2. 西安外事学院,陕西 西安 710077;
3. 陕西省眼科研究所,陕西 西安 710002
2. Xi'an International University, Xi'an 710077, China;
3. Shaanxi Institute of Ophthalmology, Xi'an 710002, China
白藜芦醇(resveratrol,RES)是植物界分布较广的羟基二苯乙烯类多酚化合物。作为天然抗氧化剂,它可抑制体内自由基的形成,具有抗氧化、抗肿瘤、抗炎、延缓衰老等生理活性[1, 2]。然而,水溶性差和生物利用率低限制了RES生理活性的发挥[3]。研究表明,纳米粒、胶束、脂质体等纳米尺度载体可以负载RES并形成热力学性能稳定的胶体溶液系统,改善RES在水相环境中的分布和提高对肿瘤细胞的杀伤效应[4~6]。海洛等[5]以150 nm的纳米氧化石墨烯为载体,RES负载率可达到69.5%,对乳腺癌细胞MCF-7的生长抑制率达90%。Narayanan等[6]采用脂质体负载RES,对前列腺癌细胞的生长抑制率达72%。Kumar等[7]将RES负载在金纳米粒(Au NPs)表面得到平均粒径为26.63 nm的RES-Au NPs,以肺癌细胞A549为模型进行的细胞毒性实验结果显示,当给药剂量均为10 μmol·L-1时,由Au NPs和RES处理后的细胞存活率分别为108%和80%,而由RES-Au NPs处理后的细胞存活率仅为51%。Mohanty等[8]采用RES还原HAuCl4得到平均粒径为10 nm的RES-Au NPs,将其与DOX共混得到同时负载RES及DOX的金纳米载药颗粒(DOX-RES-Au NPs)。当给药剂量均为14 μg·mL-1时,DOX-RES-Au NPs处理组的胶质瘤细胞LN 229存活率仅为24%,分别是RES-Au NPs组和DOX组的0.96倍和0.33倍。
与纳米金相比,纳米银自身具有一定的抑菌和抗肿瘤活性[9~11],通过将RES或抗肿瘤药物负载到纳米银表面,可望通过联合给药提高治疗效果。Shukla等[12]以硝酸银为前驱体、以RES为还原剂和保护剂,制备了平均粒径为21.1 nm的RES-Ag NPs,对大肠杆菌体现了良好的抑菌效果。Park等[13]以硝酸银为前驱体、RES为还原剂、十二烷基磺酸钠(SDS)为分散剂,得到平均粒径为20.8 nm的RES-Ag NPs,其对肺炎链球菌的最低抑菌浓度为28.5 μg·mL-1。袁玉国[14]等以RES为还原剂和分散剂,制备了平均粒径为20 nm的Ag NPs,并以2, 2-双氟嘧啶核苷(GEM)为抗肿瘤药物模型、以卵巢癌细胞A2780为细胞模型探究了GEM与Ag NPs联合给药的抗肿瘤效果。结果表明,当GEM与Ag NPs浓度均为50 nmol·L-1时,联合给药组(50 nmol·L-1GEM+50 nmol·L-1 Ag NPs)的细胞抑制率(75%)高于单一给药的GEM组(27%)和Ag NPs组(23%)。
研究发现,表面活性剂在纳米粒形成过程中兼具分散剂和相转移催化剂的双重作用[15]。但是,在RES-Ag NPs制备研究中鲜有以阳离子表面活性剂为分散剂和相转移催化剂的报道,将RES与Ag NPs联用对不同种类的肿瘤细胞模型进行细胞增殖抑制效果评价的报道亦较少。因此,本文尝试采用CTAB为分散剂和相转移催化剂,以RES为还原剂、硝酸银为前驱体,通过单因素实验和正交设计实验实现RES-Ag NPs的优化制备。利用纳米银的尺寸效应和RES的抗肿瘤活性,评价RES-Ag NPs对乳腺癌细胞MCF-7的细胞增殖抑制效果。
2 实验部分 2.1 试剂与材料硝酸银(AgNO3,分析纯,上海精细化工材料研究所);白藜芦醇(RES,化学纯,纯度98 %,上海思域化工科技有限公司);硼氢化钠(NaBH4,分析纯,天津福晨化学试剂厂);十六烷基三甲基溴化铵(CTAB,分析纯,国药集团试剂化学有限公司);3-(4, 5-二甲基噻唑-2)-2, 5-二苯基四氮唑溴盐(C18H16BrN5S,化学纯,阿拉丁试剂有限公司);透析袋(10 kDa,上海绿乌科技有限公司)。其他试剂均为分析纯。
2.2 主要仪器ZEN3600动态光散射粒度仪(英国马尔文仪器有限公司);UV-3600紫外分光光度计(南京华璧科学仪器有限公司);Carl Zeiss SIGMA扫描电子显微镜(德国卡尔·蔡司股份有限公司);Tecnai G2F20场发射透射电镜(美国菲达康有限公司);F50多功能酶标仪(瑞士帝肯贸易有限公司);5415D高速冷冻离心机(德国艾本德股份有限公司);Tensor 27红外光谱仪(美国布鲁克光谱仪器公司);PHS-3C型pH计(上海仪电科学仪器股份有限公司);CHA-S气浴恒温振荡器(江苏金坛市宏华仪器厂)。
2.3 实验方法 2.3.1 Ag NPs的制备避光条件下,将0.5 mL、0.01 mol·L-1 AgNO3溶液和5.0 mL、0.1 mol·L-1 CTAB溶液移入100 mL圆底烧瓶中,再加入13.9 mL超纯水搅拌10 min,逐滴滴加0.6 mL、10 mmol·L-1 NaBH4溶液。滴加完毕后于20℃水浴避光反应2 h。将所得样品于25℃、10000 r·min-1离心10 min,收集沉淀。超纯水洗涤沉淀,超声分散5 min,25℃、10000 r·min-1离心10 min,收集沉淀。反复洗涤和离心3次,得到Ag NPs。
2.3.2 RES-Ag NPs的制备将一定质量RES和CTAB溶解在20 mL、50 %乙醇水溶液中,向其中缓慢滴加一定体积1.0 mol·L-1 AgNO3溶液,恒温条件下避光回流反应一定时间。反应结束后,将所得样品于25℃、10000 r·min-1离心10 min,收集沉淀并用超纯水洗涤以去除过量的CTAB,超声分散5 min后再于25℃、10000 r·min-1离心10 min并收集沉淀,反复洗涤、离心3次。再用无水乙醇洗涤沉淀以去除未被负载的RES,超声分散5 min后再于25℃、10000 r·min-1离心10 min并收集沉淀,反复洗涤、离心3次,得到RES-Ag NPs。
以平均粒径为评价指标,采用单因素实验和正交设计实验确定所需AgNO3、RES和CTAB的投料比,并确定反应温度和反应时间。正交设计实验保持反应液中nAgNO3= 0.1 mol·L-1,根据正交表中物料摩尔比分别设置相应物质的投料量。
2.3.3 RES-Ag NPs微观形貌观测采用Carl Zeiss SIGMA扫描电子显微镜在3 kV加速电压下观测样品形貌、单分散性和尺寸分布。
取少量RES-Ag NPs于5 mL离心管内,向离心管内加入2 mL无水乙醇并超声5 min,将样品均匀滴在400目铜网上,采用Tecnai G2F20场发射透射电镜在80 kV加速电压下观测样品形貌。
2.3.4 FT-IR表征将干燥样品与KBr按1:100质量比混合均匀并压片,采用Tensor 27红外光谱仪在500~ 4000 cm-1波数表征样品的红外光谱学特征。
2.3.5 RES-Ag NPs粒径与zeta电位测试采用超纯水将所得纳米粒稀释适当倍数,移取2 mL溶液置于ZEN3600型马尔文动态光散射粒度仪测定池中,25℃测定样品平均粒径、粒径分布和zeta电位。
2.3.6 RES-Ag NPs中RES负载量的测定标准曲线测定:以无水乙醇为溶剂,逐级稀释法配制浓度为0.0625、0.125、0.25、0.5和1.0 mmol·L-1的RES标准溶液。采用UV-3600紫外分光光度计于298 nm测定溶液吸光度值,以浓度C为自变量、吸光度值A298为因变量,对测定结果拟合的标准曲线方程为:
称重3只干燥至恒重的1.5 mL离心管,将平均重量记为W0。将RES-Ag NPs样品溶于无水乙醇,准确将3份1000 μL样品溶液移入上述称重的离心管,将离心管置于50℃恒温干燥箱至管内溶液完全干燥,称重,将平均重量记为Wt。待测纳米银样品的平均重量为
向上述含有干燥样品的离心管中加入1000 μL无水乙醇,使样品完全溶解。采用UV-3600紫外分光光度计于308 nm波长处测定溶液吸光度值,利用标准曲线计算溶液中RES含量C(mmol·L-1)。利用式(1)计算RES-Ag NPs的RES负载量E(mg RES·(mg NPs)-1)。
| $ E = \frac{{C \cdot V \cdot 228}}{{\Delta W}} $ | (1) |
式中,V为样品溶液体积,mL;228为RES的相对分子质量。
2.3.7 体外释药实验采用透析袋释药法。按照2.3.6节中方法测定干燥RES-Ag NPs样品中的RES负载量E0。准确称量六份5.0 mg该纳米粒样品并加入10 mL试管中,记为A、B、C、D、E、F、G六组。其中,A、B、C三组分别加入5 mL、pH 5.4且H2O2浓度分别为0、5、25 μmol·L-1的磷酸盐缓冲液,D、E、F三组分别加入5 mL、pH 7.2且H2O2浓度为0、5、25 μmol·L-1的磷酸盐缓冲液。超声分散5 min后将其分别移入6只截留分子量为10 kDa的透析袋中,再将透析袋转移至盛有80 mL对应缓冲液的锥形瓶中,于37℃、150 r·min-1摇床中进行释放实验。隔时从锥形瓶中移取2 mL溶液并补加2 mL相应新鲜缓冲液,于298 nm波长处测定溶液吸光度值并根据RES标准曲线方程计算释放介质中RES的含量Ct,根据式(2)计算纳米粒中RES释放率(εt)。以释放时间为横坐标,以RES释放率为纵坐标,绘制释放曲线。
| $ {\varepsilon _{\rm{t}}}(\% ) = \frac{{({C_{\rm{t}}} \cdot {V_{\rm{t}}} + \sum\nolimits_{\rm{t}}^{{\rm{t}} - 1} {{C_{\rm{i}}} \cdot {V_{\rm{i}}}) \times 228} }}{{{E_0} \times 5}} \times \% $ | (2) |
式中,Ct为t时刻释放介质中RES的浓度;Vt为释放介质的总体积;Ci为ti时刻移取释放介质中RES的浓度;Vi为ti时移取的释放介质体积;E0为RES-Ag NPs药物负载量;228为RES相对分子质量。
2.3.8 细胞毒性实验无菌操作条件下,采用0.25 %胰蛋白酶消化对数生长期MCF-7细胞,2000 r·min-1离心5 min收集细胞。采用新鲜DMEM培养液悬浮细胞并计数,配制细胞悬液使细胞浓度为5×103个·mL-1。
在96孔板上设置空白组、RES对照组、Ag NPs对照组、RES+Ag NPs联合给药组和RES-Ag NPs实验组。空白组加入100 μL细胞悬液和100 μL新鲜DMEM培养液,对照组、联合给药组和实验组各设计8个样品浓度(5、10、15、20、25、30、35、40 μg·mL-1),每个浓度设置6个复孔,各孔均加入100 μL细胞悬液和100 μL样品溶液。将96孔板置于37℃、5% CO2培养箱中培养24 h后移除培养液,各孔加入5 mg·mL-1 MTT溶液100 μL,37℃、5% CO2培养箱中孵育4 h。倾去MTT溶液,各孔加入100 μL DMSO溶液以溶解甲瓒。采用酶标仪于490 nm测定吸光度值,根据式(3)计算细胞存活率(ɷ)。
| $ \varpi (\% ) = \frac{{{A_{{\rm{treated}}}}}}{{{A_{{\rm{blank}}}}}} \times 100\% $ | (3) |
式中,Ablank为空白组吸光度值;Atreated为各处理组吸光度值。
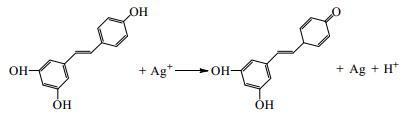
3 结果与讨论 3.1 RES-Ag NPs制备工艺原理利用反式RES分子结构中4’-酚羟基还原特性,RES还原AgNO3制备纳米银反应如式(4)所示。
|
(4) |
据报道,在RES与Ag+的氧化还原反应中,RES被氧化为醌式结构,银离子被还原成单质银[16~18]。由于银原子外层电子排布可由4d105s1形成5sp3杂化空轨道,而氧化态RES分子中的4’-羰基氧原子可提供孤对电子,二者具有形成配位键的能力。同时,反应体系中过量加入的还原态RES也能通过分子中的羟基氧原子与银晶核配位结合[18]。晶核表面RES分子层的形成,既实现了药物的高效负载又避免了银纳米粒因相互碰撞造成的聚集,有效维持了RES-Ag NPs在纳米尺度上的良好分布[12, 14]。
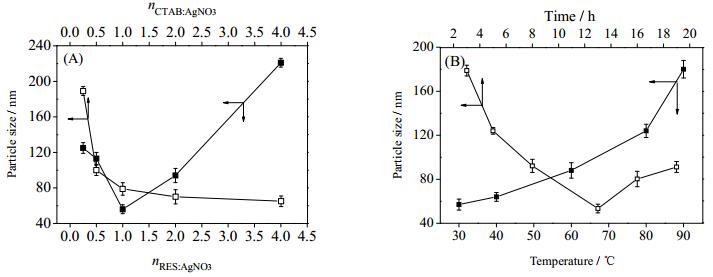
3.2 RES-Ag NPs尺寸相关制备因素本文研究了RES与AgNO3摩尔比(nRES:AgNO3)、CTAB与AgNO3摩尔比(nCTAB:AgNO3)、反应温度(T)和反应时间(t)对RES-Ag NPs平均粒径的影响。
保持nCTAB:AgNO3=2,当CAgNO3=0.1 mol·L-1、T=50℃及t=8 h时,nRES:AgNO3对平均粒径的影响如图 1(A)所示。当nRES:AgNO3<1时,体系中还原形成的银原子(Ag0)浓度较低,晶核数量较少。此时晶核生长形成Ag NPs比Ag0聚集产生新的晶核耗能更少,故体系中生成的Ag0主要在晶核表面吸附沉积,引起晶核生长。当nRES:AgNO3= 1时,增加的RES促进还原Ag+生成的Ag0在短时间内爆炸式成核,消耗了体系中大量的Ag+,用于银晶核生长的Ag+数量减少,易于获得小粒径的银颗粒。与此同时,RES分子在晶核上结合的数量增多,颗粒间空间位阻增大,使粒径减小至56.3 nm。当nRES:AgNO3>1时,溶液中Ag+过饱和度减小,银晶核成核速率减慢,晶核生长过程所需单质银的数量相对增加,颗粒粒径增大,说明减小硝酸银浓度有助于晶核生长。在此基础上,当nRES:AgNO3=1、T=50 ℃和t= 8 h时,图 1(A)进一步显示了nCTAB:AgNO3对平均粒径的影响。结果表明,nCTAB:AgNO3由0.25增大至1时,RES-Ag NPs的平均粒径显著减小。在纳米粒形成过程中,CTAB兼具分散剂和相转移催化剂的双重作用,CTAB分子通过疏水链结合还原态RES并将之携带由醇相进入水相,增大了RES与Ag+接触机率,促进反应进行;反应结束后CTAB亲酯端与氧化态RES分离并重复催化反应[15]。同时,RES分子在银晶核表面的结合亦为CTAB分子提供了附着表面,使之在纳米粒表面形成疏水链向内、亲水端向外的定向排列结构,有效阻止了银颗粒之间的碰撞聚集。因此,增加反应体系中的CTAB含量,有利于形成小尺寸纳米粒。随着银纳米晶核周围的胶束结构逐渐达到饱和状态,继续增加CTAB含量对Ag NPs粒径的影响不再显著。
|
图 1 nRES:AgNO3与nCTAB:AgNO3 (A)、反应温度与反应时间(B)对RES-Ag NPs平均粒径的影响 Fig.1 Effects of nRES:AgNO3 and nCTAB:AgNO3 (A), temperature and reaction time (B) on average size of RES-Ag NPs |
由图 1(B)可见,当nRES:AgNO3:CTAB=1、t=8 h时,纳米粒平均粒径与反应温度T呈正相关关系,这是由于升高反应温度可加快RES还原AgNO3的速率并持续生成Ag0。由于体系中已有晶核表面张力大, 强烈吸引作用使Ag0在晶核表面附着并使晶核长大。同时,温度升高会加快颗粒间的布朗运动,增加了团聚几率。另外,图 1(B)还显示了在nRES:AgNO3:CTAB=1、T = 50℃条件下Ag NPs平均粒径随反应时间延长呈现先减小后增大的趋势。在反应初期,反应体系中还原生成的银原子浓度较小,形成的晶核数量少,银原子在低浓度条件下更易于在已有晶核表面沉积而不是形成新的团簇,此阶段具有颗粒数量少、平均尺寸较大的特点。随着反应时间的延长,在RES的还原作用下,溶液中Ag0浓度持续增大并趋向形成数量更多的晶核,使得在晶核表面沉积的Ag0数量相对减少,表现为纳米粒平均粒径减小。随着反应时间进一步延长,AgNPs浓度不断增大,粒子之间的碰撞几率增加[19]。另外,在AgNPs颗粒成长期间伴随着奥斯特瓦尔德熟化过程(Ostwaldripening),较小尺寸AgNPs溶解并释放的Ag0重新在较大粒径AgNPs表面生长,导致AgNPs平均粒径随反应时间延长而增大并均一化[20]。随着反应的进行,溶液中Ag+逐渐被消耗,Ag0生成速度变慢,晶核生长速度降低。
3.3 正交设计实验优化制备工艺条件肿瘤组织具有血管丰富且内皮结构不连续的特点,使载药纳米粒在EPR(enhanced permeability and retention effect)效应作用下易于通过血液循环系统在肿瘤组织富集[21, 22]。研究表明,粒径小于100 nm的纳米颗粒主要通过内吞作用进入细胞,减小纳米粒子的尺寸可以促进其进入肿瘤细胞发挥疗效[23, 24]。在单因素实验基础上,以平均粒径为评价指标进行的四因素四水平正交设计实验结果如表 1所示。结果表明,各实验组获得的纳米粒均具有较小的PDI值和粒径分布区间;四个实验因素对纳米粒平均粒径的影响显著性顺序为nRES:AgNO3>T>nCTAB:AgNO3>t;经过工艺优化,制备最小平均粒径纳米银的条件为:nRES:AgNO3 = 1,nCTAB:AgNO3 = 0.5,T=40℃,t=13 h。在此条件下重复三次实验获得RES-Ag NPs的平均粒径为(45.5±2) nm。本文以该样品为研究对象,对RES-Ag NPs进行结构和性能的表征与评价。
|
|
表 1 L16(44)正交实验结果与分析 Table 1 Experimental results and analysis of orthogonal design L16 (44) |
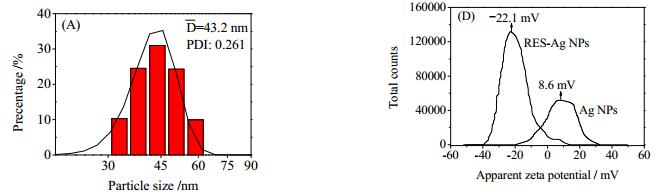
RES-Ag NPs的SEM与TEM微观形貌测定结果如图 2所示,其平均粒径及粒径分布、表面电位测定结果如图 3所示。结果表明,RES-Ag NPs球形度优良,单分散性好,尺寸分布均匀且粒径分布范围为40~50 nm。与未负载RES的Ag NPs相比,RES-Ag NPs的表面电位由+8.6 mV改变为-22.1 mV。这是由于CTAB分子的阳离子极性端构成的胶束表层赋予Ag NPs具有正电性表面电位;当RES负载在纳米颗粒上时,分子中4’-酚羟基部分解离使RES分子携带负电性氧原子,增大的表面电位绝对值改善了纳米颗粒单分散性。

|
图 2 RES-Ag NPs的SEM (A)与TEM (B)形貌观测结果 Fig.2 SEM (A) and TEM micrographs (B) of RES-Ag NPs |
|
图 3 RES-Ag NPs的粒径分布(A)与表面电位(B)测定结果 Fig.3 Size distribution (A) and zeta potential values (B) of RES-Ag NPs |
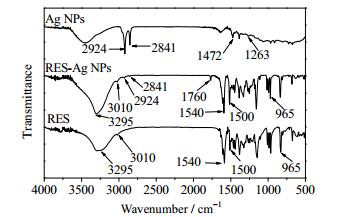
图 4为RES、Ag NPs和RES-Ag NPs的红外光谱测定结果。RES的红外图谱可见,3295 cm-1处为酚羟基伸缩振动峰,3010 cm-1处为苯环上C-H伸缩振动峰,1540和1500 cm-1处为苯环的特征峰,1154 cm-1处为-C-O伸缩振动峰,965 cm-1处为-C=C-伸缩振动峰,830 cm-1处为苯环-C-H面外弯曲振动峰。在Ag NPs的红外图谱中,2924和2841 cm-1处为C-H伸缩振动峰,1472和1381 cm-1处为C-H弯曲振动峰,1263 cm-1处为C-N伸缩振动峰,说明Ag NPs上负载有CTAB分子。在RES-Ag NPs的红外谱图中,在3295、1540、1500和965 cm-1保留了RES的特征峰,同时在1760 cm-1处出现新的C=O吸收,表明RES分子中酚羟基被氧化为羰基结构。另外,由于RES的配位键合作用减弱了CTAB在银粒上的结合作用力,RES-Ag NPs在2924和2841 cm-1处的C-H伸缩振动吸收减弱,表明CTAB作为相转移催化剂在后处理中被洗涤分离去除,纳米银颗粒中CTAB残存量少。
|
图 4 RES、Ag NPs和RES-Ag NPs的红外光谱 Fig.4 FTIR spectra of RES, Ag NPs and RES-Ag NPs |
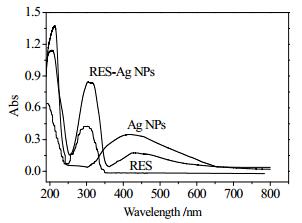
图 5为RES、Ag NPs和RES- Ag NPs的紫外吸收光谱。结果表明,RES- Ag NPs在308、416 nm分别出现了RES和Ag NPs的特征吸收峰,表明RES成功负载到纳米银颗粒上。在RES- Ag NPs制备过程中,RES分子4’-酚羟基中的氧原子与纳米银表面银原子上一个空轨道发生配位[25],导致RES-Ag NPs表面的RES电子离域程度增加,致使电子跃迁所需能量降低[26]。同时,RES分子中4’-酚羟基氧化为醌氧结构,芳环中大π键的π-π共轭转变为C-C键的n-π共轭,氧化态RES分子的共轭程度增加及表面未被氧化的RES电子离域程度增加导致特征吸收位置从298 nm红移至308 nm。因此,本文在308 nm处测定最优工艺条件制备的RES-Ag NPs吸光度值,根据RES标准曲线计算纳米银上RES的负载量为0.0883 mg·mg-1。
|
图 5 RES、Ag NPs和RES-Ag NPs紫外吸收图谱 Fig.5 UV absorption spectra of RES, Ag NPs and RES-Ag NPs |
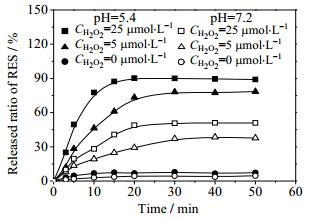
H2O2含量较高[27, 28]与弱酸性(pH=5.3~5.5)是肿瘤细胞内环境的重要特征。因此,可将氧化应激作为一种内源性刺激用于药物释放体系。研究表明,当肿瘤细胞通过小窝蛋白介导的内吞作用将RES-Ag NPs吞入后,胞内较高水平的H2O2可将载体中的单质银氧化并释放RES[23]。因此,本文在pH=5.4的PBS缓冲液中加入双氧水以模拟肿瘤细胞内的H2O2环境,研究RES-Ag NPs在环境因素刺激下的药物释放行为。由图 6可见,当CH2O2=0 μmol·L-1时,RES-Ag NPs的RES释放率仅为7.5%;将CH2O2增大至5和25 μmol·L-1时,在30 min内RES释放率分别达到77%和89%,表明RES-Ag NPs对环境中H2O2刺激具有敏感的响应性。另外,在pH=7.2的PBS缓冲液中,当H2O2浓度分别为0、5和25 μmol·L-1时,RES-Ag NPs在30 min内的释放率相应为3.4%、37%和48%,表明RES-Ag NPs具有H2O2敏感响应的RES释放特征。
|
图 6 pH与H2O2对RES-AgNPs中RES释放行为的影响 Fig.6 RES release profiles of RES-Ag NPs under hydrogen peroxide and pH stimulation |
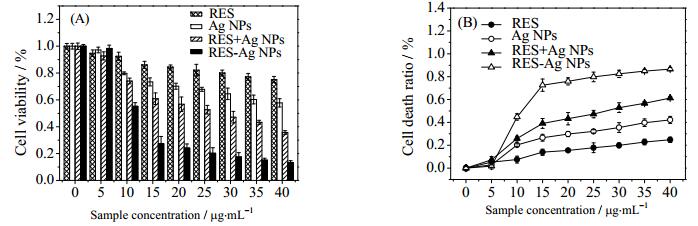
以乳腺癌细胞MCF-7为肿瘤细胞模型,采用MTT法评价RES-Ag NPs对肿瘤细胞的杀伤效应,由图 7(A)可知,RES-Ag NPs组对肿瘤细胞的生长抑制作用具有显著的剂量依赖效应。当实验各组样品剂量均为15 μg·mL-1时,RES-Ag NPs组的细胞存活率比RES组、Ag NPs组和RES+Ag NPs联合给药组分别降低了68.2 %、62.6 %和55.1 %;当样品剂量均为40 μg·mL-1时,RES-Ag NPs组的细胞存活率比RES组、Ag NPs组、RES+Ag NP联合给药组分别降低了82.2 %、76.8 %和62.5 %。
|
图 7 RES、Ag NPs和RES-Ag NPs对MCF-7的细胞杀伤效应 Fig.7 Cytotoxicity effects of RES, Ag NPs and RES-Ag NPs on MCF-7 cells (A) cell viability (B) cell death ratio |
图 7(B)进一步表明,当样品加入剂量自5 μg·mL-1增加至15 μg·mL-1时,RES-Ag NPs组中的细胞死亡率由1.7 %增加至72.6%。而RES组、Ag NPs组、RES+Ag NPs联合给药组的细胞死亡率仅相应增加了8.7%、23.8%和31.9%,表明载药纳米银颗粒中RES与银纳米粒具有更强的协同增强的肿瘤细胞杀伤效应。研究表明,粒径范围为10~60 nm的纳米粒子主要通过胞吞胞吐机制进出细胞[23, 24]。纳米制剂的剂量较小时,细胞对纳米粒的胞吞速率大于胞吐速率。随着剂量不断增加,细胞的胞吞与胞吐速率接近平衡状态,导致细胞死亡速率降低。考虑到高剂量纳米银对正常组织和细胞可能存在蓄积毒性风险[29],在保证良好的肿瘤细胞杀伤效应前提下,选择RES-Ag NPs的适宜给药剂量为15 μg·mL-1。
4 结论本文利用RES的还原特性,采用液相还原法制备了负载白藜芦醇的纳米银颗粒,所制备的RES-Ag NPs球形度好且粒径分布均一。通过单因素实验分析了主要制备参数对RES-Ag NPs平均粒径的影响规律和作用机理。通过正交设计实验优化了制备条件,当AgNO3,RES和CTAB的摩尔比为1:1:0.5, 40 ℃下反应13 h时,制备得到平均粒径为(45.5± 2) nm、RES负载量为0.0883 mg·mg-1的RES-Ag NPs。体外释放实验表明RES-Ag NPs在模拟肿瘤细胞内环境下具有较快的释放特征。MTT实验结果表明,RES-Ag NPs对人乳腺癌细胞MCF-7具有明确的协同杀伤效应。当纳米颗粒剂量为15 μg·mL-1时,与RES组、Ag NPs组和RES+Ag NPs联合给药组相比,RES-Ag NPs组的细胞死亡率分别增加了58.7%、46%和40.7%。本文工作的开展,为发展新型高效抗肿瘤纳米药物提供了有益的实验基础支撑。
| [1] | Pangeni R, Sahni J K, Ali J, et al. Resveratrol:review on therapeutic potential and recent advances in drug delivery[J]. Expert Opinion on Drug Delivery, 2014, 11(8): 1285-1298. DOI:10.1517/17425247.2014.919253. |
| [2] | Malhotra A, Bath S, Elbarbry F. An organ system approach to explore the antioxidative, anti-Inflammatory, and cytoprotective actions of resveratrol[J]. Oxidative Medicine & Cellular Longevity, 2015, 2015(1-2): 1-15. |
| [3] | Guerrero R F, Garcíaparrilla M C, Puertas B, et al. Wine, resveratrol and health:a review[J]. Natural Product Communications, 2009, 4(5): 635-658. |
| [4] | Hung C F, Chen J K, Liao M H, et al. Development and evaluation of emulsion-liposome blends for resveratrol delivery[J]. Journal of Nanoscience & Nanotechnology, 2006, 6(9-10): 2950-2958. |
| [5] | Hai L, He D, He X, et al. Facile fabrication of a resveratrol loaded phospholipid@reduced graphene oxide nanoassembly for targeted and near-infrared laser-triggered chemo/photothermal synergistic therapy of cancer in vivo[J]. Journal of Materials Chemistry B, 2017, 5(29): 5783-5792. DOI:10.1039/C7TB01600J. |
| [6] | Narayanan K N, Nargi D, Randolph C, et al. Liposome encapsulation of curcumin and resveratrol in combination reduces prostate cancer incidence in PTEN knockout mice[J]. International Journal of Cancer, 2009, 125(1): 1-8. DOI:10.1002/ijc.v125:1. |
| [7] | Kumar C G, Poornachandra Y, Mamidyala S K. Green synthesis of bacterial gold nanoparticles conjugated to resveratrol as delivery vehicles[J]. Colloids Surf B Biointerfaces, 2014, 123(2): 311-317. |
| [8] | Mohanty R K, Thennarasu S, Mandal A B. Resveratrol stabilized gold nanoparticles enable surface loading of doxorubicin and anticancer activity[J]. Colloids Surf B Biointerfaces, 2014, 114(2): 138-143. |
| [9] | Valodkar M, Jadeja R N, Thounaojam M C, et al. In vitro, toxicity study of plant latex capped silver nanoparticles in human lung carcinoma cells[J]. Materials Science & Engineering C, 2011, 31(8): 1723-1728. |
| [10] | Rajan R, Chandran K, Harper S L, et al. Plant extract synthesized silver nanoparticles:an ongoing source of novel biocompatible materials[J]. Industrial Crops & Products, 2015, 70: 356-373. |
| [11] | Li J, You J, Dai Y, et al. Gadolinium oxide nanoparticles and aptamer-functionalized silver nanoclusters-based multimodal molecular imaging nanoprobe for optical/magnetic resonance cancer cell imaging[J]. Analytical Chemistry, 2014, 86(22): 11306-11311. DOI:10.1021/ac503026d. |
| [12] | Shukla S P, Roy M, Mukherjee P, et al. Size selective green synthesis of silver and gold nanoparticles:enhanced antibacterial efficacy of resveratrol capped silver sol[J]. Journal of Nanoscience & Nanotechnology, 2016, 16(3): 2453-2463. |
| [13] | Park S, Cha S H, Cho I, et al. Antibacterial nanocarriers of resveratrol with gold and silver nanoparticles[J]. Materials Science & Engineering C Materials for Biological Applications, 2016, 58: 1160-1169. |
| [14] | Yuan Y G, Peng Q L, Gurunathan S. Silver nanoparticles enhance the apoptotic potential of gemcitabine in human ovarian cancer cells:combination therapy for effective cancer treatment[J]. Int J Nanomedicine, 2017, 12: 6487-6502. DOI:10.2147/IJN. |
| [15] | Starks C M. Phase-transfer catalysis. I. Heterogeneous reactions involving anion transfer by quaternary ammonium and phosphonium salts[J]. Journal of the American Chemical Society, 1971, 93(1): 195-199. DOI:10.1021/ja00730a033. |
| [16] | Wright J S, Johnson E R, Dilabio G A. Predicting the activity of phenolic antioxidants:theoretical method, analysis of substituent effects, and application to major families of antioxidants[J]. Journal of the American Chemical Society, 2001, 123(6): 1173-1183. DOI:10.1021/ja002455u. |
| [17] | Zhang X C, Yang Q. Antioxidant effect of resveratrol and its control effect on related diseases[J]. Hans Journal of Food and Nutrition Science, 2017, 06(2): 59-64. DOI:10.12677/HJFNS.2017.62006. |
| [18] | Vongsvivut J, Robertson E G, Mcnaughton D. Surface-enhanced Raman scattering spectroscopy of resveratrol[J]. Australian Journal of Chemistry, 2009, 61(12): 921-929. |
| [19] | Darroudi M, Ahmad M B, Zamiri R, et al. Preparation and characterization of gelatin mediated silver nanoparticles by laser ablation[J]. Journal of Alloys & Compounds, 2011, 509(4): 1301-1304. |
| [20] | Agnihotri , Mukherji S. Antimicrobial chitosan-PVA hydrogel as a nanoreactor and immobilization matrix for silver nanoparticles[J]. Applied Nanoscience, 2012, 2(3): 179-188. DOI:10.1007/s13204-012-0080-1. |
| [21] | Nakamura H, Jun F, Maeda H. Correction to:development of next-generation macromolecular drugs based on the EPR effect:challenges and pitfalls[J]. Expert Opinion on Drug Delivery, 2015, 12(1): 53-64. DOI:10.1517/17425247.2014.955011. |
| [22] | Danhier F. To exploit the tumor microenvironment:since the EPR effect fails in the clinic, what is the future of nanomedicine?[J]. Journal of Controlled Release, 2016, 244(Pt A): 108-121. |
| [23] | Chithrani B D, Chan W C. Elucidating the mechanism of cellular uptake and removal of protein-coated gold nanoparticles of different sizes and shapes[J]. Nano Letters, 2007, 7(6): 1542-1550. DOI:10.1021/nl070363y. |
| [24] | Sakhtianchi R, Minchin R F, Lee K B, et al. Exocytosis of nanoparticles from cells:role in cellular retention and toxicity[J]. Advances in Colloid & Interface Science, 2013, 201-202(4): 18-29. |
| [25] | JIANG Zhao-hua(姜兆华), SUN De-zhi(孙德智), SHAO Guang-jie(邵光杰), et al. Applied Surface Chemistry(应用表面化学与技术)[M].Harbin(哈尔滨): Harbin Institute of Technology Press(哈尔滨工业大学出版社), 2000. |
| [26] | GUO Ming(郭明), WU Zhou-ling(伍周玲), WANG Chun-ge(王春歌), et al. Synthesis and anti-tumor activity of baicalin-metal complex(黄芩苷-金属配合物的合成及其抗肿瘤活性研究)[J]. Acta Pharmaceutica Sinica(药学学报), 2014(3): 337-345. DOI:10.3969/j.issn.1008-7303.2014.03.14. |
| [27] | CHEN Wei-ju (谌委菊). Study on multifunctional mesoporous silica nanoparticles for targeted drug delivery (多功能介孔硅纳米材料的设计及其用于靶向药物释放的研究)[D]. Changsha (长沙): Hunan University (湖南大学), 2014. |
| [28] | Wlassoff W A, Albright C D, Sivashinski M S, et al. Hydrogen peroxide overproduced in breast cancer cells can serve as an anticancer prodrug generating apoptosis-stimulating hydroxyl radicals under the effect of tamoxifen-ferrocene conjugate[J]. Journal of Pharmacy & Pharmacology, 2007, 59(11): 1549-1553. |
| [29] | Kawata K, Osawa M, Okabe S. In vitro toxicity of silver nanoparticles at no cytotoxicdoses to HepG2 human hepatoma cells[J]. Environmental Science & Technology, 2009, 43(15): 6046-6051. |




