全球气候变暖是当前人类面临的最严峻挑战,已对全球范围内环境、科学、经济以及政治等产生深远的影响。CO2作为对温室效应影响最大的气体物质得到广泛的关注,削减和控制其排放是能源与化工等行业亟须解决的问题。CO2捕集与封存(CCS)作为全球应对气候变化的重要战略,是我国履约减排任务、应对未来挑战的重要技术选择之一。化学吸收法碳捕集是短期内控制能源、化工等领域CO2排放最为有效的方法[1-2]。其中,以氨水为吸收剂的碳捕集具有能耗低、CO2负载高、吸收剂氧化降解低、无腐蚀等显著优点,近年来受到广泛关注。
但是,由于氨水的易挥发特性,吸收过程中容易发生氨逃逸现象,造成氨水浓度的下降,影响循环吸收效果。同时,氨在热再生过程中损失更明显。Resnik等[3]在半连续吸收、解吸循环试验中发现,当氨水质量分数为14% 时,总氨损失可达43.1%,且损失量会随着再生温度的升高而进一步增大。为了降低氨逃逸,大量研究均是针对低浓度氨水(氨的质量分数为4%~6%)进行工艺设计与开发。Dave等[4]指出:为了控制氨的逃逸,氨水浓度不能超过5%,且吸收温度不能高于10 ℃。然而,在常温下氨水吸收CO2的反应速率常数比一乙醇胺(MEA)要低1/9左右,相比其他吸收剂如羟乙基乙二胺(AEEA)、乙二胺(EDA)、二乙烯三胺(DETA)以及吡嗪酰胺(PZ)的反应速率更低[5]。在实验条件下,CO2与氨水的反应速率和液相氨浓度的平方呈正比[6],这意味着提高氨水浓度不仅可以提升其与CO2的反应速率,同时可以大大降低装置的尺寸,而且提高氨水浓度还可以降低再生能耗。Ullah等[7]将贫液氨质量分数从4% 增加到6.5% 时,再生能耗从每千克CO2 4.88 MJ降低到3.66 MJ。Darde等[8]更是指出,当氨质量分数达到28% 时,CO2的再生能耗可以低至每千克CO2 2.05 MJ。
然而,高浓度氨水虽然可以实现CO2的高效脱除和低再生能耗的目的,但由于较高的氨逃逸速率,难以满足低损失循环的要求。当前研究虽指出高浓度氨水在CO2再生能耗方面具有优势,但均未考虑逃逸氨的处理方式及其能耗对整体性能的影响,也缺乏氨在高浓度条件下工艺参数的选择。因此,本研究采用Aspen Plus软件对氨法碳捕集过程进行建模,模拟了高浓度氨水捕集CO2的循环工艺流程,对比分析了低浓度氨水与高浓度氨水吸收CO2过程的氨逃逸规律与CO2再生能耗特性,优化了再生过程的工艺参数,提出了水洗法回收逃逸氨的方法,并对整体能耗进行了分析与比较。
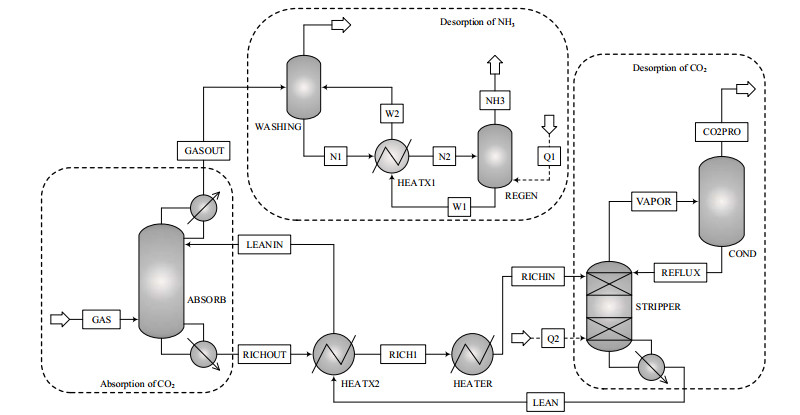
2 高浓度氨水脱碳系统模型构建 2.1 碳捕集工艺流程简述高浓度氨水碳捕集系统由CO2吸收、CO2解吸、氨水洗再生3个部分组成,具体流程如图 1所示。图中,N1、N2、W1、W2、Q1、Q2、RICHIN、CO2PRO、REFLUX、LEAN为流股。经预处理后的烟气(GAS)进入吸收塔塔底,与吸收塔(ABSORB)上部进入的贫液(LEANIN)逆流接触;被吸收后的烟气从顶部烟气出口(GASOUT)排出,进入氨水洗塔(WASHING),通过水洗方式将逃逸氨吸收,吸收后的氨水经过换热器进入氨再生塔(REGEN),再生后的氨与吸收液混合使逃逸氨得到回收利用。吸收CO2后的富CO2溶液(简称富液)从吸收塔底部富液出口(RICHOUT)流出;富液(RICH1)在进入解吸塔之前先经过一个单独的加热器,以显示加热富液所需的热量以及设定进入解吸塔的富液温度;解吸后的气体(VAPOR)从解吸塔顶部出去后,经过冷却回流,冷凝水和溶于水的氨回流至解吸塔,剩下纯度较高的CO2被排出。
|
图 1 高浓度氨法碳捕集工艺流程图 Fig.1 Flow chart of the carbon capture process using high concentration ammonia solvents |
在Aspen Plus中搭建CO2脱除工艺流程仿真模型,模型中各设备采用的模块及其操作参数设置如表 1所示。吸收塔模块采用Aspen Plus塔单元RadRrac模块。RadRrac模块是基于传质速率相平衡分离过程的真实塔板逐板计算模型,被广泛用于氨法碳捕集流程中吸收塔的模型。解吸塔采用Yu等[9]的模型,同样基于RadFrac模块,采用了6个平衡级,在第1级引入富液和冷凝回流,在第6级设置贫液离开解吸塔。
|
|
表 1 氨法碳捕集系统所采用的模块和操作参数设置 Table 1 The module and operation parameters of the ammonia carbon capture system |
氨法碳捕集过程是CO2与氨水溶液中的碱性基团发生化学反应,生成新的化合物,解吸过程是一个分解反应[10]。在运用Aspen Plus对氨法碳捕集进行建模中,明确化学组成尤为重要,表 2列出了氨法碳捕集过程的化学组成。
|
|
表 2 模型的化学组成 Table 2 Chemical compositions of modules |
模型采用电解质NRTL和RK状态方程分别计算液相和气相的性质[11]。亨利定律适用于计算CO2、NH3、N2、O2的溶解度,在反应计算中,亨利组分的活度系数基础选择为水溶液[7],从Aspen Plus数据库中,检索CO2和水的亨利定律常数以及其他含水的亨利组分的亨利定律常数。
氨法碳捕集的吸收与再生过程有很多研究,普遍认为该过程中发生的化学反应通常用动力学反应模型来描述[12]。CO2与NH3和CO2与OH−的反应是动力学控制的,而其他的反应都是化学平衡反应。
模型涉及的化学平衡反应有:
| $ {\text{2}}{{\text{H}}_{\text{2}}}{\text{O}} \leftrightarrow {{\text{H}}_{\text{3}}}{{\text{O}}^{\text{ + }}}{\text{ + O}}{{\text{H}}^ - } $ | (1) |
| $ {\text{N}}{{\text{H}}_{\text{3}}}{\text{ + }}{{\text{H}}_{\text{2}}}{\text{O}} \leftrightarrow {\text{N}}{{\text{H}}_{\text{4}}}^{\text{ + }}{\text{ + O}}{{\text{H}}^ - } $ | (2) |
| $ {\text{C}}{{\text{O}}_{\text{2}}}{\text{ + 2}}{{\text{H}}_{\text{2}}}{\text{O}} \leftrightarrow {{\text{H}}_{\text{3}}}{{\text{O}}^{\text{ + }}}{\text{ + HC}}{{\text{O}}_{\text{3}}}^ - $ | (3) |
| $ {\text{N}}{{\text{H}}_{\text{3}}}{\text{ + HC}}{{\text{O}}_{\text{3}}}^ - \leftrightarrow {{\text{H}}_{\text{2}}}{\text{O + N}}{{\text{H}}_{\text{2}}}{\text{CO}}{{\text{O}}^ - } $ | (4) |
| $ {\text{HC}}{{\text{O}}_{\text{3}}}^ - {\text{ + }}{{\text{H}}_{\text{2}}}{\text{O}} \leftrightarrow {{\text{H}}_{\text{3}}}{{\text{O}}^{\text{ + }}}{\text{ + C}}{{\text{O}}_{\text{3}}}^{{\text{2}} - } $ | (5) |
| $ {\text{N}}{{\text{H}}_{\text{4}}}{\text{HC}}{{\text{O}}_{\text{3}}}{\text{(S)}} \leftrightarrow {\text{N}}{{\text{H}}_{\text{4}}}^{\text{ + }}{\text{ + HC}}{{\text{O}}_{\text{3}}}^ - $ | (6) |
反应平衡常数用式(7)计算:
| $ \ln {K_{{\rm{eq}}, j}} = a + \frac{b}{T} + c\ln T + dT + e\left( {\frac{{p - {p_{{\rm{ref}}}}}}{{{p_{{\rm{ref}}}}}}} \right) $ | (7) |
式中:Keq, j为反应j的平衡常数;T为热力学温度,K;p为反应压力,Pa;pref为参考状态点压力,Pa;系数a、b、c、d、e由Aspen Plus根据实验结果拟合得到。
模型涉及的动力学反应有:
| $ {\text{N}}{{\text{H}}_{\text{3}}}{\text{ + C}}{{\text{O}}_{\text{2}}}{\text{ + }}{{\text{H}}_{\text{2}}}{\text{O}} \to {{\text{H}}_{\text{3}}}{{\text{O}}^{\text{ + }}}{\text{ + N}}{{\text{H}}_{\text{2}}}{\text{CO}}{{\text{O}}^ - } $ | (8) |
| $ {{\text{H}}_{\text{3}}}{{\text{O}}^{\text{ + }}}{\text{ + N}}{{\text{H}}_{\text{2}}}{\text{CO}}{{\text{O}}^ - } \to {\text{N}}{{\text{H}}_{\text{3}}}{\text{ + C}}{{\text{O}}_{\text{2}}}{\text{ + }}{{\text{H}}_{\text{2}}}{\text{O}} $ | (9) |
| $ {\text{C}}{{\text{O}}_{\text{2}}}{\text{ + O}}{{\text{H}}^ - } \to {\text{HCO}}_{\text{3}}^ - $ | (10) |
| $ {\text{HCO}}_{\text{3}}^ - \to + {\text{C}}{{\text{O}}_{\text{2}}} + {\text{O}}{{\text{H}}^ - } $ | (11) |
动力学反应速率用Aspen Plus中的幂律方程式(12)表示:
| $ {r_j} = {k_j}{(\frac{T}{{{T_0}}})^n}{\exp _{}}\left[ {\left( {\frac{{ - {E_j}}}{R}} \right)\left( {\frac{1}{T} + \frac{1}{{{T_0}}}} \right)} \right]\prod\limits_{i = 1}^N {{{\left( {{\chi _i}{\gamma _i}} \right)}^{{\alpha _i}}}} $ | (12) |
式中:
|
|
表 3 动力学反应参数 Table 3 Parameters of reaction kinetics |
模拟烟气选择一座600 MW的典型燃煤电厂,经过脱硫脱硝后的烟气参数如表 4所示[11]。烟气流率为915 kg⋅h−1,压力为103 kPa,模拟烟气中CO2、N2、O2的体积分数分别为5%、81%、4%。
|
|
表 4 烟气条件 Table 4 Flue gas conditions |
碳负载是影响再生能耗的重要因素,碳负载是溶液中所承载的CO2量的一个数值,用溶液中碳元素的浓度c(CO2)与氮元素的浓度c(NH3)的比值表示[11],单位为mol⋅mol−1,如式(13):
| $ {\text{C}}{{\text{O}}_{\text{2}}}{\text{loading = }}\frac{{c{\text{(C}}{{\text{O}}_{\text{2}}}{\text{)}}}}{{c{\text{(N}}{{\text{H}}_{\text{3}}}{\text{)}}}}{\text{ = }}\frac{{c{\text{(C}}{{\text{O}}_{\text{2}}}{\text{) + }}c{\text{(N}}{{\text{H}}_{\text{2}}}{\text{CO}}{{\text{O}}^ - }{\text{) + }}c{\text{(HC}}{{\text{O}}_{\text{3}}}^ - {\text{) + }}c{\text{(C}}{{\text{O}}_{\text{3}}}^{{\text{2}} - }{\text{)}}}}{{c{\text{(N}}{{\text{H}}_{\text{3}}}{\text{) + }}c{\text{(N}}{{\text{H}}_{\text{4}}}^{\text{ + }}{\text{) + }}c{\text{(N}}{{\text{H}}_{\text{2}}}{\text{CO}}{{\text{O}}^ - }{\text{)}}}} $ | (13) |
CO2再生能耗是解吸过程再沸器的能耗与所捕集CO2的质量的比值,单位为MJ⋅kg−1。氨再生能耗是水洗装置的再生能耗与所捕集CO2的质量的比值,单位为MJ⋅kg−1。系统整体能耗包含了CO2再生能耗、氨水洗再生能耗以及再热器的能耗,单位为MJ⋅kg−1。
2.5 模型验证为了验证模型的准确性,对吸收塔与解吸塔分别进行验证。吸收塔的验证基于Munmorah电站中试电厂的实验数据[13],其结果如表 5所示。可以看出,模拟结果与实验结果的最大相对误差在10% 以内,与Li等[14]建立的模型相比,本模型的误差更小,考虑到实验的稳定性和测量误差,可以认为模型是可靠的。
解吸塔采用Yu等[11]的模型,对解吸塔塔板温度以及各塔板气液相流率进行计算,该解吸流程运行条件如表 6所示,模型结果与文献结果的对比如表 7所示。可以看出,模型结果与文献结果基本吻合,误差较小,建立的模型较为准确。
|
|
表 6 解吸过程操作条件 Table 6 Operating conditions of the desorption process |
|
|
表 7 解吸过程模型验证[11] Table 7 Simulation verification of the desorption process |
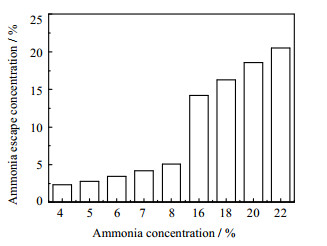
为了探究高浓度氨水下氨逃逸的变化,首先对比了高浓度(质量分数为16%~22%)和低浓度(质量分数为4%~8%)氨水在CO2吸收过程中氨的逃逸。图 2为吸收温度为25 ℃、贫液碳负载为0.2时氨逃逸的对比结果。可以看出,随着氨水浓度的升高,其氨逃逸量快速上升。例如,18% 的高浓度氨水的氨逃逸是5% 的低浓度氨水的5.8倍。本文中氨水浓度均为质量分数。
|
图 2 吸收温度为25 ℃、贫液碳负载为0.2时不同氨水吸收液下氨逃逸的对比结果 Fig.2 Comparison of ammonia escape with different ammonia concentrations under 25 ℃ and 0.2 carbon loading |
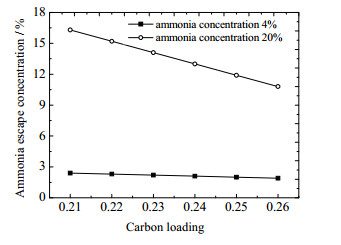
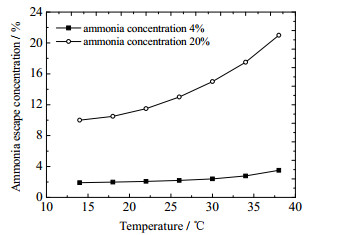
图 3显示了在吸收温度25 ℃条件下吸收塔氨逃逸浓度(体积分数)随贫液碳负载的变化。高浓度氨水与低浓度氨水吸收CO2时均呈现氨逃逸浓度随贫液碳负载的升高而下降的规律,但是高浓度下的氨水变化趋势更加明显。这是因为贫液碳负载越高,贫液中CO2的含量越大,CO2与溶液中氨的化合程度越高,溶液中游离的氨分子越少,从而使溶液的氨逃逸量越少。图 4显示了氨逃逸浓度随吸收温度的变化趋势。可以看出,高浓度氨水条件下氨逃逸对吸收温度更加敏感,吸收温度越高,氨逃逸量越大。因此,降低吸收温度有利于降低氨逃逸,但是,低温条件下氨水吸收CO2的反应速率会减弱,在选择吸收温度时应在氨逃逸与反应速率之间平衡。
|
图 3 氨逃逸浓度随贫液碳负载的变化 Fig.3 Profiles of ammonia escape concentrations as a function of carbon loading |
|
图 4 氨逃逸浓度随吸收温度的变化 Fig.4 Profiles of ammonia escape concentrations as a function of absorption temperature |
由于高浓度氨水条件下逃逸的氨浓度较高,需要设置水洗装置进行氨的脱除与再生,以保持系统氨水浓度的平衡。在吸收温度为25 ℃、贫液碳负载为0.2的条件下,对不同浓度氨水吸收CO2的水洗装置进行模拟,结果如图 5所示。可以看出,随着氨水浓度的升高,水洗过程所需的再生能耗也升高。这是因为氨逃逸量越大,所需的洗涤水量越大,氨再生塔的能量需求越多。在低浓度氨水条件下水洗装置中氨再生的能耗与CO2再生能耗相比,其占比非常低,所以目前大部分的研究中给出的捕集能耗均未考虑水洗过程的能耗;但高浓度氨水条件下由于逃逸氨的浓度较高,氨水洗装置的再生能耗成为不可忽视的部分,虽然目前文献中报道的高浓度氨水捕集CO2再生能耗更低,但在整体能耗方面还需考虑处理氨逃逸过程的能耗。
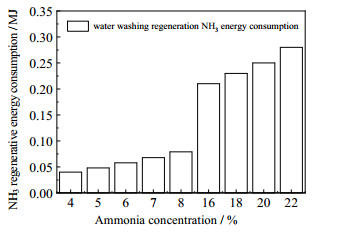
|
图 5 水洗再生NH3能耗随氨水浓度的变化 Fig.5 Profiles of energy consumption of NH3 water washing regeneration as a function of ammonia concentration |
有研究表明富液入口温度对解吸过程CO2的再生能耗有影响。为实现不同的富液入口温度,本研究在工艺流程的贫富液换热器与解吸塔之间设置再热器,以控制富液入口温度。因此,CO2再生能耗包括再热器与再沸器的能耗。
图 6显示了不同富液入口温度条件下CO2的再生能耗。可以看出,富液入口温度对CO2再生能耗的影响较大,CO2再生能耗均呈现先下降后上升的趋势,表明存在最佳的富液入口温度,使得再生能耗最小。例如,在氨水浓度为20%、碳负载为0.35时,其最佳富液入口温度为97 ℃。另外,最佳富液入口温度受氨水浓度的影响较小,受贫液CO2负载影响较大,CO2负载越大,最佳富液入口温度越低,其对应的CO2再生能耗也越小。存在最佳富液入口温度的原因是提高富液入口温度使待解吸液温度提高,有利于待解吸液在解吸塔中的解吸,降低了解吸塔的能耗,解吸塔降低的能耗高于再热器升温所需要的能耗;当富液入口温度达到某个值时,继续提高富液入口温度,能耗不再降低反而增加,这是因为待解吸液的温度升高到某个值时就会达到饱和状态,继续升高富液入口温度会造成其解吸过程在再热器中发生。
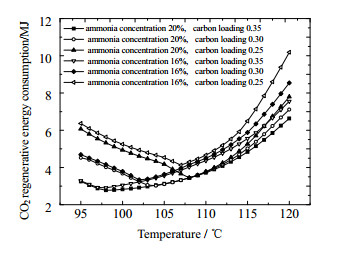
|
图 6 再热器温度与再生能耗的关系 Fig.6 Relationship between reheating temperature and regenerative energy consumption |
富液入口温度对解吸塔内的运行温度有直接影响,进而会影响解吸过程氨的逃逸,所以解吸塔出口一般设置冷凝器,用于冷凝回流水蒸气和氨。在本研究的解吸塔模型中,解吸过程的氨逃逸浓度也受富液入口温度的影响(如图 7所示)。富液入口温度不高时,氨逃逸浓度维持在10−4以内;当富液入口温度升高到一定值时,氨逃逸浓度将出现一个迅速升高的转折点,而且氨逃逸量迅速升高的温度点受氨水浓度影响较大,与碳负载关系较小。例如,当氨水浓度为20% 时,氨逃逸迅速升高的转折温度点为107 ℃左右;而当氨水浓度降低至16% 时,氨逃逸迅速升高温度点达到117 ℃左右。为了控制解吸塔的氨逃逸,富液入口温度应低于氨逃逸迅速升高的温度点。
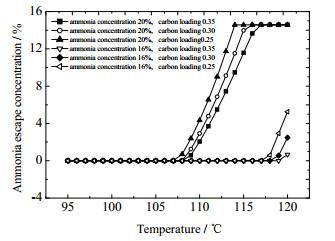
|
图 7 再热温度与解吸塔氨逃逸的关系 Fig.7 Relationship between reheating temperature and ammonia escape from desorption column |
氨逃逸迅速升高的原因是随着富液入口温度的升高,在再热器中发生的CO2解吸开始逐渐增强,导致富液进入解吸塔时氨浓度较高,在冷凝器中冷凝后达到过饱和,导致氨逃逸增大;当富液入口温度继续升高时,由于解吸塔中温度的升高,进入冷凝器的水蒸气增加,其与逃逸的氨在冷凝器中的冷凝吸收逐渐趋于平衡。
3.2.3 富液入口温度优化由于富液入口温度既影响CO2再生能耗,又影响氨逃逸量,所以需要优化富液入口温度,使得CO2再生能耗较低的同时氨逃逸处在较低的范围内。图 8显示了不同氨浓度和贫液碳负载条件下对应的最佳富液入口温度和氨逃逸量迅速升高对应温度点的关系。在高浓度氨水条件下两者均存在交叉点,说明两者存在优化的温度点。例如,在氨水浓度为20% 时,贫液碳负载不宜低于0.25,如果碳负载低于这个值,最佳富液入口温度将高于氨逃逸迅速升高所对应的温度,即在使得CO2再生能耗最小时,无法使得氨逃逸量较低。在18% 和16% 的氨水浓度时,分别对应的最低贫液碳负载为0.2和0.13。在低浓度氨水捕集CO2的过程中,则不用考虑氨水浓度与碳负载匹配的问题,这是由于氨水浓度越低,满足要求的最低贫液碳负载越小,当氨水浓度在5% 左右,最低贫液碳负载趋于0,即在任何碳负载条件下,都可以在氨逃逸量较低的条件下满足CO2再生能耗最小。
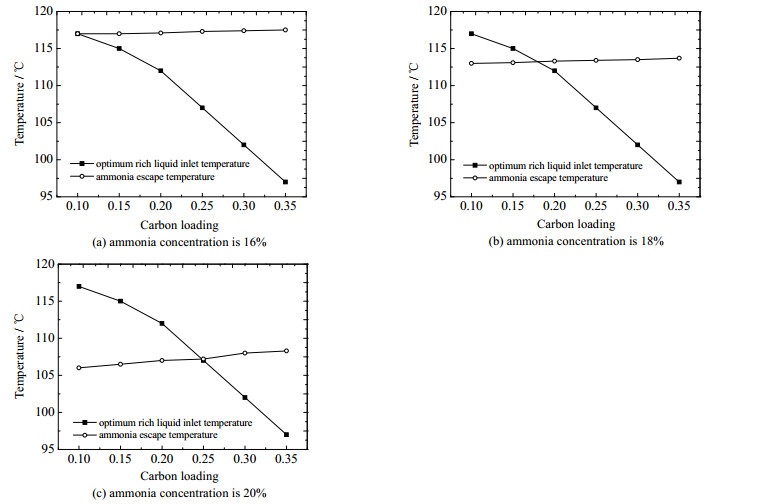
|
图 8 富液入口温度与氨逃逸温度的关系 Fig.8 Relationship between inlet temperature of rich liquid and ammonia escape temperature |
基于碳捕集模型,研究了低浓度氨水和高浓度氨水在捕集CO2过程的能耗变化。在CO2吸收率为90%、吸收温度为25 ℃、其他参数都为最佳参数的条件下,各部分能耗结果如图 9所示。可以看出,高浓度氨水的CO2再生能耗更低,氨水浓度高于20% 时,再生能耗在每千克CO2 2.44 MJ以下,相比氨水浓度为4% 时的每千克CO2 3.52 MJ的再生能耗减少了30.9%。然而,当考虑逃逸氨的水洗能耗时,氨水浓度越高,氨再生能耗也越大,氨再生能耗占总捕集能耗的比例越大,在氨水浓度为20% 时,氨再生能耗为每千克CO2 0.25 MJ,占总能耗的9.3%,而氨水浓度为4% 时,氨再生能耗仅为每千克CO2 0.039 MJ,仅占总能耗的1.1%。从总能耗上看,高能耗氨水捕集CO2仍占优势,其总能耗比低浓度氨水捕集CO2的能耗低21.6%~25%,但由于处理逃逸氨的能耗增加较快,增加氨水浓度并不能显著降低总能耗,在氨水浓度为18%~22% 时,系统总体能耗几乎无变化,此时,处理氨逃逸所需的能耗与氨浓度增加时CO2再生能耗的下降处于平衡。
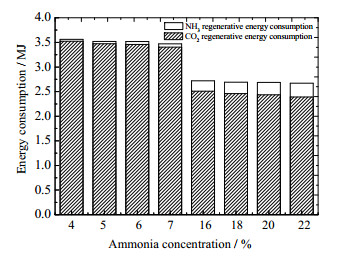
|
图 9 低浓度与高浓度氨水CO2再生能耗与NH3再生能耗对比 Fig.9 Comparison of CO2 regeneration energy consumption of low and high concentration ammonia and NH3 regeneration energy consumption |
在吸收塔内,CO2与氨水溶液的碱性基团发生的化学反应是放热反应,温度升高对吸收速率会有反向的效果,氨逃逸也会相应地增加。为了探究吸收温度对捕集能耗的影响,针对20% 的氨水模拟了吸收与解吸循环过程能耗之间的特性。如图 10所示,在保持CO2的脱除率为90% 的条件下,吸收温度越高CO2再生能耗越高,同时氨再生能耗也越大。
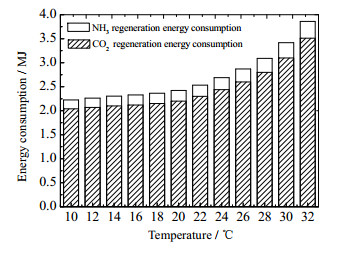
|
图 10 氨水浓度为20% 条件下吸收温度与能耗的关系 Fig.10 Relationship between absorption temperature and energy consumption at ammonia concentration of 20% |
吸收温度主要通过液气比(单位时间内吸收液与烟气的质量比,mL/mG)影响系统能耗。图 11显示了在吸收效率为90%的条件下,所需mL/mG与温度的关系。可以看出,随吸收温度的升高,mL/mG呈现先下降后上升的趋势,当温度低于14 ℃时,继续降低温度,所需吸收液流量反而有所增加,这是因为动力学反应速率降低,需要增加吸收液流量以维持吸收效率。当吸收温度高于20 ℃时,平衡反应向分解方向移动,同时氨逃逸量增大导致吸收液氨水浓度下降较快,则所需吸收液流量增大,液气比增大。有研究表明,解吸塔的能耗主要由加热溶液所需的能耗、分解能耗、气体逸出能耗3部分组成,其中加热溶液的能耗占主导地位[15],所以吸收温度越高,所需的吸收液流量越大,解吸塔加热溶液的负荷越大,CO2再生能耗增加。
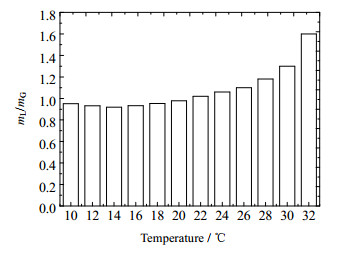
|
图 11 吸收温度与液气比的关系 Fig.11 Relationship between absorption temperature and liquid-gas ratio |
解吸后的溶液中仍然含有未解吸完的CO2,这一部分碳负载在吸收过程中使得反应向分解方向移动,所以探究吸收液的碳负载对整个吸收、解吸过程的影响有着重要的意义。图 12显示了在20 ℃、20% 氨水吸收条件下,不同吸收液碳负载对液气比和整体能耗的关系。随着吸收液碳负载的增加,所需吸收液的流量相应增加,这是因为吸收液碳负载高,反应向分解方向移动,高碳负载限制了吸收液的吸收能力。同时,碳负载越高,所需能耗越大,这是因为吸收液流量相应增大,解吸时加热吸收液所需的能耗会增加。虽然碳负载从0.22增加到0.34时,液气比增加了31%,但是能耗只增加了13%,这是因为吸收液碳负载越大,吸收后相应的富CO2待解吸液的碳负载越大,富液的碳负载越大越利于解吸过程的进行。
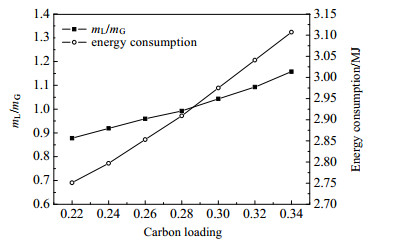
|
图 12 吸收液碳负载与液气比和能耗的关系 Fig.12 Relationship between absorption liquid carbon loading with liquid-gas ratio and energy consumption |
针对高浓度氨水吸收CO2过程中氨逃逸与CO2再生能耗之间的相互影响,本研究基于Aspen Plus建立了高浓度氨水捕集CO2与氨逃逸回收工艺的仿真模型,对高浓度氨水吸收CO2过程的氨逃逸与能耗进行了分析,考察了逃逸氨水洗对系统整体能耗的影响,研究了吸收温度、富液入口温度、CO2负载、液气比等关键参数的影响,得出以下结论:
(1) 高浓度氨水捕集CO2时氨逃逸量是低浓度氨水条件下的5~5.8倍。吸收塔的氨逃逸浓度随贫液碳负载和吸收温度的变化较低浓度氨水条件下的变化更加显著。
(2) 富液入口温度对CO2的再生能耗和解吸塔的氨逃逸均有显著的影响。当富液入口温度超过一定值时氨逃逸呈现迅速上升的变化;存在最佳富液入口温度,使得CO2的再生能耗最低,同时最佳富液入口温度随碳负载增加而降低。
(3) 在保证能耗最低,吸收塔氨逃逸较小的前提下,存在碳负载的限制,如20% 的氨水吸收CO2时,富液入口温度不能高于107 ℃,贫液碳负载不宜小于0.25。
(4) 高浓度氨水捕集CO2具有更低的能耗。浓度为16%~22% 的氨水捕集CO2时的CO2再生能耗比浓度为4%~7% 的氨水降低了26.2%~32.2%,总体能耗下降了21.6%~25%。氨水浓度越高,氨再生能耗越大,当氨水浓度为20% 时,氨再生能耗为每千克CO2 0.25 MJ,占总能耗的9.3%,而氨水浓度为4% 时,氨再生能耗为每千克CO2 0.039 MJ,仅占总能耗的1.1%。氨水浓度在18%~22% 时具有整体能耗低的优势。
| [1] |
董建勋, 张悦, 张昀, 等. 用氨水作为吸收剂脱除燃煤烟气中CO2的实验研究[J]. 动力工程, 2007, 27(3): 438-440, 450. DONG J X, ZHANG Y, ZHANG J, et al. Experimental study on absorption of CO2 in flue gas by hydrous ammonia[J]. Journal of Power Engineering, 2007, 27(3): 438-440, 450. |
| [2] |
王阳, 贾莹光, 李振中, 等. 燃煤烟气氨法CO2减排技术的研究[J]. 电力设备, 2008, 9(5): 17-20. WANG Y, JIA Y G, LI Z Z, et al. Study on absorption of CO2 in coal-fired flue gas by hydrous ammonia[J]. Electrical Equipment, 2008, 9(5): 17-20. |
| [3] |
RESNIK K P, GARBER W, HREHA D C, et al. A parametric study for regenerative ammonia-based scrubbing for the capture of CO2: Proceedings of the 23rd Annual International Pittsburgh Coal Conference [C]. Pittsburgh: [s. n], 2006.
|
| [4] |
DAVE N, DO T, PUXTY G, et al. CO2 capture by aqueous amines and aqueous ammonia–A comparison[J]. Energy Procedia, 2009, 1(1): 949-954. DOI:10.1016/j.egypro.2009.01.126 |
| [5] |
QIN F, WANG S J, HARTONO A, et al. Kinetics of CO2 absorption in aqueous ammonia solution[J]. International Journal of Greenhouse Gas Control, 2010, 4(5): 729-738. DOI:10.1016/j.ijggc.2010.04.010 |
| [6] |
BUDZIANOWSKI W M. Mitigating NH3 vaporization from an aqueous ammonia process for CO2 capture[J]. International Journal of Chemical Reactor Engineering, 2011, 9(1): A58-A58. |
| [7] |
ULLAH A, SOOMRO M I, KIM W S. Ammonia-based CO2 capture parameters optimization and analysis of lean and rich vapor compression processes[J]. Separation and Purification Technology, 2019, 217: 8-16. DOI:10.1016/j.seppur.2019.02.002 |
| [8] |
DARDE V. CO2 capture using aqueous ammonia [D]. Copenhagen: Technical University of Denmark, 2011.
|
| [9] |
YU H, QI G J, WANG S J, et al. Results from trialling aqueous ammonia-based post-combustion capture in a pilot plant at Munmorah power station: Gas purity and solid precipitation in the stripper[J]. International Journal of Greenhouse Gas Control, 2012, 10: 15-25. DOI:10.1016/j.ijggc.2012.04.014 |
| [10] |
吕泽宁, 乔琨, 王韬, 等. 低温条件下喷淋塔氨法脱碳实验研究[J]. 热力发电, 2021, 50(12): 115-121. LYU Z N, QIAO K, WANG T, et al. Experimental research on ammonia decarbonization in spray tower at low temperature[J]. Thermal Power Generation, 2021, 50(12): 115-121. |
| [11] |
YU J W, WANG S J, YU H, et al. Rate-based modelling of CO2 regeneration in ammonia based CO2 capture process[J]. International Journal of Greenhouse Gas Control, 2014, 28: 203-215. DOI:10.1016/j.ijggc.2014.06.032 |
| [12] |
ZHANG M K, GUO Y C. A comprehensive model for regeneration process of CO2 capture using aqueous ammonia solution[J]. International Journal of Greenhouse Gas Control, 2014, 29: 22-34. DOI:10.1016/j.ijggc.2014.07.010 |
| [13] |
YU H, MORGAN S, ALLPORT A, et al. Results from trialling aqueous NH3 based post-combustion capture in a pilot plant at Munmorah power station: Absorption[J]. Chemical Engineering Research and Design, 2011, 89(8): 1204-1215. DOI:10.1016/j.cherd.2011.02.036 |
| [14] |
LI K K, YU H, TADE M, et al. Process modeling of an advanced NH3 abatement and recycling technology in the ammonia-based CO2 capture process[J]. Environmental Science & Technology, 2014, 48(12): 7179-7186. |
| [15] |
ZHANG M K, GUO Y C. Rate based modeling of absorption and regeneration for CO2 capture by aqueous ammonia solution[J]. Applied Energy, 2013, 111: 142-152. DOI:10.1016/j.apenergy.2013.04.074 |




