2. 浙江省化工研究院 含氟温室气体替代及控制处理国家重点实验室,浙江 杭州 310023
2. State Key Laboratory of Fluorinated Greenhouse Gases Replacement and Control Treatment, Zhejiang Research Institute of Chemical Industry, Hangzhou 310023, China
六氟乙烷(C2F6,R116)是无色、无味、非易燃气体。高纯R116是超大规模集成电路必需的介质[1-3],主要用于电子清洗及蚀刻工艺。随着半导体芯片尺寸越来越小,电子行业对R116的纯度要求也越来越高,即使百万分之一的微量杂质也能导致电子产品的不合格率迅速增加[1],因此,高效去除工业级R116中的各类杂质变得十分重要。
工业级R116产品主要从五氟一氯乙烷(C2F5Cl,R115)直接氟化而来[4],工业品中有多种含氟、氯、氢化合物杂质,杂质情况复杂,其中以R115为主。R116沸点-78.2 ℃,非极性,R115沸点-39 ℃,极性。电子级R116纯化主要采用精馏法[5-6],R115类含氯杂质去除主要采用氟化偶合精馏[7-9]方法。然而精馏需要低温、高压,能耗高,对设备要求高,同时氟化操作腐蚀性强,对操作和设备要求高。吸附分离法操作条件温和、能耗低、去除深度高,在工业生产电子级R116中具有明显优势,而工业应用的前提是选择高效吸附剂。
PENG[10]研究R115/R125体系分离时发现R115/AC属于能量不均一体系,最大吸附热40 kJ·mol-1,R115在MFI型全硅分子筛的孔道和交叉点吸附热分别为52.2和44.6 kJ·mol-1。PARK[11]发现R115/AC的吸附热为15.368~25.689 kJ·mol-1,MOON[12]发现R115在AC和Pd/AC上的吸附热随覆盖度增加而上升的异常现象,作者认为吸附相分子之间发生了相互作用力。
随着新型吸附剂的开发和TSA/PSA技术的发展,吸附技术已广泛应用于工业分离,但R116吸附纯化研究只有极少量的专利适用性报道,吸附分离机理尚不清晰。昭和电工专利[13]用分子筛或微孔尺寸在0.35~1.1 nm的碳质吸附剂去除R116中含2个碳原子的HFCs杂质,但不包含R115杂质。杜邦专利[3]用AC或0.3~1.5 nm的分子筛针对性地高效吸附R13和R23杂质,使R116纯度达到99.999%。普莱克斯[14]专利用临界法去除R116中的非挥发性杂质,吸附剂为NaX。中化蓝天专利[1]报道NaX适用于去除R116中包含R115在内的多种氟氯烃杂质。
本研究通过R116及其关键杂质R115在NaX分子筛上的吸附平衡常数、吸附热等研究,明确了吸附分离机理,为脱除R116中其它含氟、氯、氢杂质及开发新型吸附剂提供依据和方向,同时对比吸附穿透曲线与理想吸附溶液理论(ideal adsorbed solution theory, IAST)结果,IAST理论适用于本体系。
2 实验 2.1 实验材料与仪器采用Micromeritics 3Flex型气体吸附分析仪测试吸附等温线,该仪器配有1台分子泵和11个不同压力传感器,提高了低压范围的灵敏度。氦离子气相色谱仪分析穿透曲线实验尾气。NaX分子筛购于杭州希吉斯新材料科技有限公司。实测77 K下N2吸附表征显示,BET比表面积为685.8 m2·g-1,孔容为0.34 cm3·g-1。R115和R116采购于浙江蓝天环保高科技股份有限公司,纯度高于99.99%。
2.2 吸附等温线测试方法采用静态容积法精确测量2 Pa~110 kPa R115和R116在NaX上的吸附等温线。测试前,吸附剂在523 K下真空脱气4 h,随后在273、283、293和303 K下分别进行吸附测量。用冰水混合物为冷却剂测量273 K下的吸附等温线,用循环水浴控制温度进行283,293和303 K下的吸附等温线测量,误差范围±0.01 K。
2.3 穿透曲线实验采用固定床吸附器进行R115/R116二组分穿透曲线实验。吸附剂粒径1.0~1.5 mm,装填量5 g。吸附剂在623 K,25 mL·min-1的He气氛下在线活化5 h,随后在303 K,100 kPa,25 mL·min-1 (He为稀释气,R115和R116质量含量分别为98x10-6和89x10-6,摩尔比为52.4:47.6)的条件下进行吸附实验。吸附后尾气用氦离子气相色谱仪(检测限10x10-9)在线分析气体组成。
2.4 理论方法 2.4.1 吸附等温线模型采用Langmuir、Langmuir-Freundlich和Toth模型拟合吸附等温线,公式如下:
Langmuir模型:
| $ V = \frac{{{V_{{\rm{m }}}} \times b \times p}}{{1 + b \times p}} $ | (1) |
Langmuir-Freundlich模型:
| $ V = \frac{{{V_{\rm{m}}} \times b \times {p^n}}}{{1 + b \times {p^n}}} $ | (2) |
Toth模型:
| $ V = \frac{{{V_{\rm{m}}} \times b \times p}}{{{{\left( {1 + {{(b \times p)}^k}} \right)}^{\frac{1}{k}}}}} $ | (3) |
Langmuir、Langmuir-Freundlich和Toth模型中的常数通过实验数据的非线性回归计算得到,标准偏差σ:
| $ \sigma = \sqrt {\sum {\frac{{{{\left( {{V_{{\rm{cal}}}} - {V_{\exp }}} \right)}^2}}}{{\omega - \tau }}} } $ | (4) |
等量吸附热由克劳修斯-克拉伯龙方程计算得到,公式如下:
| $ \Delta {H_{{\rm{ads}}}} = - {\rm{R}}{\left[ {\frac{{\partial \ln p}}{{\partial (1/T)}}} \right]_{\rm{v}}} $ | (5) |
吸附质在吸附剂表面的覆盖度公式如下:
| $ \theta = \frac{V}{{{V_{\rm{m}}}}} $ | (6) |
采用纯物质Langmuir拟合的吸附等温线数据,利用Meyers和Prausnitz提出的IAST模型预测R115在R115/R116双组分混合气体中的选择性,通过下式计算[15-18]:
| $ {S_{{\rm{R}}115}} = \frac{{X_{{\rm{R}}115}^{\rm{a}}/X_{{\rm{R}}115}^{\rm{g}}}}{{X_{{\rm{R}}116}^{\rm{a}}/X_{{\rm{R}}16}^{\rm{g}}}} $ | (7) |
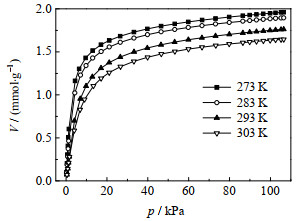
R115和R116在273,283,293和303 K的吸附等温线分别如图 1和2所示。吸附温度越低R115和R116的吸附量越大,但两者在NaX上的吸附等温线线型差异显著。R115吸附等温线在低压区的吸附量迅速上升,并快速达到吸附平衡。R116吸附等温线在低压区的吸附量随压力增加上升相对较缓,推测这种差异与吸附剂对两者分子的相互作用力不同有关。R115进入吸附剂孔道后与NaX发生强相互作用,迅速占据活性位,使吸附等温线在低压区快速上升。而进入孔道的R116与NaX作用力相对较弱,需要增加一定吸附压力后才提高吸附量,因此吸附等温线在低压区上升较缓。

|
图 1 不同温度下R115在NaX上的吸附等温线 Fig.1 R115 adsorption isotherms on NaX measured at different temperatures |
|
图 2 不同温度下R116在NaX上的吸附等温线 Fig.2 R116 adsorption isotherms on NaX measured at different temperatures |
通过拟合R115和R116的吸附等温线,得到不同吸附模型的参数。Langmuir参数b反映吸附剂与吸附质之间的相互作用力,b越大表示吸附作用力越强[17, 19-20]。如表 1所示,不同模型的bR115在相同温度下均大于bR116。以Toth模型为例,273 K下bR115是bR116的553.6倍,说明NaX对R115的作用力远大于R116。这可能是由体系极性差异引起:R115/NaX为极性/极性体系,相互作用力较强,而R116/NaX为非极性/极性体系,相互作用力较弱。随着温度上升,bR115在Langmuir、Langmuir-Freundlich和Toth模型中分别从4.22,1.684,26.02 mmHg-1下降到0.653,0.652,1.309 mmHg-1,bR116分别从0.038,0.048,0.047 mmHg-1下降到0.016,0.016,0.017 mmHg-1,均随温度上升而下降。可见,R115、R116与NaX的相互作用力随温度上升而减弱。
|
|
表 1 R116和R115在NaX上的Langmuir、Langmuir-Freundlich、Toth吸附等温线参数 Table 1 Adsorption isotherm parameters of Langmuir, Langmuir-Freundlich and Toth model for R116 and R115 adsorption on NaX |
能量异性程度是吸附剂/吸附质体系的一种特性[20],Freundlich参数n和Toth参数k反映能量异性程度[10, 20]:n和k越偏离1,体系能量异性越大。如表 1所示,273~303 K下的nR115分别为0.548,0.573,0.606和0.765,nR116分别为0.909,0.942,0.966和0.988,kR115分别为0.441,0.468,0.487和0.653,kR116分别为0.834,0.877,0.923和0.983。相同温度下,R115的n与k比R116更偏离1,说明相同温度时,R115/NaX能量异性大于R116/NaX体系。nR115,nR116,kR115,kR116均随温度上升而单调逐渐增加,并趋近于1,可见温度上升使R115/NaX,R116/NaX体系的能量异性逐渐减弱。
表 1中R2反应模型拟合度,R2越接近于1说明该模型拟合越好。从R2可见用Toth模型拟合R115和R116比较适合。R116在3个模型中的拟合度都比较高,而且温度越高,拟合度越好,这可能与R116与NaX作用力有关:R116与NaX作用力较弱,并且随温度升高而减小,使吸附量减小,接近单层吸附。Langmuir模型适用于均一性表面的单层吸附,Langmuir-Freundlich不适用于低压和高压,高压下的吸附饱和量有限制。R115/NaX为非均一体系,因此R115对Langmuir和Langmuir-Freundlich模型的拟合度较差。Toth模型适用于高压与低压下的不均匀表面吸附,因此适用于R115/NaX体系。
3.2 吸附热吸附热(ΔHads)可以提供吸附剂表面化学亲和力信息。吸附热越大,表明吸附质/吸附剂之间的作用力越大[11, 21]。表 2为不同模型计算的R115和R116吸附热,其中ΔHads, R115为45.20~113.39 kJ·mol-1,大于其蒸发焓19.41 kJ·mol-1[22],ΔHads, R116为21.17~34.76 kJ·mol-1,与其蒸发焓16.15 kJ·mol-1[22]较为接近。同一模型的ΔHads, R115大于ΔHads, R116,表明R115/NaX之间的作用力大于R116/NaX体系,结论与b值一致。文献报道R115在不同吸附剂上的吸附热为15~40 [10-12]、44.6 [10]和52.2 kJ·mol-1[10],低于本研究结果,因此,R115与NaX的作用力比文献报道更强。
|
|
表 2 不同模型计算的R115和R116吸附热比较 Table 2 Comparison of R115 and R116 adsorption enthalpy calculated by different models |
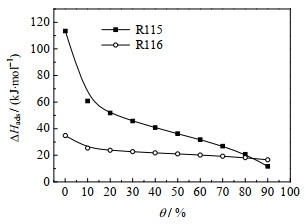
吸附体系能量异性另一个证据是吸附热随覆盖率增加而下降[20]。图 3是基于Langmuir-Freundlich模型计算的吸附热随覆盖度变化关系。ΔHads, R115和ΔHads, R116没有发生Moon [12]报道的吸附热随覆盖度增加而上升的异常现象,说明被吸附分子之间没有相互作用力。ΔHads, R115随覆盖度增加从113.39迅速单调下降到11.74 kJ·mol-1,ΔHads, R116随初始覆盖度增加而下降后,快速稳定于20.0 kJ·mol-1左右。可见,R115/NaX能量异性程度大于R116/NaX体系,即NaX表面对R115敏感程度大于R116。ΔHads, R115和ΔHads, R116随覆盖度下降差异推测与极性相关:NaX和R115均为极性,两者相互作用力较大,初始吸附热较大。随着吸附进行,能量较高的活性位点逐渐减少,吸附热迅速下降。R116为非极性,与NaX作用力弱,NaX表面对R116以非活性位为主,初始吸附热低。吸附一定量后,较强活性位基本占满,吸附热保持稳定。
|
图 3 R115 和 R116 在 NaX 上的吸附热随覆盖度变化 Fig.3 Isosteric adsorption heats of R115 and R116 as a function of coverage |
在研究R115和R116单组分吸附等温线基础上,用Myers和Prausnitz提出的IAST预测了NaX对R115/R116混合气体的吸附分离性能。
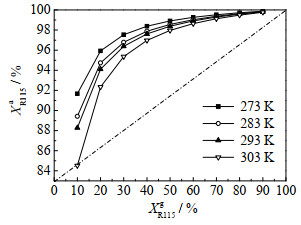
图 4和5分别为不同温度下IAST计算的R115及R116气相和吸附相含量关系。R115的气相含量为10%时,吸附相已富集到90%左右,而R116在气相含量90%左右时,吸附相只有10%左右。可见,R115容易被NaX吸附而累积,而且温度越低,R115在吸附相中富集程度越高。例如R115气相含量为10%时,吸附相含量随温度降低逐渐从84.5%上升到91.7%,低温下更容易选择性吸附R115。
|
图 4 IAST计算的不同温度下XR115g和XR115a关系 Fig.4 IAST plots of XR115g vs XR115a at different temperatures |

|
图 5 IAST计算的不同温度下XR116g和XR116a关系 Fig.5 IAST plots of XR116g vs XR116a at different temperatures |
图 6为R115/R116 (摩尔比52.4:47.6)混合二组分在303 K下的IAST吸附量随吸附压力变化。R115和R116的吸附量随吸附压力增加而上升,最高分别达1.7和0.03 mmol·g-1,R115的吸附量是R116的56.7倍。R115分子比R116大,而R115吸附量却远大于R116,可见,影响吸附分离的原因不是分子筛孔径限域作用。

|
图 6 303 K下R115/R116二组分IAST吸附量随吸附压力变化 Fig.6 IAST adsorption capacity as a function of pressure at 303 K |
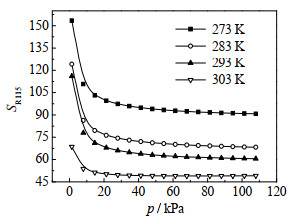
图 7为IAST计算的R115/R116混合二组分在不同温度下R115选择性随压力变化。由图可见,SR115随吸附压力和温度增加而下降。273,283、293和303 K下,SR115随压力增加而下降后,分别稳定于92、70、61和49左右,且温度越低,SR115越大。
|
图 7 不同温度下R115/R116混合二组分IAST选择性随吸附压力变化 Fig.7 IAST adsorption selectivity of R115 as a function of pressure at different temperatures |
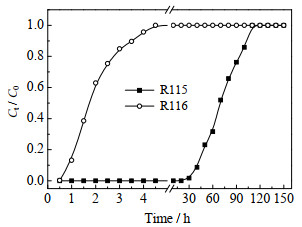
IAST预测选择性的准确度与吸附体系能量均一性、吸附质极性,吸附质分子尺寸差异等因素相关,因此必须通过实验验证[16]。为获得R115和R116在NaX上的真实动态吸附容量及R115的吸附选择性,并与IAST模拟结果对比,在100 kPa,303 K条件下,R115与R116摩尔比为52.4:47.6的二组分进行动态吸附实验,结果如图 8所示。实验以Ct/C0=0.01为穿透点。R116在实验初即迅速从吸附剂床层穿透,而R115经过近30 h后才在尾气中检测到。R116和R115的穿透时间相差30 h,意味着在R115被穿透出现前,可以得到纯净的R116产品,NaX对R115/R116二组分混合物的分离效率优异。
|
图 8 303 K下 R115 和 R116 混合气在 NaX 上的吸附穿透曲线 Fig.8 Breakthrough curves of the mixed gas on NaX at 303 K |
原料中R115和R116气体百分含量分别为52.4%和47.6%,用穿透曲线吸附量计算两者在吸附相中的百分含量分别为97.8%和2.1%,代入式(7)计算出穿透曲线选择性为40.9。IAST计算相同条件下的选择性为49.0,略高于实验值,但基本接近。偏差的原因是IAST选择性的计算基础是单组分,而实际穿透实验为R116和R115双组分。吸附过程中NaX与R116作用力虽然小于R115,但R116仍占据一部分活性位,同时降低R115与NaX的碰撞机率,导致减少了一部分R115吸附量,因而R115实际选择性略低于理论计算值。
4 结论(1) Toth模型对R115和R116在NaX上的吸附等温线拟合较适合。Langmuir常数b和吸附热表明NaX对R115的作用力大于R116,作用力差异是NaX分离R115/R116的重要原因。
(2) R115/NaX和R116/NaX体系都是能量异性体,NaX表面对R115的敏感程度大于R116。
(3) IAST预测吸附温度越低,吸附压力越小,R115吸附选择性越高。穿透曲线实验点的选择性与IAST计算基本吻合。
符号说明:
|
|
| [1] |
浙江省化工研究院有限公司, 中化蓝天集团有限公司.一种改性的吸附剂及其在超高纯六氟乙烷制备中的应用: CN, 105363407A[P]. 2016-02-17. Zhejiang Research Institute of Chemical Industry Ltd., Sinochem Lantian Co. Ltd. Modified adsorbent and its application in preparation of ultra-pure hexafluoroethane: CN, 105363407A[P]. 2016-02-17. |
| [2] |
杨健芳. 六氟乙烷(FC-116)应用前景和市场分析[J]. 浙江化工, 2008, 39(10): 14-17. YANG J F. Hexafluoroethane (FC-116) application prospect and market analysis[J]. Zhejiang Chemical Industry, 2008, 39(10): 14-17. DOI:10.3969/j.issn.1006-4184.2008.10.006 |
| [3] |
CORBIN D R, FERNANDEZ R E, MAHLER B A. Purification of hexafluoroethane products: US, 5523499(A)[P]. 1996-06-04.
|
| [4] |
杜汉盛. 六氟乙烷的制备及纯化方法概述[J]. 低温与特气, 2013, 31(3): 1-4. DU H S. Method for producing and purifying hexafluoroethane[J]. Low Temperature and Specialty Gases, 2013, 31(3): 1-4. DOI:10.3969/j.issn.1007-7804.2013.03.001 |
| [5] |
MILLER R N, DESCHERE M R, Mahler B A, et al. Purification process for hexafluoroethane products by azeotropic distillation with hydrogen chloride: WO, 9609271A1[P]. 1996-03-28.
|
| [6] |
佛山市华特气体有限公司.一种六氟乙烷的纯化方法: CN, 103664501A[P]. 2014-03-26. Foshan Huate Gases Co. Ltd. Method for purifying hexafluoroethane: CN, 103664501A[P]. 2014-03-26. |
| [7] |
OHNO H, OHI T. Production and use of hexafluoroethane: WO, 2003014047A1[P]. 2003-02-20.
|
| [8] |
OHNO H, ARAI T. Process for producing hexafluoroethane and use thereof: WO, 2005019141A2[P]. 2005-03-03.
|
| [9] |
OHNO H, KAGA K, OHI T. Fluorination process for producing hexafluoroethane from pentafluoroethane and hydrogen fluoride and the product's use as an etching gas: WO, 2001098240A2[P]. 2001-12-27.
|
| [10] |
PENG Y, ZHANG F, ZHENG X, et al. Comparison study on the adsorption of CFC-115 and HFC-125 on activated carbon and Silicalite-1[J]. Industrial & Engineering Chemistry Research, 2010, 49(20): 10009-10015. |
| [11] |
PARK H M, MOON D J. Adsorption Equilibria of CFC-115 on activated charcoal[J]. Journal of Chemical & Engineering Data, 2003, 48(4): 908-910. |
| [12] |
MOON D J, CHUNG M J, PARK K Y, et al. Adsorption equilibrium and catalytic reaction of CFC-115 on Pd/activated carbon powder[J]. Carbon, 1999, 37(1): 123-128. DOI:10.1016/S0008-6223(98)00196-1 |
| [13] |
OHNO H, NAKAJO T, OHI T. Method for purifying hexafluoroethane: US, 6274782B1[P]. 2001-08-14.
|
| [14] |
HOLMER A E. Purification of hexafluoroethane: US, 6346138B1[P]. 2002-02-12.
|
| [15] |
LAMIA N, WOLFF L, LEFLAIVE P, et al. Equilibrium and fixed bed adsorption of 1-butene, propylene and propane over 13x zeolite pellets[J]. Separation Science and Technology, 2008, 43(5): 1124-1156. DOI:10.1080/01496390801888136 |
| [16] |
WU C W, SIRCAR S. Comments on binary and ternary gas adsorption selectivity[J]. Separation and Purification Technology, 2016, 170(2016): 453-461. |
| [17] |
CHOUDARY N V, KUMAR P, BHAT T S G, et al. Adsorption of light hydrocarbon gases on alkene-selective adsorbent[J]. Industrial & Engineering Chemistry Research, 2002, 41(11): 2728-2734. |
| [18] |
ANSON A, WANG Y, LIN C C H, et al. Adsorption of ethane and ethylene on modified ETS-10[J]. Chemical Engineering Science, 2008, 63(16): 4171-4175. DOI:10.1016/j.ces.2008.05.038 |
| [19] |
NEWALKAR B L, CHOUDARY N V, TURAGA U T, et al. Potential adsorbent for light hydrocarbon separation: Role of SBA-15 framework porosity[J]. Chemistry of Materials, 2003, 15(7): 1474-1479. DOI:10.1021/cm020889d |
| [20] |
DO D. Adsorption analysis:equilibria and kinetics[M]. London: Imperial College Press, 1998.
|
| [21] |
REN X, SUN T, HU J, et al. Highly enhanced selectivity for the separation of CH4 over N2 on two ultra-microporous frameworks with multiple coordination modes[J]. Microporous and Mesoporous Materials, 2014, 186(2014): 137-145. |
| [22] |
HAYNES W M. CRC Handbook of Chemistry and Physics[M]. 94th ed. Boca Raton: CRC Press, 2013.
|




