2. 浙江大学衢州研究院, 浙江 衢州 324000
2. Institute of Zhejiang University-Quzhou, Quzhou 324000, China
随着新能源汽车的快速发展,锂作为动力电池的核心原料,其需求量更是逐年攀升。尽管我国锂盐资源量相对丰富,资源储量占全球的7%[1],但国内产量依旧不能满足工业需求,每年的原料进口占比高达72%[2]。海水中Li+质量浓度约为0.17 mg⋅L−1,锂含量高达2 300亿吨[3],若能绿色且廉价地从海水中提取Li+,对我国工业发展具有重要的战略意义。
目前,从海水中提取Li+的方法主要有沉淀法、溶剂萃取法、离子交换法、电化学法、膜分离法和吸附法等[4-8]。Chitrakar等[9]研究了用Li16Mn1.6O4前体合成的氧化锰吸附剂从海水中提锂,该吸附剂对Li+的吸附量可达40 mg⋅g−1。Liu等[10]制备了氧化锰离子筛吸附剂用于吸附浓缩海水中的金属离子,其中Li+浓度为6.08 mg⋅L−1,吸附量最大可达10.05 mg⋅g−1。尽管这些吸附剂能高效提取Li+,但是该类吸附剂存在制备工艺复杂,流动性差,易造成溶损,且含有重金属离子,难以回收利用,容易对环境造成污染等问题[11]。因此,寻找绿色环保、易分离回收、高吸附率的吸附剂意义重大。
低共熔溶剂(DES),是一种新型的绿色离子液体,具有低熔点、低毒性、可降解、热稳定和易制备等优点[12],已经逐步取代传统的有机溶剂和其他离子液体,广泛应用于溶剂萃取中。当前研究的用于提锂的DES主要有苯甲酰三氟丙酮(HBTA)和三辛基氧化膦(TOPO)、2-噻吩甲酰三氟丙酮(HTTA)和TOPO,分别以物质的量比为2:1混合制备形成[13],以物质的量比为1:2的甲基三辛基氯化铵(N8881Cl)和癸酸(C10)组成的DES(N8881Cl/C10 DES)[14]。而将DES直接用于萃取会导致DES发生乳化、损耗等问题,为了解决这一问题,可将DES作为芯材包裹在微胶囊的壳中。新型微流体技术结合微胶囊传统制备方法[15-16]被广泛用于制备粒径均一的微胶囊,该法能精确控制微胶囊的尺寸和内部结构。本研究利用同轴共流微流体技术结合溶剂挥发法制备包裹有N8881Cl/C10 DES的聚苯乙烯微胶囊(PS@[N8881Cl/C10]微胶囊),并将其用作Li+吸附剂,系统研究吸附时间、吸附温度、pH、初始Li+浓度和固液比等因素对吸附过程的影响,同时考察微胶囊的循环可利用性及对其他金属离子的分离选择性,以期为海水中Li+的提取提供相关的技术依据。
2 实验(材料与方法) 2.1 实验材料与仪器实验药品:聚苯乙烯(分析纯,相对分子质量为280 000)购自美国Alorich公司;明胶(生物技术级,胶强度~250 g Bloom)、甲基三辛基氯化铵(分析纯,质量分数w为97%)、癸酸(分析纯,w=99%)、无水氯化锂(分析纯,w > 99.99%)、氯化钠(分析纯,w=99.8%)、氯化钾(分析纯,w=99%)、氯化钙(分析纯,w=99.9%)、氯化镁(分析纯,w=99%)均购自上海麦克林生化科技股份有限公司;锂标准溶液(质量浓度为1 000 μg⋅mL−1)购自北京海岸鸿蒙标准物质技术有限公司;氢氧化钠(分析纯)购自国药集团化学试剂有限公司;盐酸(分析纯)购买自西陇科学有限公司。
实验仪器:THZ-82AB水浴恒温振荡器(江苏荣华有限公司);Pump 33DDS微量注射泵(美国Harvard公司);85-2数显式恒温磁力搅拌器(常州越新仪器制造有限公司);真空干燥箱(上海恒科学仪器有限公司);iS50傅里叶红外光谱仪(美国Thermo Nicolet公司);iCE 3000火焰原子吸收光谱仪(美国赛默飞公司);Pyris 1 TGA热分析仪(美国Perkin-Elmer公司);蔡司Sigma 300场发射扫描电镜(德国卡尔·蔡司股份公司);PHS-3C pH计(上海雷磁有限公司)。
2.2 实验试剂与设备含DES的微胶囊(PS@[N8881Cl/C10])的制备及表征对低共熔溶剂进行制备。通过加热搅拌共混的方法[14]制备物质的量比为1:2的N8881Cl/C10 DES。微流体设备如图 1 (a)所示。将长为10 cm、内径为0.5 mm的毛细玻璃管插入长为15 cm的透明硅胶管(0.8 mm×1.9 mm)内,并将长为25.5 mm的27G针头(0.2 mm ×0.4 mm)弯曲成90°角插入管中,使针尖位于毛细管中间,并与之平行;随后将硅胶管与玻璃管接触部分、硅胶管与针头部分用环氧树脂胶密封。
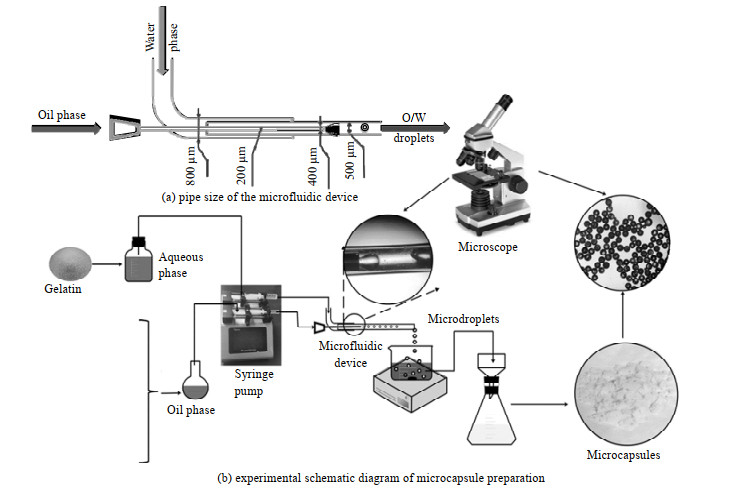
|
图 1 微胶囊制备的实验装置和流程图 Fig.1 Schematic diagram of the experiment setup and microcapsule preparation processes |
微胶囊制备的实验流程如图 1(b)所示。称1 g聚苯乙烯(PS)颗粒和1.5 g制备好的DES,将其一起加入装有20 mL二氯甲烷(DCM)的圆底烧瓶中,室温下搅拌直至PS完全溶解形成有机相;配制质量分数为1.5% 的明胶溶液作为水相待用。在微流体设备中,受毛细管尺寸的限制,选择将27 G针头作为有机相的通道,毛细玻璃管作为水相通道,通道两端分别连接到注射器上。随注射泵的推动,水相剪切有机相在固定的流速下,在毛细玻璃管中产生水包油(O/W)微液滴。液滴的形成过程受有机相和水相流量的影响,如:水相流量太小,会导致形成的微液滴尺寸偏大,且液滴在明胶水溶液中易聚并;水相流量太大,会导致水相的损失。综合考虑各项因素影响,本研究分别设置有机相和水相的体积流量为40 µL⋅min−1和240 µL⋅min−1。将毛细玻璃管插入盛有明胶水溶液的结晶皿里,结晶皿内收集形成的微液滴。随后将盛有微液滴的结晶皿移入25 ℃水浴锅中,继续搅拌2 h,使DCM完全挥发,得到PS@[N8881Cl/C10]微胶囊。过滤并收集固体颗粒,将其置于60 ℃的真空干燥箱中干燥48 h,获得微胶囊颗粒并保存于干燥器中待用。
对获得的微胶囊颗粒进行表征。通过扫描电镜观察微胶囊的表面形貌特征;使用傅里叶红外光谱仪检测微胶囊的成分;结合热重分析仪检测微胶囊中DES的包裹率;进一步使用电子显微镜和粒径统计软件分析微胶囊颗粒的粒径分布。
2.3 PS@[N8881Cl/C10]微胶囊对Li+的吸附采用静态吸附法研究微胶囊对Li+的吸附效果。取一定质量的微胶囊置于盛有250 mL一定浓度的Li+溶液的玻璃瓶中,用氢氧化钠和盐酸调节溶液pH。在恒温水浴震荡摇床中以200 r⋅min-1的震动频率震荡吸附2 h。吸附结束后,过滤,收集滤液,并通过原子吸收光谱仪(AAS)检测水溶液中Li+的含量。采用式(1)和(2)分别计算单位质量微胶囊吸附Li+的质量和萃取率。
| $ {q_{\text{e}}} = \frac{{\left( {{\rho _{\text{0}}} - {\rho _{\text{e}}}} \right)V}}{m} $ | (1) |
| $ E = \frac{{\left( {{\rho _0} - {\rho _{\text{e}}}} \right)}}{{{\rho _0}}} \times 100\% $ | (2) |
式中:qe为吸附平衡时单位质量微胶囊所吸附的Li+的质量,mg⋅g−1;
为研究PS@[N8881Cl/C10]微胶囊对各金属离子提取的选择性,依据海水中各金属离子的浓度范围,用去离子水溶解所需量的LiCl、KCl、NaCl、CaCl2和MgCl2,以制备模拟海水溶液,其组成及对应质量浓度为Li+(0.15 mg⋅L−1)、K+(400 mg⋅L−1)、Na+(10 000 mg⋅L−1)、Ca2+(400 mg⋅L−1)、Mg2+(1 300 mg⋅L−1),并调节模拟海水的pH分别为8.55和10.34。称取2.5 mg PS@[N8881Cl/C10]微胶囊,加入250 mL的模拟海水溶液中,在25 ℃下进行吸附实验。吸附平衡下,对各金属离子的吸附分配比[17]Kd, M和选择性系数βN/M的计算公式如下:
| $ K_{\mathrm{d}, \mathrm{M}}=\frac{\left(\rho_{\mathrm{i}, \mathrm{aq}}-\rho_{\mathrm{e}, \mathrm{aq}}\right) V}{\rho_{\mathrm{e}, \mathrm{aq}} m_{\mathrm{a}}}$ | (3) |
| $ \begin{gathered} \beta_{\mathrm{NM} }=\frac{K_{\mathrm{d}, \mathrm{N}}}{K_{\mathrm{d}, \mathrm{M}}} \end{gathered}$ | (4) |
式中:Kd, M、
图 2(a)和(b)是PS@[N8881Cl/C10] 微胶囊的形貌观测图;从图中可以看出,微胶囊形态规整,呈均一的球状,表面具有丰富的褶皱和沟壑。

|
图 2 PS@[N8881Cl/C10]微胶囊扫描电镜图 Fig.2 SEM images of PS@[N8881Cl/C10] microcapsules |
图 3展示了N8881Cl/C10、PS和PS@[N8881Cl/C10]微胶囊3种材料在500~4 000 cm−1的红外光谱图。图中1 724 cm−1处的峰是癸酸中C═O峰的位置,该峰同样出现在PS@[N8881Cl/C10]微胶囊中,癸酸中的─OH峰出现在2 955 cm−1处,在纯的DES和微胶囊里同样存在。除此之外,DES中脂肪族的C─H弯曲振动峰(1 466 cm−1),C─C伸缩振动峰(1 174 cm−1)在微胶囊里也有出现。红外谱图表明PS@[N8881Cl/C10]微胶囊里含有DES。
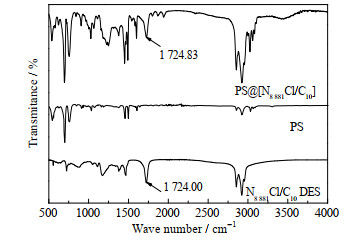
|
图 3 N8881Cl/C10、PS和PS@[N8881Cl/C10]微胶囊红外光谱图 Fig.3 FT-IR spectra of N8881Cl/C10, PS and PS@[N8881Cl/C10] microcapsules |
N8881Cl/C10、PS和PS@[N8881Cl/C10]微胶囊在温度为50~500 ℃得到的热重分析结果如图 4所示,升温速率控制在20 ℃⋅min−1。从图中看出,纯DES初始分解温度在135 ℃附近,PS初始分解温度为300 ℃左右。而PS@[N8881Cl/C10]微胶囊出现两个热分解平台,第1个平台的初始分解温度在180 ℃左右,该平台代表微胶囊中的DES开始分解;分解温度高于纯DES的初始分解温度,说明DES被包裹在微胶囊里,得到了壳层材料的保护。第2个平台在300 ℃左右,是PS在分解。从2个分解平台的重量下降比得出,微胶囊对DES的包裹率约为30.83%。
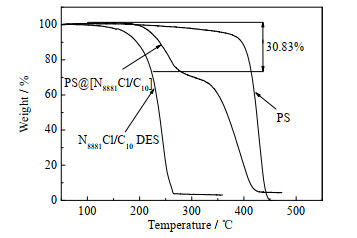
|
图 4 N8881Cl/C10、PS和PS@[N8881Cl/C10] 微胶囊热重分析谱图 Fig.4 Thermo gravimetric analysis curves of N8881Cl/C10, PS and PS@[N8881Cl/C10] microcapsules |
显微镜观察及软件统计获得的微胶囊粒径分布如图 5所示。从图 5(a)可以看到,微胶囊形态呈现均一的球形。显微镜下拍摄100个左右的微胶囊颗粒并通过软件统计得出粒径分布,结果如图 5(b)所示,可以看到,粒径分布符合正态分布变化。所制得的微胶囊粒径范围为160~190 µm,其中约49% 的颗粒粒径分布在170~175 µm,约87% 的颗粒粒径分布在165~180 µm,且计算的PS@[N8881Cl/C10]微胶囊颗粒平均粒径为(173.38±4.96) µm。粒径较小且较为均一。
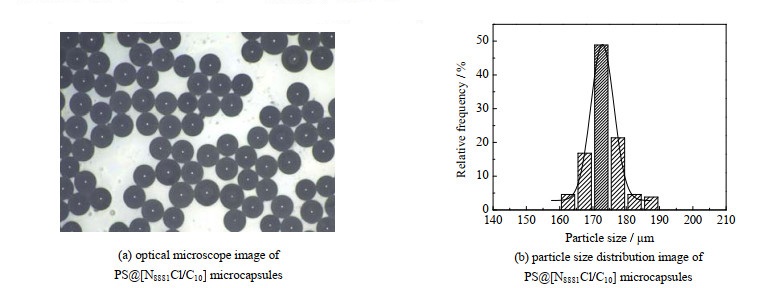
|
图 5 PS@[N8881Cl/C10]微胶囊的显微镜表观图及其粒径分布 Fig.5 Optical microscope image and particle size distribution of PS@[N8881Cl/C10] microcapsules |
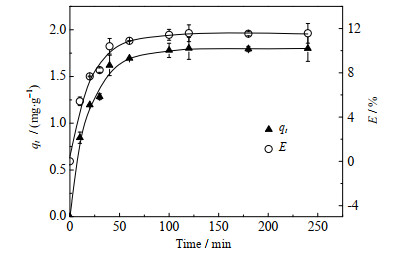
配制初始锂浓度ρ0为0.15 mg⋅L−1的Li+水溶液,并调节溶液pH=10.42。取2.5 mg微胶囊加入250 mL Li+水溶液中(固液比为0.01 g⋅L−1),分别进行不同时间(0~250 min)的吸附实验,吸附温度为25 ℃。
实验结果如图 6所示。结果表明,微胶囊初始吸附速率较快,且多数在1 h内被吸附。这是因为在初始阶段,Li+不断被吸附到微胶囊中,大量的结合位点是空的,所以萃取率在增加,吸附量在增大。随着吸附时间的延长,溶液中Li+浓度下降,微胶囊上吸附位点减少,导致吸附速率下降。随着吸附时间继续延长,吸附量的增加趋于平缓,最终在120 min左右达到平衡,平衡吸附量为1.80 mg⋅g−1。为保证微胶囊达到吸附平衡,后续的吸附时间均保持2 h。
|
图 6 吸附时间对Li+吸附量和萃取率的影响 Fig.6 Effects of time on Li+ adsorption amount and extraction efficiency |
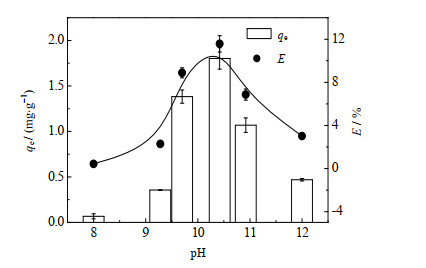
为研究PS@[N8881Cl/C10]微胶囊对Li+的吸附效果与水溶液pH的关系,称取2.5 mg的PS@[N8881Cl/C10]微胶囊,加入250 mL ρ0为0.15 mg⋅L−1的Li+水溶液中,溶液pH为8~12,分别在25 ℃下,进行吸附实验。吸附量和萃取率变化结果如图 7所示。
|
图 7 溶剂pH对Li+吸附量和Li+萃取率的影响 Fig.7 Effects of pH on Li+ adsorption amount and extraction efficiency |
从图中可以看到,随着pH的增大,PS@[N8881Cl/C10]微胶囊对Li+的吸附量和萃取率均是先增大后减小。在pH呈弱碱性(pH=8)或强碱性(pH=11~12)时,微胶囊对Li+的吸附都较少;而在pH=9.7或10.42时,微胶囊对Li+的吸附较大,这是因为碱性条件下,DES中由于癸酸的存在使得氢键减弱,导致更多的Li+进入,从而增大了DES对Li+的萃取率[14]。最佳pH为10.42时,吸附量最大,为1.80 mg⋅g−1;萃取率也最高,为11.57%。所以后续实验均在pH=10.42条件下开展。
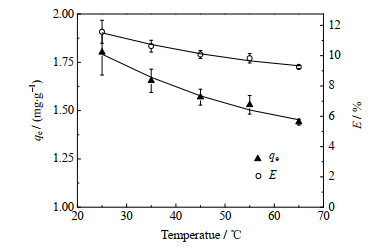
3.2.3 温度的影响为了探究最佳吸附温度,将2.5 mg的PS@[N8881Cl/C10]微胶囊加入250 mL ρ0为0.15 mg⋅L−1的Li+水溶液中,调节溶液pH=10.42,分别在25~65 ℃条件下,进行吸附实验。实验结果如图 8示。从图中可得,在25~65 ℃,吸附量下降约20%,萃取率从11.57% 下降到9.25%,这表明PS@[N8881Cl/C10]微胶囊吸附Li+的过程可能是放热的,在室温条件下,Li+的吸附量较高。因此,从吸附效果考虑,吸附温度设定在25 ℃较合适。
|
图 8 温度对Li+吸附量和萃取率的影响 Fig.8 Effects of temperature on Li+ adsorption amount and extraction efficiency |
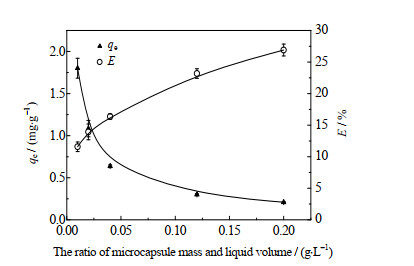
吸附过程中,把微胶囊质量与水溶液的体积比称为固液比。固液比太小,会影响Li+的吸附效果;固液比太大,会使吸附量下降,导致微胶囊的浪费。为此,有必要研究固液比对吸附过程的影响。实验中,分别称取2.5~50 mg的PS@[N8881Cl/C10] 微胶囊加入250 mL ρ0为0.15 mg⋅L−1的Li+水溶液中,调节溶液pH=10.42,在25 ℃条件下,进行吸附实验。改变加入的微胶囊质量,使固液比从0.01 g⋅L−1增加到0.20 g⋅L−1。实验测得在不同固液比下,PS@[N8881Cl/C10]微胶囊对Li+的吸附量和萃取率的变化结果如图 9所示。
|
图 9 固液比对Li+吸附量和萃取率的影响 Fig.9 Effects of solid-liquid ratio on Li+ adsorption amount and extraction efficiency |
由图 9可知,随着固液比从0.01 g⋅L−1增加到0.20 g⋅L−1,吸附量则从1.80 g⋅L−1减小到0.21 g⋅L−1,萃取率从11.57% 增加到26.9%,这是由于微胶囊的增多,会促进对水溶液中Li+的吸附,但是由于实验研究的水溶液Li+浓度极低,导致萃取率的增大幅度较小,相反,这会导致微胶囊吸附的急剧减小,这说明微胶囊的增多可能会降低其使用效率,从而增加成本,导致微胶囊的浪费。因此,为使微胶囊使用效率最大化,后续实验选取的固液比均为0.01 g⋅L−1。
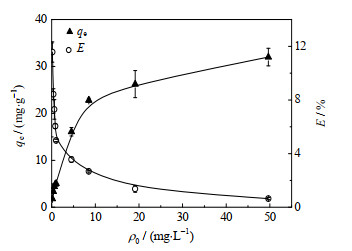
3.2.5 ρ0的影响研究表明,微胶囊吸附量总是随溶液中初始浓度的增大而增大,例如:Bilgic等[18]使用基于孢子花粉蛋白的新型荧光微胶囊去除水溶液中的Cu2+时,当初始Cu2+质量浓度从10 mg⋅L−1增加到50 mg⋅L−1时,微胶囊吸附量从7.5 mg⋅g−1增加到35 mg⋅g−1,由此可见,初始浓度对微胶囊吸附量影响很大。为探究PS@[N8881Cl/C10]微胶囊提锂的最大吸附量,研究微胶囊吸附量随ρ0的变化关系,实验分别取2.5 mg PS@[N8881Cl/C10]微胶囊加入250 mL pH=10.42的不同ρ0的水溶液中,在25 ℃下进行吸附实验,考察ρ0从0.15 mg⋅L−1增加到50 mg⋅L−1时对平衡吸附量和萃取率的影响,结果如图 10所示。
|
图 10 初始Li+浓度对Li+吸附量和萃取率的影响 Fig.10 Effects of initial Li+ concentration on Li+ adsorption amount and extraction efficiency |
从图 10可知,微胶囊的吸附量随ρ0的增大而增大。当ρ0从0.15 mg⋅L−1增加到50 mg⋅L−1时,微胶囊吸附量从1.80 mg⋅g−1增加到32 mg⋅g−1。这表明ρ0越高,吸附量越大,且微胶囊对Li+达到的最大吸附量约为32 mg⋅g−1。另外,随ρ0的增大,萃取率却逐渐减小。随着ρ0从0.15 mg⋅L−1增加到10 mg⋅L−1,平衡吸附量增加速度快;但是,当ρ0继续增大(> 10 mg⋅L−1)时,微胶囊平衡吸附量增加缓慢,即吸附量的变化逐渐趋于平缓,这是因为微胶囊对Li+的吸附并不是无止境的,会存在饱和吸附量;当ρ0增大到50 mg⋅L−1时,萃取率降低为0.64%,此时微胶囊吸附量趋于最大。
3.3 吸附等温线研究为了获得吸附平衡、吸附容量和吸附平衡常数等的信息,基于3.2.5节中实验获得的数据。研究分别使用Freundlich等温吸附模型[19]和Langmuir等温吸附模型[20]来拟合吸附过程,模型方程分别如式(5)和(6)所示:
| $ \log {q_{\text{e}}} = \log {K_{\text{f}}} + \frac{{\text{1}}}{n}\log {\rho _{\text{e}}} $ | (5) |
| $ \frac{1}{{{q_{\text{e}}}}} = \frac{1}{{{q_{{\text{max}}}}{k_{\text{L}}}{\rho _{\text{e}}}}} + \frac{{\text{1}}}{{{q_{{\text{max}}}}}} $ | (6) |
式中:qmax为微胶囊最大吸附量,mg⋅g−1,Kf (L⋅kg−1)和n为Freundlich等温吸附常数,1/n表示浓度对吸附量影响的强弱,1/n越小,说明吸附性能越好。kL为Langmuir等温吸附常数,L⋅mg−1。
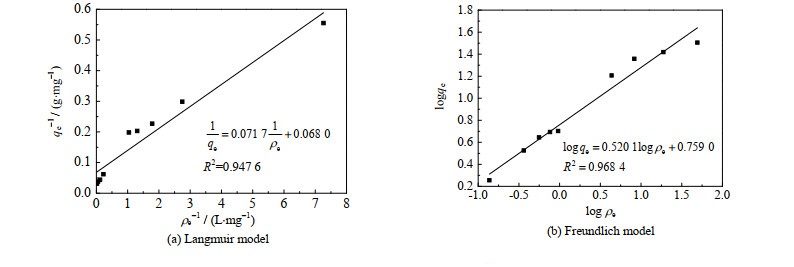
分别以1/ρe和1/qe为横纵坐标,log ρe和log qe为横纵坐标作图,并进行线性拟合,结果如图 11所示。从图中可以看出,Freundlich吸附模型(R2=0.968 4)比Langmuir吸附模型(R2=0.947 6)拟合效果更好,说明在低质量浓度Li+溶液中,PS@[N8881Cl/C10]微胶囊对Li+的吸附并不是简单的单层吸附,而是包含两个过程:微胶囊壳层对Li+的吸附和微胶囊中DES对Li+的液液萃取。侧面反映出微胶囊表面存在一定的孔隙使得Li+进入微胶囊里的DES中。进一步,由Freundlich和Langmuir吸附模型方程结合拟合直线的斜率和截距,计算得出25 ℃下等温吸附常数及其线性拟合相关系数R2,见表 1。在Freundlich吸附模型中,1/n为0.520 1,小于1,说明PS@[N8881Cl/C10]微胶囊对Li+较易吸附,是相对较强的吸附剂。而由Langmuir模型获得的微胶囊最大吸附量为14.71 mg⋅g−1,与实验值(32 mg⋅g−1)偏差较大。
|
图 11 吸附等温模型线性拟合 Fig.11 Line fitting results of adsorption isotherm models |
|
|
表 1 Langmuir和Freundlich吸附模型相关的参数结果 Table 1 Parameters of the Langmuir and Freundlich equations |
为了进一步研究吸附动力学过程,研究采用拟一阶动力学模型(7)和拟二阶动力学模型(8)获得吸附速率常数:
| $ {\text{l}}{{\text{n}}_{}}\left( {{q_{\text{e}}} - {q_t}} \right){\text{ = l}}{{\text{n}}_{}}{q_{\text{e}}} - {k_{\text{1}}}t $ | (7) |
| $ {q_t} = \frac{{q_{\text{e}}^{\text{2}}{k_{\text{2}}}t}}{{1 + {q_{\text{e}}}{k_{\text{2}}}t}} $ | (8) |
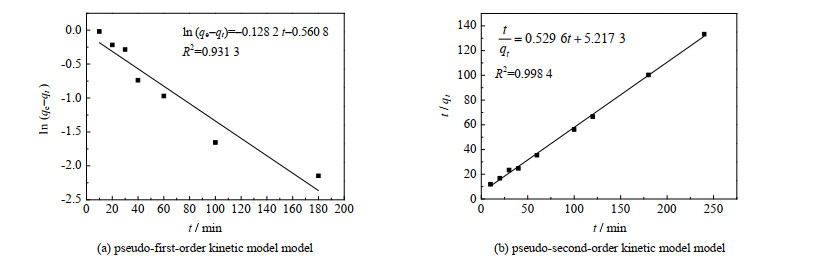
式中:qt为t时刻时Li+的吸附量,mg⋅g−1;k1和k2分别为一阶吸附模型和二阶吸附模型的速率常数,min−1,g⋅mg−1⋅min−1。为判断PS@[N8881Cl/C10]微胶囊吸附Li+过程是否符合拟一阶动力学模型,本研究以ln (qe-qt)为纵坐标、以时间t为横坐标作图,结果如图 12(a)所示,线性拟合度R2为0.931 3。绘制t/qt与t的关系图如图 12(b)所示,可以看到线性拟合度R2为0.998 4,比拟一阶动力学模型要高,说明PS@[N8881Cl/C10]微胶囊对Li+的吸附过程更适合用拟二阶动力学模型来描述。
|
图 12 吸附动力学线性拟合 Fig.12 Line fitting results of adsorption kinetics |
根据线性拟合方程的斜率和截距可以分别计算出吸附速率常数k1和k2,以及平衡吸附量qe,结果如表 2所示。拟一阶动力学模型计算出的Li+平衡吸附量(qe=0.95 mg⋅g−1)与实验结果(qe=1.80 mg⋅g−1)相差大,而拟二阶动力学模型计算得到的平衡吸附量(qe=1.90 mg⋅g−1)与实际量相近,这说明拟二阶动力学模型更能描述PS@[N8881Cl/C10]微胶囊的吸附动力学过程,且吸附速率常数为0.053 2 g⋅mg−1⋅min−1。
|
|
表 2 拟一阶动力学和拟二阶动力学模型参数 Table 2 Parameters of the Pseudo-first-order kinetic and Pseudo-second-order kinetic models |
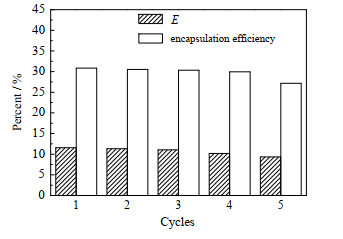
微胶囊的循环可利用性对于绿色环保和降低成本有着重要的意义和工业价值。因此,使用2.5 mg PS@[N8881Cl/C10] 微胶囊在25 ℃下吸附250 mL pH=10.42,ρ0为0.15 mg⋅L−1的水溶液,待达到吸附平衡后再进行脱附处理。这样对微胶囊进行5次循环的吸附和脱附后,每次循环使用后微胶囊对Li+的提取效果和微胶囊中DES的包裹率变化如图 13所示。从图可知,微胶囊经过3次循环使用后,提锂萃取率仍可保证11% 及以上,但随着微胶囊的继续使用,萃取率开始下降,经过5次循环后,微胶囊的提锂萃取率下降为9.36%。同时,微胶囊循环使用4次,其DES的包裹率呈略微下降趋势,从而导致循环使用后的微胶囊提锂萃取率下降。5次循环后,DES的包裹率开始明显下降,降为27.18%,这可能是由于提锂过程中微胶囊中N8881Cl/C10 DES结构中化学键或氢键的断裂;此时,DES的损失率为12%,相对较少。
|
图 13 五次循环中微胶囊对Li+的萃取率和包裹率 Fig.13 Extraction efficiency and encapsulation efficiency of microcapsules for Li+ in five cycles |
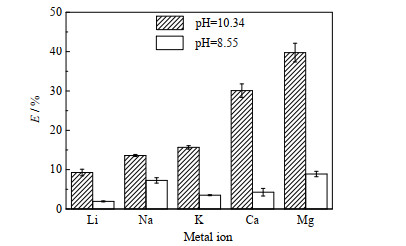
PS@[N8881Cl/C10]微胶囊对模拟海水中各金属离子的萃取率E进行分析,结果如图 14所示。从图可知,微胶囊在弱碱性(pH=8.55)条件下对各金属离子的吸附效果都不如强碱性(pH=10.34)条件下的吸附效果,其中,Li+萃取率从弱碱性条件下的1.94% 增加到强碱性条件的9.27%,由此说明溶液pH对吸附效果影响很大,这主要是因为DES在碱性条件下对金属离子有更高的亲和力。将模拟海水调至强碱性时,PS@[N8881Cl/C10]微胶囊对二价金属离子的萃取率远大于对一价金属离子的,其中对Mg2+的萃取率最高,能达39.76%。
|
图 14 微胶囊对模拟海水的金属离子萃取率 Fig.14 Extraction efficiency of metal ions in simulated seawater by microcapsule |
为详细研究PS@[N8881Cl/C10]微胶囊在不同条件下对各金属离子吸附的分配比和选择性差异,根据吸附前后的浓度变化将计算结果列于表 3中。从表可知,PS@[N8881Cl/C10]微胶囊对各金属离子吸附的分配比大小为:Kd, Mg > Kd, Ca > Kd, K > Kd, Na > Kd, Li,这说明微胶囊更易吸附二价金属离子;而在一价金属里,PS@[N8881Cl/C10]微胶囊对pH为10.34时的模拟海水中Li+的最大吸附分配比为10.22 L⋅g−1。通过选择性系数可以判断微胶囊对各金属离子的亲和力的差异。在强碱性条件下,微胶囊对模拟海水中锂钙、锂镁的选择性均小于对锂钾和锂钠的,且都小于1,说明PS@[N8881Cl/C10]微胶囊更有利于区分Li+与其他的二价金属离子。而微胶囊对钾钙和钾镁的选择性系数(< 1)相差不多,小于钾钠选择性(> 1),但是对钾钙和钾镁的选择性系数更远离1,选择性更高。总之,PS@[N8881Cl/C10]微胶囊更有利于将Li+、K+与其他的二价金属离子分离。
|
|
表 3 微胶囊对模拟海水和真实海水中各金属离子的分配比和选择性系数 Table 3 Distribution and selectivity coefficients of various metal ions absorbed by microcapsules from real and simulated seawater |
(1) 使用同轴共流微流体技术结合溶剂挥发法成功将DES包裹在微胶囊内,并制备出粒径均一的微胶囊颗粒,DES的包裹率在30.83%;微胶囊颗粒粒径为(173.38±4.96) µm。
(2) 当ρ0为0.15 mg⋅L−1、pH=10.42、固液比为0.01 g⋅L−1、温度为25 ℃、吸附时间为2 h时,微胶囊对Li+的平衡吸附量为1.80 mg⋅g−1,当ρ0增加到50 mg⋅L−1,PS@[N8881Cl/C10]微胶囊达到最大的吸附量,为32 mg⋅g−1。
(3) PS@[N8881Cl/C10] 微胶囊循环使用5次仍具有较好的稳定性,且对较强碱性的模拟海水中Li+提取的吸附分配比为10.22 L⋅g−1。
| [1] |
于建国, 孙庆, 裘晟波, 等. 支撑国家新能源战略发展的锂资源开发[J]. 无机盐工业, 2023, 55(1): 1-14. YU J G, SUN Q, QIU S B, et al. Lithium resources development supporting national new energy strategy development[J]. Inorganic Chemicals Industry, 2023, 55(1): 1-14. |
| [2] |
茹存一. 中国锂矿资源供需形势评价[D]. 北京: 中国地质大学(北京), 2021. RU C Y. Research on risk evaluation and situation of China's lithium resources supply [D]. Beijing: China University of Geosciences (Beijing), 2021. |
| [3] |
赵晓昱. 海卤水提锂新技术研究现状及展望[J]. 高校化学工程学报, 2017, 31(3): 497-508. ZHAO X Y. Review on new techniques for lithium extraction from seawater and brine[J]. Journal of Chemical Engineering of Chinese Universities, 2017, 31(3): 497-508. |
| [4] |
UM N, HIRATO T. Precipitation behavior of Ca(OH)2, Mg(OH)2, and Mn(OH)2 from CaCl2, MgCl2, and MnCl2 in NaOH-H2O solutions and study of lithium recovery from seawater via two-stage precipitation process[J]. Hydrometallurgy, 2014, 146: 142-148. DOI:10.1016/j.hydromet.2014.04.006 |
| [5] |
NISHIHAMA S, ONISHI K, YOSHIZUKA K. Selective recovery process of lithium from seawater using integrated ion exchange methods[J]. Solvent Extraction and Ion Exchange, 2011, 29(3): 421-431. DOI:10.1080/07366299.2011.573435 |
| [6] |
ZHANG Y, SUN W, XU R, et al. Lithium extraction from water lithium resources through green electrochemical-battery approaches: A comprehensive review[J]. Journal of Cleaner Production, 2021, 285: 124905. DOI:10.1016/j.jclepro.2020.124905 |
| [7] |
PARK M J, NISOLA G M, VIVAS E L, et al. Mixed matrix nanofiber as a flow-through membrane adsorber for continuous Li+ recovery from seawater[J]. Journal of Membrane Science, 2016, 510: 141-154. DOI:10.1016/j.memsci.2016.02.062 |
| [8] |
OOI K, MIYAI Y, KATOH S. Recovery of lithium from seawater by manganese oxide adsorbent[J]. Separation Science and Technology, 1986, 21(8): 755-766. DOI:10.1080/01496398608056148 |
| [9] |
CHITRAKAR R, KANOH H, MIYAI Y, et al. Recovery of lithium from seawater using manganese oxide adsorbent (H1.6Mn1.6O4) derived from Li1.6Mn1.6O4[J]. Industrial & Engineering Chemistry Research, 2001, 40(9): 2054-2058. |
| [10] |
LIU L F, ZHANG H W, ZHANG Y S, et al. Lithium extraction from seawater by manganese oxide ion sieve MnO2·0.5H2O[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2015, 468: 280-284. |
| [11] |
柏春, 郭敏, 张慧芳, 等. 离子筛型锂吸附剂吸附法从盐湖卤水/海水中提锂的研究进展[J]. 化工进展, 2017, 36(3): 802-809. BAI C, GUO M, ZHANG H F, et al. The research progress of extracting lithium from brine by lithium ion sieve[J]. Chemical Industry and Engineering Progress, 2017, 36(3): 802-809. |
| [12] |
李伟聪, 余柳莹, 沈剑, 等. 低共熔溶剂萃取水中二甲基甲酰胺的研究[J]. 高校化学工程学报, 2023, 37(2): 210-216. LI W C, YU L Y, SHEN J, et al. Extraction of dimethylformamide in water with deep eutectic solvents[J]. Journal of Chemical Engineering of Chinese Universities, 2023, 37(2): 210-216. |
| [13] |
HANADA T, GOTO M. Synergistic deep eutectic solvents for lithium extraction[J]. ACS Sustainable Chemistry & Engineering, 2021, 9(5): 2152-2160. |
| [14] |
YU L Y, WU K J, HE C H. Tailoring hydrophobic deep eutectic solvent for selective lithium recovery from dilute aqueous solutions[J]. Separation and Purification Technology, 2022, 281: 119928. |
| [15] |
陈国, 方柏山, 彭益强. 一种可控制生物微胶囊尺寸的气流微囊发生器[J]. 高校化学工程学报, 2008, 22(3): 466-470. CHEN G, FANG B S, PENG Y Q. A superposed air apparatus for size-controllable biocapsules preparation[J]. Journal of Chemical Engineering of Chinese Universities, 2008, 22(3): 466-470. |
| [16] |
DE SOUZA L R, AL-TABBAA A. High throughput production of microcapsules using microfluidics for self-healing of cementitious materials[J]. Lab on a Chip, 2021, 21(23): 4652-4659. |
| [17] |
ZHANG Q H, SUN S Y, LI S P, et al. Adsorption of lithium ions on novel nanocrystal MnO2[J]. Chemical Engineering Science, 2007, 62(18/20): 4869-4874. |
| [18] |
BILGIC A, CIMEN A, KURSUNLU A N, et al. Novel fluorescent microcapsules based on sporopollenin for removal and detection of Cu (II) ions in aqueous solutions: Eco-friendly design, fully characterized, photophysical & physicochemical data[J]. Microporous and Mesoporous Materials, 2022, 330: 111600. |
| [19] |
NG C, LOSSO J N, MARSHALL W E, et al. Physical and chemical properties of selected agricultural byproduct-based activated carbons and their ability to adsorb geosmin[J]. Bioresource Technology, 2002, 84(2): 177-185. |
| [20] |
CHAN L S, CHEUNG W H, MCKAY G. Adsorption of acid dyes by bamboo derived activated carbon[J]. Desalination, 2008, 218(1/2/3): 304-312. |




