2. 安徽元琛环保科技股份有限公司, 安徽 合肥 230012
2. Anhui Yuanchen Environmental Protection Technology Co., Ltd., Hefei 230012, China
作为最主要的温室气体,二氧化碳(CO2)所引发的环境问题已严重威胁到地球的生态平衡[1-2]。近年来,CO2的捕集、利用与封存(CCUS)技术越来越成为世界各国的研究热点[3]。化学吸收法是目前捕集CO2的常见方法之一。由于对CO2具有吸收能力强、选择性高等特点,单乙醇胺(MEA)、N-甲基二乙醇胺(MDEA)、二乙烯三胺(DETA)和哌嗪(PZ)等有机胺,已成为捕集CO2的主要化学吸收剂[4-7]。
具有对称结构的环状胺PZ,在前期研究中主要作为活化剂,添加至传统的MEA、MDEA和DETA等溶液中[8-9],以提高吸收剂对CO2的初始吸收速率。如Zoghi等[10]将PZ以物质的量比n(PZ): n(MDEA)=1:5加入MDEA溶液中,使MDEA对CO2的初始吸收速率提高了一倍。宋薇等[11]考察了质量分数为40% 的单一PZ溶液对CO2的吸收性能,393.15 K下的再生效率为71.1%;虞辉等[12]研究了温度和浓度对PZ平衡吸收量的影响和PZ的再生能力,结果显示PZ在循环10次后吸收容量仅降低9.8%。Kadiwala等[13]的研究表明,PZ对CO2的吸收量随着温度的升高而降低,随着CO2分压的升高而升高;Dash等[14]基于电解质非随机双液体理论的气液平衡模型预测了CO2在PZ溶液中的平衡溶解度,考察了CO2在PZ溶液中的气液平衡情况;Hilliard等[15]研究了PZ溶液吸收CO2的热效应;Freeman等[16]研究发现,PZ溶液的抗氧化能力是MEA溶液的3~5倍。
PZ在捕集CO2应用中具有反应速率快、耐热、降解性好等特点[17],但解吸率低严重制约了PZ的进一步应用。Nitta等[18]利用核磁碳谱(13C-NMR)和酸度系数pKa证实了PZ吸收CO2过程中生成的双氨基甲酸盐对解吸过程不利,PZ与不同叔醇胺的混合溶液在加热解吸时的解吸率随着叔醇胺pKa的降低而增加。当叔醇胺pKa小于9.34时,哌嗪氨基甲酸盐在加热时呈减少趋势;当叔醇胺pKa大于9.34时,哌嗪双氨基甲酸盐呈增加趋势,导致解吸速率和解吸率下降。因此,通过改变PZ的质子化程度,降低吸收过程中双氨基甲酸盐转化含量,可以达到提高PZ解吸性能的目的。荆丹琳[19]研究了不同酸对PZ质子化程度的影响,结果表明,无机酸对PZ的质子化作用高于有机酸。相关研究表明[20-21],常见无机强酸中,硫酸的稳定性高、酸性强、不易挥发,是常用的质子化试剂。因此,本研究选用硫酸(H2SO4)为质子化试剂,开展PZ质子化及其吸收/解吸CO2过程的研究。
为研究PZ在不同pH值下对CO2吸收/解吸过程的影响及其机制,本研究以PZ为吸收剂,以H2SO4调节PZ的质子化程度,采用13C-NMR研究PZ吸收/解吸CO2的过程。通过调节PZ溶液的pH值,结合PZ质子化曲线,控制质子化PZ的含量,以期降低PZ吸收CO2过程中双氨基甲酸盐的生成,为PZ和质子化PZ吸收/解吸CO2的过程提供相关理论支持。
2 实验材料与方法 2.1 实验原料哌嗪(C2H10N2,分析纯AR,国药试剂有限公司),浓硫酸(H2SO4,AR,国药试剂有限公司),盐酸(HCl,AR,国药试剂有限公司);CO2(南京上元气体有限公司,体积分数≥99.995%),N2(南京上元气体有限公司,体积分数≥99.999%)。
2.2 溶液配制配制质量分数为20% 的PZ溶液100.00 g于250 mL四口烧瓶中,将装有吸收液的吸收瓶置于水浴锅内恒温至303.15 K,利用pH计测定其初始pH值。通过加入不同质量的浓H2SO4调节溶液的pH值,搅拌稳定30 min后,即可获得不同质子化程度的PZ溶液。
2.3 PZ吸收/解吸CO2过程研究吸收实验:配制质量分数为20% 的PZ溶液100.00 g于250 mL四口烧瓶中,将其置于水浴锅内恒温至303.15 K。将模拟烟气CO2-N2(CO2体积分数为12%)以600 mL⋅min−1的体积流量先通入装有去离子水的水饱和瓶中,待流量稳定后,将水饱和的模拟烟气通入吸收瓶中,同时记录吸收过程中吸收剂pH值和温度的变化。每次取0.5 mL的样品加入滴定瓶中,采用盐酸滴定法测定样品中CO2的负载量(mol⋅mol−1,即每摩尔胺所能吸收的CO2的物质的量),每组重复3次。当连续2次测定吸收液中CO2的负载量保持不变时,即可认为吸收液对CO2已吸收饱和,此时停止实验。
解吸实验:准确称取吸收饱和的PZ溶液75.00 g置于解吸瓶中,并加入393.15 K的油浴锅中进行解吸实验,解吸过程中通入N2(体积流量为100 mL⋅min−1)吹扫,解吸时间持续240 min。
2.4 表征方法以氘代水为溶剂,采用超导核磁共振波谱仪(美国安捷伦科技有限公司,600 MHz 54 mmASC紧凑型永久主动屏蔽磁体)对样品进行13C-NMR分析。其工作参数为:采集时间t = 4.05 μs,弛豫时间t1 = 1 s,测量数NS = 256,测试温度T = 298.15 K。
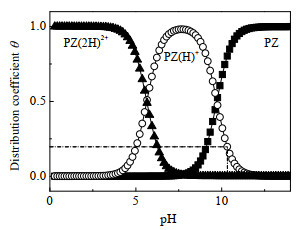
3 结果与讨论 3.1 pH对PZ质子化过程的影响PZ是一种二元弱碱,在溶液中通常以PZ、PZ(H)+和PZ(2H)2+这3种形式存在,其浓度分布与pKa值及溶液的pH密切相关。利用电位分析法[22]测得PZ的pKa1和pKa2分别为5.64和9.71。如图 1所示,通过计算可以进一步得到PZ溶液质子化过程中PZ、PZ(H)+和PZ(2H)2+的分布曲线。
|
图 1 303.15 K下PZ、PZ(H)+及PZ(2H)2+的分布曲线 Fig.1 Distribution curves of PZ, PZ(H)+ and PZ(2H)2+ at 303.15 K |
从图中可以看出,在初始阶段随着pH降低,PZ的分布系数θ不断下降,而PZ(H)+的分布系数则不断升高,当pH=7.50时其浓度达到最大,此时PZ(H)+的分布系数θ=0.98,PZ基本全部转化为PZ(H)+。当pH继续下降,PZ(H)+逐渐转化为PZ(2H)2+,使得PZ(2H)2+的分布系数逐渐升高。当溶液pH降低至3.50以下时,溶液中的PZ(H)+几乎全部转化为PZ(2H)2+。
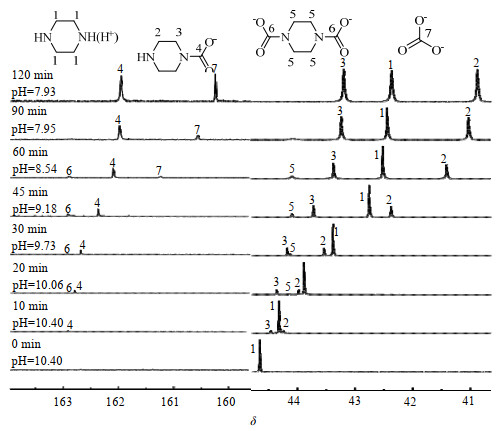
3.2 PZ吸收CO2过程研究实验采用质量分数为20% 的PZ溶液于303.15 K下进行CO2吸收实验,其过程中溶液的pH值及13C-NMR谱图中化学位移δ随吸收时间的变化情况如图 2所示。由图 2可知,随着CO2吸收过程的进行,溶液的pH值逐渐下降并趋于稳定,CO2的负载量逐渐增大。采用13C-NMR对吸收过程进行跟踪,从图 2可知通入CO2前,吸收剂的13C-NMR谱图中仅能检测到1个碳的核磁峰C1,这归属于PZ结构中的CH2特征峰。
|
图 2 PZ溶液吸收CO2过程中体系的13C-NMR变化谱图 Fig.2 13C-NMR spectra of PZ solutions during CO2 absorption processes |
当CO2吸收过程进行至10 min时,化学位移δ=162.90处出现了新的核磁峰C4,这归属于PZ与CO2反应生成的单氨基甲酸盐中的COO−,此时高场中也出现C1的偏移以及产物峰的分裂峰(C2和C3),表明PZ与CO2开始发生反应,该过程仅有一个胺基与CO2发生反应,形成的产物为哌嗪单氨基甲酸盐PZCOO−。随着CO2通入量的增加,吸收过程进行至20 min时,图中可以观察到δ=162.92处出现了一个新的氨基甲酸盐峰C6。与此同时,高场中峰C1继续向低场偏移并分裂出小的产物峰C5,这表明PZ中的另一个胺基也参与了CO2的吸收反应,即PZ中的2个胺基均与CO2发生了反应,形成了双氨基甲酸盐。当吸收过程进行至60 min时,溶液的pH降低至8.54,低场中δ=162.90处出现归属于HCO3−/CO32−的峰C7。由于HCO3−和CO32−间的质子转化速率较快,通常在13C-NMR中难以对两者的核磁峰进行区分[23]。此后双氨基甲酸盐的峰C6强度逐渐降低,除了峰C7发生大幅偏移外,其余各个峰并没有发生明显偏移。当吸收过程进行至90 min时,溶液pH=7.95,属于双氨基甲酸盐的峰C6基本消失,溶液中几乎没有双氨基甲酸盐存在。随着溶液吸收CO2的量增大,HCO3−/CO32−峰继续向高场偏移,且峰强度有增大的趋势,属于单氨基甲酸盐的峰C6强度也有轻微的减小。这表明PZ与CO2反应生成的双氨基甲酸盐发生水解生成了碳酸氢根,吸收后期也有部分单氨基甲酸盐参与水解。最终达到平衡时pH=7.93,由13C-NMR谱图可以观察到,此时溶液中吸收的CO2仅以单氨基甲酸盐和HCO3−/CO32−的形式共存。
通过对吸收平衡后的13C-NMR谱图分析,可以看出高场中峰C1、C2和C3强度相近,即n(PZCOO−): n(PZ(H)+)近似等于2:1,表明以哌嗪单氨基甲酸盐形式存在的CO2为0.67 mol⋅mol−1。实际上此时PZ对CO2平衡吸收量为0.70 mol⋅mol−1,这与理论吸收值1 mol⋅mol−1存在差距,原因可能为单端质子化的PZ(H)+不能与CO2继续反应。由图 1所示的分布曲线可知,当溶液pH接近于8时,单质子化的PZ(H)+的分布系数θ=0.98,表明溶液中几乎全部为单质子化PZ(H)+,而双质子化PZ(2H)2+和PZ含量基本可以忽略,此时溶液中的CO2含量也不再增加,即溶液中残余一个仲胺基的单质子化PZ(H)+无法继续与CO2反应。
综上所述,PZ溶液吸收CO2的反应机理如式(1)~(4)表示:
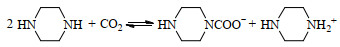
|
(1) |
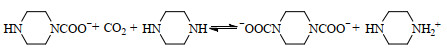
|
(2) |
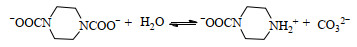
|
(3) |
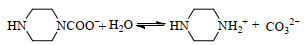
|
(4) |
通过H2SO4调节PZ溶液的pH值使其达到不同的质子化程度,表 1列出了不同初始pH值下PZ对CO2的吸收/解吸量。表中m(H2SO4)为H2SO4的质量,随着H2SO4加入量的增加,pH值不断降低,PZ质子化程度不断加深,即溶液中PZ(H)+含量不断增加。
|
|
表 1 不同初始pH值下PZ溶液的CO2吸收/解吸性能 Table 1 CO2 absorption-desorption performance of PZ solution at different initial pH values |
当m(H2SO4)=3.00 g时,n(PZ): n(H+)=1:0.25,溶液的pH=10.35。由图 1可知,该条件下PZ的θ=0.83,表明有摩尔分数为17.0% 的PZ与H2SO4反应并生成了PZ(H)+,其对CO2的吸收量则为0.70×0.83=0.564 mol⋅mol−1。该结果与表 1中的实验值(0.55 mol⋅mol−1)非常接近,误差仅为2.5%。这也表明经H2SO4质子化的PZ不能与CO2发生反应,进一步验证了单质子化PZ(H)+不与CO2反应的推论。
由表 1可知,m(H2SO4) < 3.00 g时,随着初始pH值的降低,PZ对CO2的饱和吸收量随之降低,实际吸收量与理论吸收量基本吻合,最大误差不超过2.5%。这是因为随着H2SO4的加入,溶液中PZ的质子化程度不断增大,而单质子化的PZ已无法与CO2生成稳定的氨基甲酸盐,因此饱和吸收量也在逐渐降低;而溶液中未被质子化的PZ仍可与CO2反应生成氨基甲酸盐,当溶液初始pH > 10.33时,PZ溶液中的单氨基甲酸盐可大量稳定存在,发生如式(1)所示的化学反应。当CO2吸收达到饱和时,溶液中所有的PZ均转化为PZ(H)+和哌嗪单氨基甲酸盐,因此实际吸收量与理论吸收量较为吻合。而当m(H2SO4) > 4.00 g时,由表 1可知理论吸收量与实际吸收量出现严重偏离。其可能的原因是溶液的初始pH < 10.17时,吸收饱和的PZ溶液中的单氨基甲酸盐不能稳定存在,发生如式(4)所示的可逆反应,此时溶液中部分未质子化的PZ也无法与CO2反应形成哌嗪单氨基甲酸盐,因此实际吸收量呈现快速下降的趋势,且低于理论吸收量。
此外,当m(H2SO4) < 3.00 g时,溶液的整体解吸量并没有太大变化,维持在0.47~0.51 mol⋅mol−1,但随着吸收量的降低,溶液中未解吸的CO2含量也随之降低。这可能是由于溶液初始pH在10.17~11.87时,吸收过程中所产生的哌嗪双氨基甲酸盐不能稳定存在,其水解产生的质子化的哌嗪单氨基甲酸盐含量逐渐减少,因此未解吸的CO2含量逐渐降低;但溶液中所能形成的哌嗪单氨基甲酸盐含量大致不变,所以整体解吸量也大致维持不变。而当m(H2SO4) > 4.00 g时,解吸率几乎突变至100%,这可能是由于吸收过程中不产生稳定的哌嗪双氨基甲酸盐,且有部分哌嗪单氨基甲酸盐不能稳定存在,导致吸收量和解吸量均大幅下降,而解吸率大幅升高。
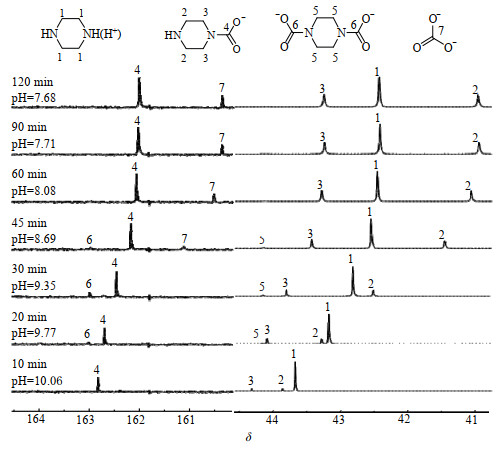
图 3为初始pH=10.35的PZ溶液在303.15 K下吸收CO2过程中溶液的pH值及13C-NMR谱图随吸收时间的变化情况。由图可知,加入H2SO4后,PZ溶液中PZ(H)+的含量明显增多。与纯PZ溶液吸收CO2过程相比,吸收过程中各物质的变化规律基本一致。
|
图 3 pH=10.35时的PZ吸收CO2过程中的13C-NMR变化谱图 Fig.3 13C-NMR spectra of PZ solutions during CO2 absorption processes at pH=10.35 |
同时,H2SO4的加入引起溶液pH降低,溶液中部分PZ与H2SO4生成PZ(H)+,导致生成的哌嗪双氨基甲酸盐含量明显低于纯PZ吸收CO2过程中生成的双氨基甲酸盐。与纯PZ溶液相比,相同条件下质子化哌嗪溶液对CO2的吸收量从0.70 mol⋅mol−1降至0.55 mol⋅mol−1,但解吸率提高了22.0%,解吸量仅相差0.03 mol⋅mol−1,表明PZ质子化能够抑制哌嗪双氨基甲酸盐的生成,从而有效提高解吸性能,促进了PZ吸收剂的再生。
4 结论本研究探究了PZ吸收CO2过程中溶液的物质变化情况,以及不同质子化程度对其吸收/解吸CO2的影响。结合PZ溶质子化过程中PZ、PZ(H)+和PZ(2H)2+的分布曲线和对CO2吸收过程的核磁图谱跟踪,揭示了PZ吸收CO2的过程机理。得出结论:
(1) PZ在吸收CO2过程中首先形成单氨基甲酸盐,之后再形成双氨基甲酸盐。其中双氨基甲酸盐不能稳定存在,当溶液pH≤8时,哌嗪双氨基甲酸盐的一端会发生水解,产生质子化的单氨基甲酸盐和HCO3−,该物质的存在不利于CO2解吸。
(2) 随着H2SO4加入量的增大,PZ质子化程度增大,生成的哌嗪双氨基甲酸盐减少,而质子化的PZ(H)+不能够与CO2发生反应,导致吸收容量降低、解吸率升高,有利于PZ吸收剂的再生。当硫酸加入量为3.00 g时,质子化PZ溶液的初始pH=10.35,相同条件下对CO2的吸收量下降了21.4%,解吸率提高了22.0%。
| [1] |
OSMAN A I, HEFNY M, ABDEL MAKSOUD M I A, et al. Recent advances in carbon capture storage and utilization technologies: A review[J]. Environmental Chemistry Letters, 2021, 19(2): 797-849. DOI:10.1007/s10311-020-01133-3 |
| [2] |
沈丽, 刘凡, 沈遥, 等. 新型AEP-相变吸收剂捕集CO2研究[J]. 高校化学工程学报, 2021, 35(6): 1067-1072. SHEN L, LIU F, SHEN Y, et al. Study on novel AEP-based biphasic solvents for CO2 capture[J]. Journal of Chemical Engineering of Chinese Universities, 2021, 35(6): 1067-1072. DOI:10.3969/j.issn.1003-9015.2021.06.015 |
| [3] |
YAN J, ZHANG Z. Carbon capture, utilization and storage (CCUS)[J]. Applied Energy, 2019, 235: 1289-1299. DOI:10.1016/j.apenergy.2018.11.019 |
| [4] |
ZHANG R L, CHEN J, CAO G R, et al. Effect of molecular structure on excess molar enthalpy of amine-based carbon dioxide absorbent and water[J]. Thermochimica Acta, 2020, 685: 178514. DOI:10.1016/j.tca.2020.178514 |
| [5] |
OKO E, WANG M, JOEL A S. Current status and future development of solvent-based carbon capture[J]. International Journal of Coal Science & Technology, 2017, 4(1): 5-14. |
| [6] |
孙铖, 刘凡, 沈丽, 等. 等.[N1111][Lys] 溶液吸收二氧化碳的机理与动力学[J]. 高校化学工程学报, 2020, 34(5): 1135-1142. SUN Y, LIU F, SHEN L, et al. Mechanism and kinetics of CO2 absorption with aqueous solution of[N1111][Lys][J]. Journal of Chemical Engineering of Chinese Universities, 2020, 34(5): 1135-1142. DOI:10.3969/j.issn.1003-9015.2020.05.006 |
| [7] |
SHENG M P, LIU C G, GE C Y, et al. Mass-transfer performance of CO2 absorption with aqueous diethylenetriamine (DETA)-based solutions in a packed column with dixon rings[J]. Industrial & Engineering Chemistry Research, 2016, 55(40): 10788-10793. |
| [8] |
LIU J, LI X S, ZHANG Z W, et al. Promotion of CO2 capture performance using piperazine (PZ) and diethylenetriamine (DETA) bi-solvent blends[J]. Greenhouse Gases: Science and Technology, 2019, 9(2): 349-359. DOI:10.1002/ghg.1851 |
| [9] |
CUCCIA L, DUGAY J, BONTEMPS D, et al. Monitoring of the blend monoethanolamine/methyldiethanolamine/water for post-combustion CO2 capture[J]. International Journal of Greenhouse Gas Control, 2019, 80: 43-53. DOI:10.1016/j.ijggc.2018.11.004 |
| [10] |
ZOGHI A T, FEYZI F, ZARRINPASHNEH S. Experimental investigation on the effect of addition of amine activators to aqueous solutions of N-methyldiethanolamine on the rate of carbon dioxide absorption[J]. International Journal of Greenhouse Gas Control, 2012, 7: 12-19. DOI:10.1016/j.ijggc.2011.12.001 |
| [11] |
宋微, 张永春, 李桂民, 等. 哌嗪及其衍生物与羟乙基乙二胺的混合溶液吸收CO2性能[J]. 化工进展, 2010, 29(10): 1994-1998. SONG W, ZHANG Y C, LI G M, et al. Absorption of CO2 by mixed solution of piperazine and its derivatives with 2-(aminoethylamino) ethanol[J]. Chemical Industry and Engineering Progress, 2010, 29(10): 1994-1998. |
| [12] |
虞辉, 陈泽智, 龚惠娟, 等. CO2在哌嗪水溶液中的吸收和再生特性研究[J]. 环境保护科学, 2013, 39(6): 1-5. YU H, CHEN Z Z, GONG H J, et al. Study on absorption and regeneration characteristics of carbon dioxide in aqueous piperazine solutions[J]. Environmental Protection Science, 2013, 39(6): 1-5. DOI:10.3969/j.issn.1004-6216.2013.06.001 |
| [13] |
KADIWALA S, RAVER A V, HENNI A. High pressure solubility of carbondioxide (CO2) in aqueous piperazine solutions[J]. Fluid Phase Equilibria, 2010, 292(12): 20-28. |
| [14] |
DASH S K, SAMANTA A, SAMANTA A N, et al. Vapour liquid equilibria of carbon dioxide in dilute and concentrated aqueous solutions of piperazine at low to high pressure[J]. Fluid Phase Equilibria, 2011, 300(1/2): 145-154. |
| [15] |
HILLIARD M D. A predictive thermodynamic model for an aqueous blend of potassium carbonate, piperazine, and monoethanolamine for carbon dioxide capture from flue gas[D]. Austin: University of Texas, 2008.
|
| [16] |
FREEMAN S A, DAVIS J, ROCHELLE G T. Degradation of aqueous piperazine in carbon dioxide capture[J]. International Journal of Greenhouse Gas Control, 2010, 4(5): 756-761. DOI:10.1016/j.ijggc.2010.03.009 |
| [17] |
ROCHELLE G, CHEN E, FREEMAN S, et al. Aqueous piperazine as the new standard for CO2 capture technology[J]. Chemical Engineering Journal, 2011, 171(3): 725-733. DOI:10.1016/j.cej.2011.02.011 |
| [18] |
NITTA M, HAYASHI K, FURUKAWA Y, et al. 13C-NMR study of acid dissociation constant (pKa) effects on the CO2 absorption and regeneration of aqueous tertiary alkanolamine-piperazine blends[J]. Energy Procedia, 2014, 63: 1863-1868. DOI:10.1016/j.egypro.2014.11.194 |
| [19] |
荆丹琳. 羟烷基哌嗪水相法合成及脱硫性能的研究[D]. 合肥: 合肥工业大学, 2019. JING D L. Research on synthesis of hydroxyalkylpiperazine by aqueous phase and desulfurization performance[D]. Hefei: Hefei University of Technology, 2019. |
| [20] |
李娇娇, 赵卫峰, 张改, 等. 浓硫酸法快速制备质子化g-C3N4纳米带及其紫外光催化降解有机染料研究[J]. 高等学校化学学报, 2018, 39(12): 2719-2724. LI J J, ZHAO W F, ZHANG G, et al. Facile preparation of protonated g-C3N4nanobelts in concentrated sulfuric acid with enhanced UV light photocatalytic activity for photodegradation of organic dyes[J]. Chemical Journal of Chinese Universities, 2018, 39(12): 2719-2724. DOI:10.7503/cjcu20180460 |
| [21] |
SUN Y, ZHAG Y L, ZHANG L H, et al. SO2 capture using pH-buffered aqueous solutions of protic triamine-based ionic liquid[J]. Energy & Fuels, 2017, 31(4): 4193-4201. |
| [22] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 化学试剂电位滴定法通则: GB/T 9725-2007[S]. 北京: 中国标准出版社, 2007. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China: Chemical reagent - General rule for potentiometric titration: GB/T 9725-2007. [S]. Beijing: Standards Press of China, 2007. |
| [23] |
JAKBSEN J P, KRANE J, SVENDSEN H F. Liquid-phase composition determination in CO2-H2O-alkanolamine systems: An NMR study[J]. Industrial & Engineering Chemistry Research, 2005, 44(26): 9894-9903. |




