2. 浙江省 抗真菌药物重点实验室, 浙江 台州 318100;
3. 浙江海正股份有限公司, 浙江 台州 318100
2. Zhejiang Key Laboratory of Antifungal Drugs, Taizhou 318100, China;
3. Zhejiang Hisun Pharmaceutical Company Limited, Taizhou 318100, China
木糖醇为五碳糖醇,分子式为C5H12O5,白色结晶状,溶解度等理化性质与蔗糖很相似,是木糖代谢的正常中间产物,广泛存在于自然界中,在化工、食品、医药等工业中有着广泛应用[1, 2],木糖醇是人体糖类代谢的中间体,食用后不消耗胰岛素,并且木糖醇具有特殊的防龋功能,可做糖尿病人的营养剂、治疗剂及儿童防龋食品,同时木糖醇还具有降低血糖浓度[3]、促进钙吸收[4]等多种功能。
近年来,木糖醇的市场需求不断扩大,国内木糖醇的年产值已超过13亿元,今后3年,国际市场上木糖醇总需求量将达10万吨以上。目前,木糖醇工业生产主要采用化学催化加氢法[5]和利用微生物直接发酵半纤维素水解液生产木糖醇,这两种方法的原料多来源于富含戊糖的玉米芯、甘蔗渣、稻壳等农副产品,这些原料的处理需要经过高温水解,需要高温高压、昂贵的催化剂和繁杂的分离净化工序且成本高。针对这些问题,国际上从20世纪70年代开始研究用微生物发酵法来生产木糖醇。生物法制备木糖醇的研究已经引起了全球的关注,酵母如:Candida[6],Saccharomyces,和Pichia可以通过木糖还原酶生产木糖醇;细菌包括Enterobacter liquaefaciens、Myobactenum smegmatis、Corymebacterium 等,其中M.smegmatis可将70%的木糖转化为木糖醇;丝状真菌如根霉、曲霉等在木糖培养基中能产生低浓度的木糖醇。但丝状真菌产木糖醇的效率不高。虽然酵母菌比较容易将木糖转化生成木糖醇,但酵母菌株中只有一部分能利用木糖,能大量积累木糖醇的更少。而 E. coli BL21(DE3) 作为研究得最为详尽的微生物,由于其繁殖迅速,培养代谢易于控制,培养成本低,表达量高,在自然条件下可以代谢木糖并且可以作为基因克隆表达受体细胞[7]等优点,因此将木糖还原酶基因导入到 E. coli 细胞内,可以通过进一步发酵来生产木糖醇。
本研究通过分析木糖还原为木糖醇的代谢途径,应用Red同源重组技术敲除 E. coli BL21(DE3)中木糖醇合成的支路代谢途径中的 xylB 基因[8],构建了单敲除突变菌DxylB/E. coli BL21(DE3)。从 Neurospora crassa[9, 10] 中克隆xr 完整基因,并在DxylB/E. coli BL21(DE3)中进行表达。木糖还原酶[11~14]是NADPH 依赖的氧化还原酶,为了提高微生物体内 NADPH[15~18]的量,本文以 E. coli K-12 基因组为模板,获得了磷酸戊糖途径(PPP)中产生 NADPH 的两个关键基因— gnd (6-磷酸葡萄糖酸脱氢酶) 和 zwf (葡萄糖6-磷酸脱氢酶) 基因,将这两个基因依次连接到双启动子载体pCDFDuet-1 上构建pCDFDuet-gnd-zwf 重组质粒,与pET30a-xr 共转化到 DxylB/E. coli BL21(DE3)内表达,以期大量提高木糖醇的产率,为木糖醇的工业化生产打下基础。
2 材料与方法 2.1 菌株和质粒菌株:粗糙脉胞菌(Neurospora crassa)、E. coli K-12、E. coli BL21(DE3)、E. coli DH5a 均为本实验室保存菌株。
质粒:pET-30a(+)(Kanar)、pCDFDuet-1(Smr) 为本实验室保存质粒;质粒 pKD46(Ampr)、pKD3(Cmr)、pCP20(Cmr,Ampr) 为浙江大学于洪巍教授赠送。
2.2 培养基细菌LB培养基(g⋅L-1) 蛋白胨10,酵母抽提物5,NaCl10。
液体种子培养基(g⋅L-1) 葡萄糖10,蛋白胨10,酵母抽提物5。
发酵培养基 (g⋅L-1) 蛋白胨15.7,酵母抽提物7.7,K2HPO4 4.7,NaC l7.7,MgSO4 2.3,木糖 40,葡萄糖 20,阿拉伯糖 30。
2.3 xylB 基因的敲除| 表 1 本研究所用引物 Table 1 Primers used in this study |
采用Primer 5.0软件根据GenBank中xylB和质粒pKD3中的cat基因序列信息,设计引物,其中下划线部分为同源臂序列。引物KZ1和KZ2用于扩增cat基因以替换xylB基因编码区;引物JD1和JD2为xylB基因敲除后重组菌鉴定引物,两条引物各位于打靶序列的左右两侧。
2.3.2 感受态的制备与电击转化将30℃过夜培养的含有pKD46的E. coliBL21(DE3) 按50:1的量接种至50 mL LB培养基(氨苄青霉素的浓度为70 mg⋅mL-1),30℃ 培养至OD600值为0.25,加入终浓度为30 mmol⋅L-1 L-阿拉伯糖继续培养至OD600值为0.5~0.6,冰上预冷10 min,4100 r⋅min-1,4℃ 离心10 min,弃培养基,用预冷10% 甘油离心洗涤三次,浓缩100倍成0.5 mL的感受态细胞,-80℃保存。将同源臂引物扩增的氯霉素抗性基因片段约200 ng加入感受态细胞,混匀,转入0.2 cm电击杯中,用Bio-Rad电击仪作电转化。电击条件:200 Ω,25 μF,电击电压2.3 kV,电击时间4.5 ms。电击后迅速加入1 mL的LB,150 r⋅min-1,37℃ 培养1 h,之后涂于氯霉素(氯霉素浓度为34 mg⋅mL-1)平板上,12 h后用PCR法鉴定长出的氯霉素抗性克隆。
2.4 载体pET30a-xr、pCDFDuet-gnd-zwf 的构建 2.4.1 粗糙脉胞菌(Neurospora crassa)和 E. coli K-12 培养及基因组制备在无菌条件下,将斜面培养的Neurospora crassa 菌种接种于M9液体培养基中,250 mL 三角瓶中装50 mL培养基,30℃ 150 r⋅min-1 培养48 h。在无菌条件下,将平板上的E. coli K-12 菌种接种于 LB 液体培养基中,250 mL 三角瓶中装 50 mL 培养基,37℃ 200 r⋅min-1 培养12 h。12000 r⋅min-1 离心后取下层培养物,用基因提取试剂盒提取基因组。
2.4.2 xr、gnd、zwf 基因片段的克隆采用Primer 5.0软件根据GenBank中xr、gnd和zwf基因序列信息,设计出引物XR1和XR2、GD1和GD2、ZF1和ZF2(划线部分为限制性酶切位点)。以XR1和XR2为引物,以上抽提Neurospora crassa 基因组为模板,PCR扩增xr基因。以GD1、GD2和ZF1、ZF2 分别为引物,以上抽提E. coli K-12 基因组为模板,PCR扩增gnd 和 zwf 基因。
2.4.3 pET30a-xr 、pCDFDuet-gnd-zwf 目标载体的构建以XR1(含BglⅡ位点)和 XR2(含EcoRⅠ位点)为引物,扩增 xr 基因。PCR 程序为:95℃,2 min;98℃,10 s;55℃,15 s;72℃,9 s;循环30次;72℃,5 min。切胶回收PCR产物,以 BglⅡ和 EcoRⅠ双酶切,并重组至经相同双酶切的pET30a,重组质粒命名为 pET30a-xr,并转化到 E. coli DH5a,测序。测序成功后转化到 DxylB/E. coli BL21(DE3)中。
以 GD1(含EcoRⅠ位点)和 GD2(含SalⅠ位点)为引物,扩增gnd 基因。PCR程序如上述,延长时间至 15 s,切胶回收PCR产物,以 SalⅠ和 EcoRⅠ酶切,并重组至经相同酶切的 pCDFDuet-1,重组质粒命名为 pCDFDuet-gnd,并转化到 E. coli DH5a,测序。
以ZF1(含BglⅡ位点)和 ZF2(含XhoⅠ位点)为引物,扩增zwf 基因。过程如上述,切胶回收PCR产物,以BglⅡ和XhoⅠ酶切,并重组至经相同酶切的pCDFDuet-gnd,重组质粒命名为pCDFDuet-gnd-zwf,并转化到 E. coli DH5a,测序。测序成功后转化到 DxylB/E. coli BL21(DE3)(含pET30a-xr)中。
2.5 重组蛋白的诱导表达感受态细胞的制备及质粒转化按常规CaCl2法。pET30a-xr 转化后的细菌用含硫酸卡那霉素(Kana)的 LB(Luria-Beryani)平板进行筛选。挑取单克隆接种于含Kana的LB培养基中,培养12 h(37℃,200 r⋅min-1),按1:50的体积比接种于含 Kana 的 LB 培养基中,培养扩增至600 nm光吸收度为0.6~0.8,加入诱导剂异丙基-β-D-硫代半乳糖苷(IPTG)至最终浓度为1.0 mmol⋅L-1,26℃诱导12h,离心收集细胞,进行分离胶质量分数为16%的十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析。pET30a-xr和 pCDFDuet-gnd-zwf转化后的细菌用含硫酸卡那霉素(Kana)和链霉素(Sm)的 LB平板进行筛选。蛋白诱导表达方法如上所述。
2.6 酶活测定方法将诱导后的发酵液放置冰上冷却,4℃、8000 r⋅min-1离心5 min,弃上清,收获菌体。用50 mmol⋅L-1的磷酸钾缓冲液清洗菌体两次,4℃、8000 r⋅min-1离心5 min,弃上清,收获菌体。洗涤后的菌体浓缩后重悬于相应的磷酸钾缓冲液中。将装有菌体的离心管于冰浴中,用超生细胞破碎仪破胞,超声功率300 W,超声时间3 s,间隔时间7 s,超声5 min。破碎后的悬液于4℃、12000 r⋅min-1离心20 min,收集上清液即为粗酶液。用分光光度计在340 nm处测定NADPH依赖的木糖还原酶活力[19]。木糖转化为木糖醇为其还原反应,需要辅酶NADPH,木糖醇转化为木糖为其氧化反应,需要辅酶NADP+。
通过测量单位时间内酶催化反应体系在340 nm处吸光度的增量从而计算出木糖还原酶的活性。反应体系中包括:100 mmol⋅L-1的磷酸钾缓冲液(pH = 6.5),0.2 mol⋅L-1 D-木糖溶液,0.15 mmol⋅L-1 NADPH溶液,加入适量的粗酶液启动反应。
6-磷酸葡萄糖酸脱氢酶是一种氧化还原酶,它的催化活性是可逆的,6-磷酸葡萄糖酸转化为核酮糖-5-磷酸为其氧化反应,需要辅酶NADP+,产生NADPH。
酶活测定方法参考上述XR的测定。
葡萄糖6-磷酸脱氢酶是一种氧化还原酶,它的催化活性是可逆的,葡萄糖6-磷酸转化为6-磷酸葡萄糖酸为其氧化反应,需要辅酶NADP+,产生NADPH。
酶活测定方法参考上述XR的测定。
2.7 木糖醇的检测方法采用高效液相色谱(HPLC)测定发酵液的成分。木糖、葡萄糖、阿拉伯糖、木糖醇和醋酸采用示差折光检测器(RID-10A)。分析条件:Dikma Nucleosil 5 μ NH2 10 nm 柱,流动相为乙腈(v):水(v) = 80:20,流速1.0 mL⋅min-1,柱温25℃。
3 实验结果与讨论 3.1 构建 DxylB/E. coli BL21(DE3)突变株以质粒pKD3为模板,用含有xylB基因同源臂的引物KZ1和KZ2扩增氯霉素抗性基因,将PCR产物转入含有pKD46质粒的大肠杆菌感受态细胞中,在氯霉素平板上进行转化子的初步筛选。为排除假阳性菌或整合到错误位置的重组菌,用鉴定引物JD1和JD2进行PCR扩增,根据重组前后序列长度的变化进行鉴定。xylB基因敲除前,PCR扩增得到1799bp片段(泳道1),第一次重组后PCR扩增得到1385bp片段(泳道2),该片段序列测定正确,获得大肠杆菌DxylB/E. coli BL21(DE3)::cat。将pCP20质粒转入大肠杆菌DxylB/E. coli BL21(DE3)::cat的感受态细胞中,消除氯霉素抗性基因,用鉴定引物JD1和JD2进行PCR扩增,获得596bp片段(泳道3),序列测定正确,获得DxylB/E. coli BL21(DE3)突变株。
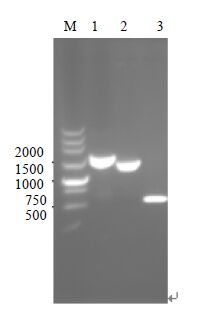
|
图 1 xylB基因敲除鉴定 Fig.1 Identification of knock out of xylB gene |
上述两个载体的构建示意图如下图所示(图 2、3),分别挑选阳性的重组菌株,用 T7 primer 测定序列,结果表明 pET30a-xr、pCDFDuet-gnd-zwf 载体已经构建成功。
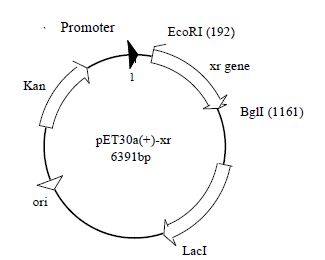
|
图 2 pET30a (+)-xr 载体图谱 Fig.2 pET30a(+)-xr vector map |
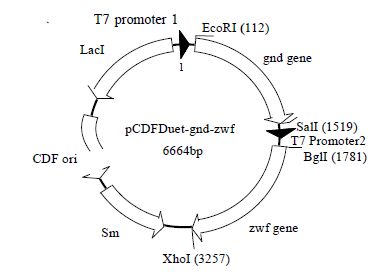
|
图 3 pCDFDuet-gnd-zwf载体图谱 Fig.3 pCDFDuet-1-gnd-zwf vector maps |
pET30a-xr、pCDFDuet-gnd-zwf质粒表达产物的质量分数为16%的 SDS-PAGE 电泳表明(见图 4),在最佳条件(26℃、1.0mmol⋅L-1 IPTG,诱导工程菌12 h)下,工程菌获得高效表达,表达蛋白分子量约为 38、51、54 kDa,与预期的目标蛋白分子量相符。
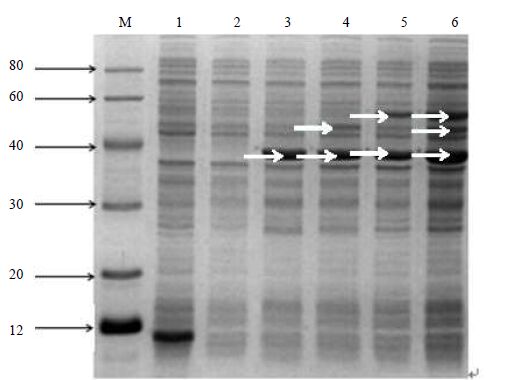
|
图 4 目的蛋白的16%聚丙烯酰胺凝胶电泳 Fig.4 16% SDS-PAGE results of target protein M. Marker(kDa) 1. pET30a(+) negative control 2. pCDFDuet-1 negative control 3. xr protein 4. 5. xr and zwf protein (control) 6. xr, gnd and zwf protein |
酶活比活力定义为:每毫克蛋白,每分钟转化 NADPH的μmol 数,即 U⋅mg-1(蛋白)。蛋白含量的测定采用 Coomassie Blue 法,以牛血清蛋白为标准品。酶活数据如表 2所示。由表 2知木糖还原酶在不同菌株中都表现出较高的活性,与 Ryan W [20] 等人的研究结果类似。
| 表 2 不同菌株中三种酶活测定数据 Table 2 Activity of the three enzymes in different strains |
发酵对于提高产物浓度具有重要意义,也是验证菌株生产能力的主要手段[21~23]。 选取含有 pET30a-xr、pET30a-xr/ pCDFDuet-gnd-zwf 载体的DxylB/E. coli BL21(DE3)菌株以及含有pET30a-xr载体的E. coli BL21(DE3)菌株,不含载体的E. coli BL21(DE3)菌株作为阴性对照,以菌体初始浓度 OD600 为2.0的接种量,在好氧条件下进行木糖醇发酵试验,以OD600 检测菌体生长,HPLC分析产物,结果见图 5。通过比较可以看出,阴性对照E. coli BL21(DE3)菌株不能将木糖转化为木糖醇,在有葡萄糖和L-阿拉伯糖存在的条件下木糖几乎不被利用;E. coli BL21(pET30a-xr)菌株可以将木糖转化为木糖醇,木糖醇转化率为51.51%,乙酸产率为0.056 g⋅(L·h)-1;DxylB/E. coli BL21(pET30a-xr)菌株木糖醇的转化率为60.9%,比 E. coli BL21(pET30a-xr)菌株转化率提高9.39%,Cirino[24]研究结果表明xylB基因的敲除可以提高木糖醇的产率,DxylB/E. coli(pET30a-xr+pCDFDuet-gnd-zwf)菌株木糖醇转化率为75.83%,比E. coli BL21(pET30a-xr)菌株转化率提高24.32%,比DxylB/E. coli BL21(pET30a-xr)菌株转化率提高14.93%,Kwon等人[25]研究结果表明,通过提高辅酶再生能力,可以使木糖醇的产率提高 1.9 倍,乙酸产率为0.042 g⋅(L⋅h)-1。
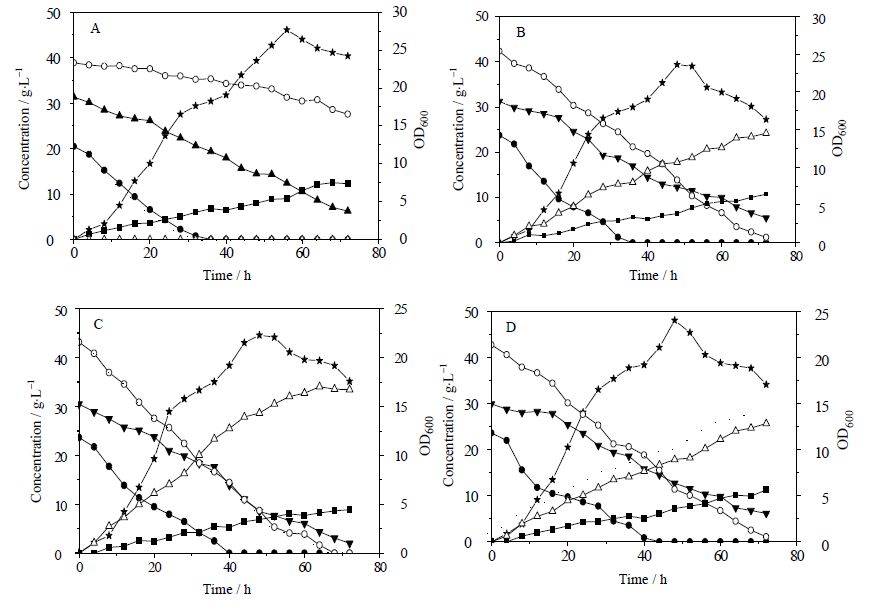
|
图 5 木糖醇发酵生长曲线和产物分析 Fig.5 Xylitol fermentation growth curves and product analysis A. negative control strain E. coli BL21 (DE3) B. E. coli BL21(pET30a-xr) C. ΔxylB/E. coli BL21(pET30a-xr) D. ΔxylB/E. coli BL21(pET30a-xr+pCDFDuet-1-gnd-zwf) ★ OD600 ● glucose ▼ L-arabinose ° D-xylose △ xylitol ■ acetic acid |
(1) 利用Red/ET 重组系统,成功地敲除了大肠杆菌的xylB基因,构建了xylB缺失的工程菌株,而且在操作位点没有留下选择标志,该菌株在减少木糖支路代谢方面发挥一定的作用。
(2) 粗糙脉胞菌(Neurospora crassa)中的木糖还原酶可以成功地在大肠杆菌中进行异源表达,该研究结果对于利用植物半纤维素废弃物生产木糖醇具有重要意义。
(3) 辅酶再生系统可以明显地提高木糖醇的转化效率,通过增强磷酸戊糖途径中gnd 和 zwf 两个辅酶再生基因的菌株可以提高木糖醇的转化效率。
(4) 对于本课题进一步深入研究的建议,笔者认为可以从消除“葡萄糖效应”和降低代谢过程中乙酸的产量或增强对乙酸耐受能力进行深入研究。
| [1] | Khalil A S, Collins J J . Synthetic biology:applications come of age[J]. Nature Reviews. Genetics , 2010, 11 (5) : 367-379 DOI:10.1038/nrg2775 |
| [2] | Jarboe L R, Zhang X, Wang X . Metabolic engineering for production of biorenewable fuels and chemicals:contributions of synthetic biology[J]. Journal of Biomedicine & Biotechnology , 2010, 10 (55) : 76-94 |
| [3] | Ferreura A S, Souza M A, Barbosa N R . Leishmania amazonensis:xylitol as inhibitor of macrophage infection and stimulator of macrophage nitric oxide production[J]. Experimental Parasitology , 2008, 119 (1) : 74-79 DOI:10.1016/j.exppara.2007.12.012 |
| [4] | Weissman J D, Fernandez F, Peter H . Xylitol nasal irrigation in the management of chronic rhinosinusitis:a pilot study[J]. Laryngoscope , 2011, 121 (11) : 2468-2472 DOI:10.1002/lary.22176 |
| [5] | Granstrom T B, Izumori K, Leisola M . A rare sugar xylitol. Part i:The biochemistry and biosynthesis of xylitol[J]. Applied Microbiology and Biotechnology , 2007, 74 (2) : 277-281 DOI:10.1007/s00253-006-0761-3 |
| [6] | Mussatto S I, Roberto I C . Kinetic behavior of Candida guilliermondii yeast during xylitol production from highly concentrated hydrolysate[J]. Process Biochemistry , 2004, 39 (11) : 1433-1439 DOI:10.1016/S0032-9592(03)00261-9 |
| [7] | Yu Chao, Cao Yujin, Zou Huibin . Metabolic engineering of Escherichia coli for biotechnological production of high-value organic acids and alcohols[J]. Applied Microbiology and Biotechnology , 2011, 89 (3) : 573-583 DOI:10.1007/s00253-010-2970-z |
| [8] | Cao Yujin, Xian Mo, Zou Huibin . Metabolic engineering of Escherichia coli for the production of xylonate[J]. Microbial Production of Bulk Chemicals , 2013, 8 (7) : 1-7 |
| [9] | Attfield Paul V, Bell Philip J L . Use of population genetics to derive nonrecombinant Saccharomyces cerevisiae strains that grow using xylose as a sole carbon source[J]. FEMS Yeast Research , 2006, 6 (6) : 862-868 DOI:10.1111/fyr.2006.6.issue-6 |
| [10] | Bera Aloke K, Ho Nancy W Y, Khan Aftab . A genetic overhaul of Saccharomyces cerevisiae 424a (lnh-st) to improve xylose fermentation[J]. Journal of Industrial Microbiology & Biotechnology , 2011, 38 (5) : 617-626 |
| [11] | Nair Nikhil U, Zhao Huimin . Selective reduction of xylose to xylitol from a mixture of hemicellulosic sugars[J]. Metabolic Engineering , 2010, 12 (5) : 462-468 DOI:10.1016/j.ymben.2010.04.005 |
| [12] | Wang M, Si T, Zhao H M . Biocatalyst development by directed evolution[J]. Bioresource Technology , 2012, 115 : 117-125 DOI:10.1016/j.biortech.2012.01.054 |
| [13] | Johannos Tyler W, Zhao Huimin . Directed evolution of enzymes and biosynthetic pathways[J]. Current Opinion in Microbiology , 2006, 9 (3) : 261-267 DOI:10.1016/j.mib.2006.03.003 |
| [14] | Nair Nikhil U, Zhao H M . Evolution in reverse:engineering a D-xylose specific xylose reductase[J]. Chembiochem:European Journal of Chemical Biology , 2008, 9 (8) : 1213-1215 DOI:10.1002/cbic.v9:8 |
| [15] | Jeffries Thomas W . Engineering yeasts for xylose metabolism[J]. Current Opinion in Biotechnology , 2006, 17 (3) : 320-326 DOI:10.1016/j.copbio.2006.05.008 |
| [16] | van Der Donk Wifred A, Zhao H M . Recent developments in pyridine nucleotide regeneration[J]. Current Opinion in Biotechnology , 2003, 14 (4) : 421-426 DOI:10.1016/S0958-1669(03)00094-6 |
| [17] | Chin Jonathan W, Khankal Reza, Monroa Caroline A . Analysis of NADPH supply during xylitol production by engineered Escherichia coli[J]. Biotechnology and Bioengineering , 2008, 102 (1) : 209-220 |
| [18] | Walton A Z, Stewart J D . Understanding and improving NADPH-dependent reactions by nongrowing Escherichia coli cells[J]. Biotechnology Progress , 2004, 20 : 403-411 |
| [19] | Ahmad I, Shim W Y, Jeon W Y . Enhancement of xylitol production in Candida tropicalis by co-expression of two genes involved in pentose phosphate pathway[J]. Bioprocess and Biosystems Engineering , 2012, 35 (1-2) : 199-204 DOI:10.1007/s00449-011-0641-9 |
| [20] | Ryan W, Michael S, Huimin Z . Heterologous expression, purification, and characterization of a highly active xylose reductase from Neurospora crassa[J]. Applied and Environmental Microbiology , 2005, 71 (3) : 1642-1647 DOI:10.1128/AEM.71.3.1642-1647.2005 |
| [21] | XIE Qin(解晴), WU Jian-ping(吴坚平), LIN Li(林立) . Purification and characterization of a carbonyl reductase from Candida pseudotropicalls(拟热带假丝酵母中羰基还原酶的纯化及其酶学性质研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2009, 23 (1) : 92-98 |
| [22] | GAO Lan(高岚), XIA Li-ming(夏黎明) . Cloning of xylose reductase gene and site-specific integrating into saccharomyces cerevisiae genome(木糖还原酶的基因克隆及其在酿酒酵母中的定向整合)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2013, 27 (3) : 450-455 |
| [23] | XU Zhi-nan(徐志南), CHEN Xiu-qi(陈秀奇), CHEN Xin-ai(陈新爱) . The optimization of fermentation conditions of penicillin G acylase from Bacillus subtilis(重组枯草芽孢杆菌生产青霉素G酰化酶发酵条件的研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2003, 17 (3) : 266-269 |
| [24] | Cirino Patrick C, Chin Jonathan W, Ingram Lonnie O . Engineering Escherichia coli for xylitol production from glucose-xylose mixtures[J]. Biotechnology and Bioengineering , 2006, 95 (6) : 1167-1176 DOI:10.1002/bit.v95:6 |
| [25] | Kwon D H, Kim M D, Lee T H . Elevation of glucose 6-phosphate dehydrogenase activity increases xylitol production in recombinant Saccharomyces cerevisiae[J]. Journal of Molecular Catalysis B:Enzymatic , 2006, 43 (1) : 86-89 |




