磷酸二氢钾被广泛应用于工业,农业和医药领域[1]。它可用于青霉素,谷氨酸钠和其他钾盐的合成,是具有商业价值的中间体[2]。由于磷酸二氢钾的需求量逐年增加,因此磷酸二氢钾的技术开发一直受到科研工作者的重视,逐渐对其生产过程及工艺进行优化。近年来,磷酸二氢钾的生产方法主要包括中和法、萃取法、复分解法,结晶法等[3, 4]。与其它方法相比,溶剂萃取法因其具有低能耗、反应条件温和、产品纯度高等优点,被认为是目前较先进且具有发展前途的工业生产方法[5]。溶剂萃取法[6]是以湿法磷酸和工业氯化钾为原料,经溶解、过滤、萃取、结晶过程而得到产品磷酸二氢钾。萃取和结晶是该工艺中较为关键的过程,直接决定磷酸二氢钾产品的纯度。萃取后,湿法磷酸中的H+和KCl中的Cl-被萃取剂从水相转移到有机相[7],而H2PO4-和K+保留在水相中。由于工业KCl中含有一定量的Na+和SO42-杂质,经萃取后仍然留在结晶母液中,因而在结晶母液中包括 (Cl-,SO42-,H2PO4-,Na+,K+),形成了 (Na+,K+//Cl-,SO42-,H2PO4--H2O) 五元体系,进一步影响磷酸二氢钾产品的纯度。水盐体系相平衡关系作为研究和预测盐类析出、溶解等相转化规律的理论,是指导结晶过程的必要工具[8]。因此,(Na+,K+//Cl-,SO42-,H2PO4--H2O) 五元体系固液相平衡的研究对提高磷酸二氢钾纯度及其结晶工艺过程的探索具有重要意义。
对于含H2PO4-相平衡体系的研究,本课题组在前期工作中已经完成了298.15、313.15 K的多个三元及四元体系,例如298.15 K、313.15 K三元体系 (KCl + KH2PO4 + H2O)[9],313.15 K四元体系 (KCl-K2SO4-KH2PO4-H2O)、(NaCl-Na2SO4-NaH2PO4-H2O) 等[10]的固液相平衡研究。298.15 K条件下 (Na+,K+//SO42-,H2PO4--H2O) 交互四元体系为 (Na+,K+//Cl-,SO42-,H2PO4--H2O) 五元体系的子体系。根据水盐体系相图的分类原则,该 (Na+,K+//SO42-,H2PO4--H2O) 交互四元体系可以分为四个三元子体系。三元子体系相平衡的研究是完成该四元体系相平衡的基础,并已有文献报道。王盼等[11]报导了298.15 K (KH2PO4-K2SO4-H2O) 的相平衡溶解度和密度数据;Eysseltova等[12]开展了298.15 K (NaH2PO4-KH2PO4-2O) 的相平衡研究;Chen [13]进行了298.15 K三元体系 (Na2SO4-NaH2PO4-H2O) 的相平衡溶解度和密度数据的相关研究;邓天龙等[14]总结报导了298.15 K (K2SO4-Na2SO4-H2O) 的相平衡数据。研究结果表明,(KH2PO4-K2SO4-H2O)、(NaH2PO4-KH2PO4-H2O) 和 (Na2SO4-NaH2PO4-H2O) 属于简单的三元体系,没有复盐或固溶体存在。然而三元体系 (K2SO4-Na2SO4-H2O) 有复盐钾芒硝 (Na2SO4·3K2SO4) 形成,并且属于异成分复盐,水合物Ⅱ型相图。目前,(Na+,K+//SO42-,H2PO4--H2O) 交互四元体系在298.15 K时的相平衡研究尚未见报道。
因此,在前期研究基础之上,本文选择以298.15 K作为研究温度,采用等温溶解法深入研究交互四元体系 (Na+,K+//SO42-,H2PO4--H2O) 的固液相平衡关系,并研究饱和溶液的物理性质 (ρ,η,nD),绘制该体系的干盐图,水图,物理性质-组成图。对于揭示该四元体系中各盐的溶解与析盐规律,指导磷酸二氢钾结晶工序及相关热力学模型的开发利用具有实际意义,也必将产生重大的经济效益。
2 实验 2.1 仪器与药品本实验所采用的主要仪器:BSA224S型分析天平 (上海奥豪斯仪器有限公司,±0.0001 g);SHZ-C型恒温水浴振荡器 (上海朗轩实验设备有限公司,±0.05 K);HH-ZK2型超级恒温水浴 (郑州英峪予华仪器有限公司,± 0.05 K);L5型紫外可见分光光度计 (上海仪电分析仪器有限公司);WYA-2S型数字阿贝折光率仪 (上海仪电物理光学仪器有限公司,±0.0001);D/MARX2200/PC型X射线粉晶衍射仪 (日本理学公司)。
本实验所采用的主要药品:实验过程中配料和分析方法均采用二次去离子水 (电导率 < 10-4 S·m-1)。实验所用药品均来自天津市科密欧化学试剂有限公司 (分析纯),分别为:K2SO4、Na2SO4、NaH2PO4·2H2O、KH2PO4。
2.2 实验方法研究采用等温溶解平衡法[15]测定交互四元体系 (Na+,K+//SO42-,H2PO4--H2O) 的固液相平衡。根据四个三元体系的共饱和点数量,该四元体系实验可以划分为6个阶段。其中四个三元体系共饱和点的平衡固相及所加入的第三种盐,也即实验方案如表 1所示。三元体系共饱和点的实验方法与以下四元体系类似,不予详细说明。四元体系饱和溶液的配制是从三元体系共饱和点开始逐渐加入第三种盐于磨口玻璃瓶中,用保鲜膜密封,再将其置于恒温水浴中振荡,以加速平衡的建立。然后,将其静置,使漂浮的细晶沉降,致使平衡液相保持澄清状态。定期测量饱和溶液中各离子的含量及物理性质,以确定饱和溶液是否达到平衡。本实验以饱和液相化学组成和物理性质不变作为达到平衡的标志,实验结果表明该阶段达到平衡的时间为10 h,静置时间为12 h。达到平衡后,对饱和液相进行分析,分别测定饱和液相中K+、SO42-、H2PO4--的含量,并测定饱和液相的物理性质 (nD,η,ρ)。平衡固相的组成采用X射线衍射进行确定。平衡液相的密度,黏度,折光率分别采用密度瓶,乌氏粘度计,阿贝折射率仪进行测定。整个实验过程中恒温水浴和恒温水浴振荡器的温度控制在 (298.15 ± 0.05) K。
| 表 1 不同单变曲线阶段饱和溶液的配制方案 Table 1 Preparation of saturated solutions corresponding to different isotherm sections |
平衡后取饱和液相进行化学分析。K+含量:四苯硼钠-季胺盐滴定法[16],相对不确定度为0.02;SO42-含量:分光光度浊度法[17],相对不确定度为0.03;H2PO4-含量:磷钼酸喹啉重量法[18],相对不确定度为0.02;Na+含量:差减法,相对不确定度为0.05。平衡固相采用X射线晶体衍射法进行确定。
3 实验结果与讨论 3.1 298.15 K (Na+, K+//SO42-, H2PO4--H2O) 固液相平衡相图根据文献数据,本文重复测定了三元子体系的共饱和点数据并确定了平衡固相的组成,具体值见表 2。交互四元体系的相图为立体图,为简化相图的表示方法,以干盐指数为基准来绘制相图和水图,以表示各盐之间的比例关系。298.15 K交互四元体系 (Na+,K+//SO42-,H2PO4--H2O) 的溶解度和干基数据见表 2。其中以总正 (负) 离子 (2H2PO4-+ SO42-=2K++2Na+) 各为100 mol作为基准,计算各离子的耶涅克指数,用J(b) 来表示。水的含量用100 mol干盐中所含水的摩尔数来表示。以 (2H2PO4-+SO42-) 为100 mol作为基准,来计算各个离子的干盐Jänecke指数,具体的计算方法详见文献[14]。
用表 2中的干盐指数绘制了298.15 K (Na+,K+//SO42-,H2PO4--H2O) 的干盐相图,如图 1所示。由表 2和图 1可见,该交互四元体系的干盐相图上有6个边界点,分别为C、L、O、H、M、K,对应四个三元体系的共饱和点。其中,点C是三元体系KH2PO4-K2SO4-H2O的共饱和点,其对应的平衡固相为 (KH2PO4 + K2SO4);点K为三元体系KH2PO4-NaH2PO4-H2O的共饱和点,其对应的平衡固相为 (KH2PO4 + NaH2PO4·2H2O);点L、O是三元体系K2SO4-Na2SO4-H2O的两个共饱和点,分别对应的平衡固相为 (K2SO4 + Gla)、(Na2SO4·10H2O + Gla);点H、M是三元体系NaH2PO4-Na2SO4-H2O的两个共饱和点,分别对应的平衡固相为 (Na2SO4+ Na2SO4·10H2O)、(NaH2PO4·2H2O + Na2SO4)。
| 表 2 298.15 K, 88.4 kPa, Na+, K+// SO42-, H2PO4--H2O四元体系固液相平衡数据 Table 2 Solid–liquid equilibrium data of the quaternary system Na+, K+// SO42-, H2PO4--H2O at T = 298.15 K, p = 88.4 kPa |

|
图 1 298.15 K四元体系Na+, K+// SO42-, H2PO4--H2O干盐相图 Fig.1 Dry-salt phase diagram of the quaternary system Na+, K+// SO42-, H2PO4--H2O at 298.15 K and p=88.4 kPa |
由图 1可见,298.15 K (Na+,K+//SO42-,H2PO4--H2O) 的干盐相图有四个共饱和点,六个单盐结晶区,九条单变量双固相共饱和线。四个共饱和点分别为点E、P、D、S,下面分别对以上四个共饱和点的液相组成及平衡固相进行说明。共饱和点P对应的平衡固相为 (KH2PO4 + Gla + NaH2PO4·2H2O),对应的平衡液相组成为:w (K+) = 2.80%(wt),w (H2PO4-) = 44.58%(wt),w (Na+) = 9.79%(wt),w (SO42-) = 1.82%(wt);共饱和点S对应的平衡固相为 (Gla + Na2SO4 + Na2SO4·10H2O),对应的平衡液相组成为:w (K+) = 2.43%(wt),w (H2PO4-) = 19.75%(wt),w (Na+) = 8.82%(wt),w (SO42-) = 11.61%(wt);共饱和点D对应的平衡固相为 (Gla + NaH2PO4·2H2O + Na2SO4·10H2O),对应的平衡液相组成为:w (K+) = 2.57%(wt),w (H2PO4-) =37.23%(wt),w (Na+) = 10.12%(wt),w (SO42-) = 5.86%(wt);点E表示的平衡固相为 (K2SO4 + KH2PO4 + Gla),对应的平衡液相组成为:w (K+) = 7.35%(wt),w (H2PO4-) = 14.84%(wt),w (Na+) =1.23 %(wt),w (SO42-) = 4.25 %(wt)。当温度高于333.15 K时,NaH2PO4才会以无水的形式结晶析出,的形式结晶析出,实验结果与文献报道[19]吻合。
六个单盐结晶区分别为K2SO4(Ⅰ)、Gla (Ⅱ)、Na2SO4·10H2O (Ⅲ)、KH2PO4(Ⅳ)、Na2SO4(Ⅴ)、NaH2PO4·2H2O (Ⅵ)。结果表明,Na2SO4的结晶区域比Na2SO4·10H2O的结晶区域小,同理可得同等条件下Na2SO4·10H2O会比Na2SO4更容易析出。Gla的结晶区域最大,NaH2PO4·2H2O的结晶区域最小,表明在该混合体系中NaH2PO4·2H2O的溶解度最大,最不容易结晶析出,同理Gla的溶解度最小,最先结晶析出。说明NaH2PO4.2H2O较硫酸盐溶解度大,且NaH2PO4·2H2O对硫酸盐有强烈的盐析作用。因此,在用溶剂萃取法生产磷酸二氢钾 (钠) 的过程中,复盐Gla (Na2SO4·3K2SO4) 的析出会对产品的纯度产生严重影响,为解决这一问题需要研究其结晶工艺。该相图中的九条单变量双固相共饱和线分别为CE、LE、EP、PK、DM、SD、SH、OS,分别对应两种盐和一种饱和溶液。九条单变曲线的平衡固相说明如下:(1) CE:KH2PO4 + K2SO4;(2) LE:K2SO4+Gla;(3) EP:KH2PO4+ Gla;(4) PK:KH2PO4 + NaH2PO4·2H2O;(5) DP:Gla + NaH2PO4·2H2O;(6) DM:Na2SO4+ NaH2PO4·2H2O;(7) SD:Gla+ Na2SO4;(8) SH:Na2SO4+ Na2SO4·10H2O;(9) OS:Gla+ Na2SO4·10H2O。综上所述:该体系含有复盐Na2SO4·3K2SO4(Gla),水合物 (Na2SO4·10H2O、NaH2PO4·2H2O) 及四个共饱和点可以认为是复杂的交互四元体系。
根据表 2中的数据,绘制该体系水图,如图 2。由图 2可知,在各单变曲线上水的含量随J (SO42-) 的改变呈规律性变化。在K2SO4和Gla的共饱和线LE上,Gla和Na2SO4·10H2O的共饱和线OS上,KH2PO4和Gla的共饱和线EP上,J (H2O) 随J (SO42-) 的变化呈现剧烈变化的规律。以共饱和线LE上的变化为例进行说明,当J (SO42-) 从100降低到36.64,J (H2O) 从4581.79减小到3326.81。分析原因可认为是:J (K+) 和J (H2PO4-) 浓度增大的总和大于J (SO42-) 降低的程度,而J (Na+) 几乎不变,饱和溶液最终呈现浓度增大的趋势,因而导致水量减小。而在KH2PO4和NaH2PO4·2H2O的共饱和线PK上,Gla和NaH2PO4·2H2O的共饱和线DP上,Na2SO4和NaH2PO4·2H2O的共饱和线DM上,Gla和Na2SO4的共饱和线SD上,KH2PO4和K2SO4的共饱和线CE上,变化趋势较小,水的含量变化微小,其中共饱和线SD上J (H2O) 从970.48变化到1430.26,而J (K+) 几乎不变,从13.96变化到13.03,J (H2PO4-) 值从45.71增加到75.86,即H2PO4-的浓度增大,导致溶液的浓度增大,致使水量减小。分析结果表明H2PO4-的含量成为影响体系平衡液相含水量的最主要因素。
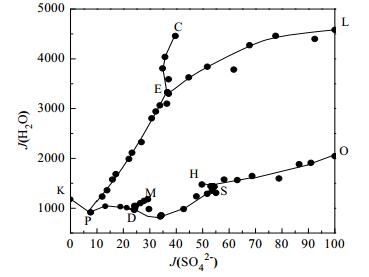
|
图 2 298.15 K Na+, K+// SO42-, H2PO4--H2O体系水图 Fig.2 Water-content diagram of Na+, K+// SO42-, H2PO4--H2O at 298.15 K |
电解质溶液的密度、黏度、折光率是化学化工、盐湖化工等领域不可缺少的基础数据。本文研究了平衡液相的物理性质 (ρ,η,nD) 如表 3所示。以J (SO42-) 为横坐标,物理性质 (ρ,η,nD) 为纵坐标,绘制物理性质-组成图,见图 3。
| 表 3 298.15 K四元体系Na+, K+// SO42-, H2PO4--H2O平衡液相物理性质 Table 3 Physical properties of the quaternary system Na+, K+// SO42-, H2PO4--H2O at 298.15 K and p = 88.4 kPa |
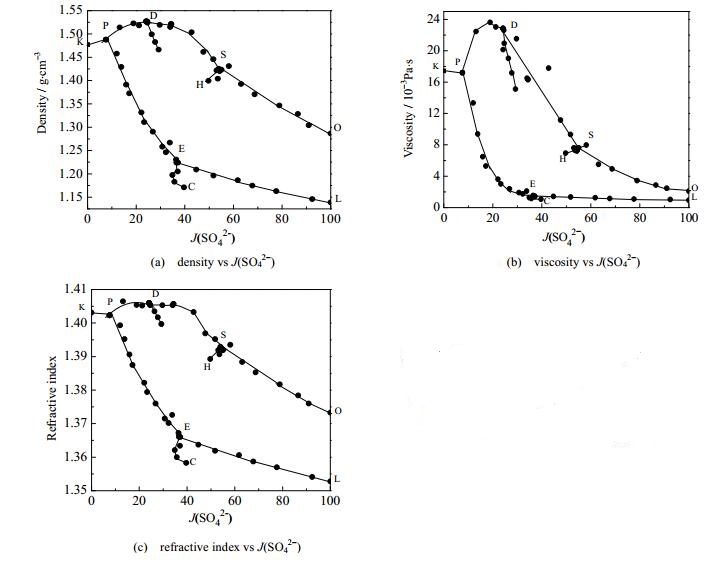
|
图 3 四元体系298.15 K Na+, K+// SO42-, H2PO4-, -H2O物化性质-组成图 Fig.3 Physicochemical properties as a function of J(SO42-) composition in the quaternary system Na+, K+// SO42-, H2PO4-, -H2O at 298.15 K |
如图 3所示,密度、黏度、折光率随J (SO42-) 的增加逐渐降低,呈现相似规律。根据单变曲线的变化,分析饱和溶液的物理性质 (折光率、黏度、密度) 和J (SO42-) 之间的关系。在单变曲线SO和PE上,密度、黏度、折光率随J (SO42-) 的增大剧烈减小。以单变曲线SO为例,密度从1.4208 g·cm-3降低到1.2866 g·cm-3,黏度从7.2554×10-3Pa·s降低到2.0982×10-3Pa·s,折光率从1.3924降低到1.3733。在单变曲线LE上,密度、折光率的变化较黏度变化趋势明显,而黏度呈现微小变化。当J (SO42-) 值从100.00降低到36.64时,黏度从0.9063×10-3Pa·s变化到1.4558×10-3 Pa·s。其他8条单变曲线由于J (SO42-) 值变化较小,因而显示在图 3中物理性质 (折光率、黏度、密度) 随J (SO42-) 值变化的曲线较短,具体的数值变化见表 3。
根据前期研究认为NaH2PO4在水溶液中的溶解度最大[20],由于混合溶液的物理性质 (黏度、密度、折光率) 与其组成相关,也就是说NaH2PO4对混合溶液中的物理性质 (黏度、密度、折光率) 影响最大。在K2SO4和Gla的共饱和线上,J (Na+) 值从36.65变化到22.13,致使交互四元体系混合溶液中生成的NaH2PO4如图 3所示,密度、黏度、折光率随J (SO42-) 的增加逐渐降低,呈现相似规律。根据单变曲线的变化,分析饱和溶液的物理性质 (折光率、黏度、密度) 和J (SO42-) 之间的关系。在单变曲线SO和PE上,密度、黏度、折光率随J (SO42-) 的增大剧烈减小。以单变曲线SO为例,密度从1.4208 g·cm-3降低到1.2866 g·cm-3,黏度从7.2554×10-3Pa·s降低到2.0982×10-3Pa·s,折光率从1.3924降低到1.3733。在单变曲线LE上,密度、折光率的变化较黏度变化趋势明显,而黏度呈现微小变化。当J (SO42-) 值从100.00降低到36.64时,黏度从0.9063×10-3Pa·s变化到1.4558×10-3 Pa·s。其他8条单变曲线由于J (SO42-) 值变化较小,因而显示在图 3中物理性质 (折光率、黏度、密度) 随J (SO42-) 值变化的曲线较短,具体的数值变化见表 3。
根据前期研究认为NaH2PO4在水溶液中的溶解度最大[20],由于混合溶液的物理性质 (黏度、密度、折光率) 与其组成相关,也就是说NaH2PO4对混合溶液中的物理性质 (黏度、密度、折光率) 影响最大。在K2SO4和Gla的共饱和线上,J (Na+) 值从36.65变化到22.13,致使交互四元体系混合溶液中生成的NaH2PO4量小,其物理性质变化微小,相似的规律如图 3所示。分析原因认为,NaH2PO4的浓度是影响整个混合溶液中物理性质 (nD,η,ρ) 的重要因素。
4 结论(1) 采用等温溶解法对交互四元体系Na+,K+// SO42-,H2PO4--H2O在298.15 K下的固液相平衡进行研究,最终获得了该体系的溶解度数据、干盐相图、水图以及物化性质-组成图。
(2) 298.15 K四元体系Na+,K+// SO42-,H2PO4--H2O的相图包括四个共饱和点、九条单变曲线及六个单盐结晶区域 (K2SO4、Gla、Na2SO4·10H2O、KH2PO4、Na2SO4、NaH2PO4·2H2O)。该体系中存在复盐Gla,结晶水合物 (Na2SO4·10H2O,NaH2PO4·2H2O),没有固溶体存在,说明298.15 K四元体系Na+,K+// SO42-,H2PO4--H2O是复杂的共饱和型体系。
(3) 该四元体系的物理性质 (ρ,η,nD) 随J(SO42-) 的变化规律相似,整体呈现递减的趋势。分析原因认为,NaH2PO4的浓度是影响整个混合溶液中物理性质 (密度、黏度、折光率) 的重要因素。
符号说明:
G ——3K2SO4·Na2SO4 O ——K2SO4
K ——KH2PO4 P ——NaH2PO4·2H2O
N ——Na2SO4 S ——Na2SO4·2H2O
| [1] | DANG Ya-gu(党亚固), FEI De-jun(费德君), HU Xiu-ying(胡秀英), et al. Effects of impurities on crystallization process of potassium dihydrogen phosphate(杂质对于磷酸二氢钾结晶的影响研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2008, 22(6): 911-914. |
| [2] | Eunhye Ch, Jin J K. High-energy proton-irradiation effects on the charge transport and electric dipole moment of KH2PO4[J]. Current Applied Physics , 2014, 14(5): 805-808. DOI:10.1016/j.cap.2014.03.003. |
| [3] | YANG Wei-hong(杨位红), LI Xin-zhu(李新柱), HU Zhao-ping(胡兆平). Summary of preparation of potassium dihydrogen phosphate from wet-process phosphoric acid(湿法磷酸制备磷酸二氢钾综述)[J]. Inorganic Chemicals Industry(无机盐工业) , 2014, 46(4): 7-9. |
| [4] | ZHOU Jing(周静), BAI Ren-liu(柏任流), ZHOU Jun-hong(周骏宏), , et al. Preparation of high-quality potassium dihydrogen phosphate from wet-process phosphoric acid by extraction method(湿法磷酸萃取制取高品质磷酸二氢钾工艺研究)[J]. Inorganic Chemicals Industry(无机盐工业) , 2014, 46(9): 21-25. |
| [5] | CHEN Ruo-yu(陈若愚), WANG Guo-ping(王国平), ZHU Jian-fei(朱建飞), et al. Study on preparation of potassium dihydrogen phosphate by extraction Method(萃取法制备磷酸二氢钾新工艺研究)[J]. Industrial Minerals & Processing(化工矿物与加工) , 2001, 11(4): 5-7. |
| [6] | LIU Yi-fei(刘逸飞), LI Jun(李军), LI Yan-feng(李燕凤), et al. Preparation of potassium dihydrogen phosphate by extraction method(萃取法制备磷酸二氢钾)[J]. Inorganic Chemicals Industry(无机盐工业) , 2007, 39(9): 24-26. |
| [7] | Ye C W. Liquid-liquid equilibria for the ternary system containing water+phosphoric acid+organic entrainers at 308.15 K[J]. Journal of Molecular Liquids , 2013, 186(5): 39-43. |
| [8] | NIU Zi-de(牛自得), CHENG Fang-qin(程芳琴). Phase diagram of salt-water system and its application(水盐体系相图及其应用)[M].Tianjin(天津): Tianjin University Press(天津出版社), 2002. |
| [9] | Shen W, Ren Y S, Zhang X R, et al. Solid-liquid phase equilibrium for the ternary tystem (potassium chloride+potassium dihydrogen phosphate+water) at (298.15 and 313.15) K[J]. Journal of Chemical Engineering Data , 2015, 60(7): 2070-2078. DOI:10.1021/acs.jced.5b00113. |
| [10] | Shen W, Wang Y L, Ren Y S. Study on the phase equilibrium of the quaternary systems Na+ (K+)//H2PO4-, Cl-, SO42--H2O at 313.15 K[J]. Fluid Phase Equilibria , 2015, 403: 85-94. DOI:10.1016/j.fluid.2015.06.014. |
| [11] | Wang P, Li J, Luo J H. Solid-liquid phase equilibrium for the ternary system K2SO4+KH2PO4+H2O at (298.15 and 333.15) K[J]. Journal of Chemical Engineering Data , 57, 3: 836-839. |
| [12] | Eysseltova J, Makovic K J. Sodium dihydrogenphosphate[J]. Alkali Metal Orthophosphates , 1988, 31(3): 68-68. |
| [13] | Chen X Z, Tang J H, Cui Y N, et al. Phase equilibrium for the ternary system NaH2PO4+Na2SO4+H2O in aqueous solution at 298.15 K[J]. Journal of Chemical Engineering Data , 2014, 59(2): 481-484. DOI:10.1021/je400932e. |
| [14] | DENG Tian-long(邓天龙), ZHOU Huan(周桓), CHEN Xia(陈侠). Phase diagram of salt-water system and its application(水盐体系相图及其应用)[M].Beijing(北京): Chemical Industry Press(化学工业出版社), 2013. |
| [15] | ZHANG Jie(张杰), SHI Xue-wei(史学伟), ZHAO Shuang-liang(赵双良), et al. Progress in study on phase equilibria of salt-water systems(水盐体系相平衡研究进展)[J]. Journal of Chemical Industry and Engineering(化工学报) , 2016, 67(2): 379-389. |
| [16] | JIANG Xu-min(姜旭敏), LI Feng-ying(李凤英), SHI Zhong-lu(史忠录), et al. K+ Measurement in KCl by sodium tetraphenylboron-quaternary ammonium salt method(四苯硼钠-季铵盐法测定KCl中K+含量的研究)[J]. Journal of Salt and Chemical Industry(盐业与化工) , 2012, 39(9): 24-30. |
| [17] | Ren Y S, Zhang X R, SUN Y, et al. Solid-liquid equilibrium of quaternary system Na+//H2PO4-, Cl-, SO42--H2O at 298.15 K[J]. Fluid Phase Equilibria , 2015, 393: 1-6. DOI:10.1016/j.fluid.2015.02.023. |
| [18] | Phosphoric acid for industrial use (including goodstuffs)-fetermination of total phosphorus (V) oxide content-quinoline phosphomolybdate gravimetric method:ISO/TC 47. ISO 3706-1976[S]. Switzerland:ISO Information Handling Services, 1976. |
| [19] | Eysseltova J, Makovicka K J. Sodium dihydrogenphosphate[J]. Alkali Metal Orthophosphates , 1988, 31(3): 40-41. |
| [20] | Zhang X R, Ren Y S, Li P, et al. Solid-liquid equilibrium for the ternary systems (Na2SO4+NaH2PO4+H2O) and (Na2SO4+NaCl+H2O) at 313.15 K and atmospheric pressure[J]. Journal of Chemical Engineering Data , 2014, 59(12): 3969-3974. DOI:10.1021/je500854m. |




