由于世界人口的不断增长和工业化水平的不断发展,能源的需求也在不断增长。所以需要新能源来补充日益枯竭的传统能源,如石油、煤炭和天然气[1-2]。生物质被认为是一种潜在的廉价的可再生能源[3-4],把废弃生物质转化为生物油的研究引起了广泛关注。其中生物油是深褐色的有机流动液体,相对于原料具有较高的热值,并可方便地存储和运输,它可用于化学品生产,也可作为燃料油用于发热或发电[5]。在生物油热化学转换过程中,一般有4种转化类型:热解、气化、直接燃烧和水热液化。
在一些生物质热解研究中[6-8],主要研究了温度、升温速率、停留时间、物料粒径以及催化剂对热解产物产率的影响和机理研究分析。卫文娟等[9]研究了不同热解温度段对水葫芦热解后的气、液、固三相产物的特性。张良等[10]以水葫芦为原料,在低温高压条件下进行液化反应制备生物油,研究了不同温度条件下水葫芦的液化效果并分析了生物油的主要成分。液化处理是一种极具前景的生物质转化技术,它将生物质原料转化为高品位的生物质炭、生物油和气体[11]。液化法处理生物质可以以水[12-13]、甲醇[14-15]、乙醇[16]、丙酮[16]等为反应媒介,无需对生物质进行脱水处理,因而适用于高含水率的生物质。水葫芦具有较高的含水量(高于90%),同时其主要有机成分为纤维素、半纤维素及木质素等(约占干重的33%~55%)[17],因而利用液化法处理水葫芦具有极好的环境友好性及研究基础。
本实验采用微型高压反应釜对水葫芦进行液化处理,基于丙酮溶解性较好,且对后续液化生物油的处理比较方便,以丙酮为溶剂,通过混合正交实验,确定最佳实验组合。在停留时间、质量比确定的情况下,主要研究液化温度对水葫芦液化制取生物油的转化率以及组成、特性的影响规律,确定适宜的水葫芦液化制生物油条件,并从生物质组成出发分析液化温度对生物油品质改善机理,为水葫芦资源化利用及其他生物质液化提供理论依据。
2 实验 2.1 原料本实验所用原料为多年生热带浮水植物水葫芦,取自华侨大学周边湖畔。首先对水葫芦进行简单的分拣处理,除去掺杂的泥沙、生物残渣等杂质,取其径部与叶子为本实验的反应原料。经过清洗、干燥,再粉碎过120目筛,备用。水葫芦的组成分析采用范式洗涤纤维分析法测定,工业分析参照GB/T28731-2012《固体生物质燃料工业分析方法》进行测定。水葫芦的组成分析与工业分析结果见表 1。
|
|
表 1 水葫芦的组成分析与工业分析 Table 1 Composition and proximate analysis of WH |
实验所采用的反应装置为微型磁力高压反应釜,采用316L不锈钢材质,反应器容积为200 mL,内置石英内衬,反应器的设计温度和设计压力分别为350 ℃和10 MPa。反应器由电热纤维炉加热,采用K型热电偶测得温度,误差为±2.5 ℃。
2.3 实验过程取5 g水葫芦粉末,将一定比例(水葫芦和丙酮的质量比1:5、1:10)的丙酮(AR)溶液依次加入到反应釜内。按照混合正交实验设计,按设定的升温程序使反应釜温度升至设定温度(240、250、260、270、280 ℃),并在该温度下停留相应的时间(30、60、90 min),反应完成后自动停止加热,待反应釜自然冷却至室温收集产物。
2.4 产物分离和分析方法试验完毕,收集气体后取出反应釜中的液体和固体产物。将产物分为固液两相,产物处理流程如图 1所示。
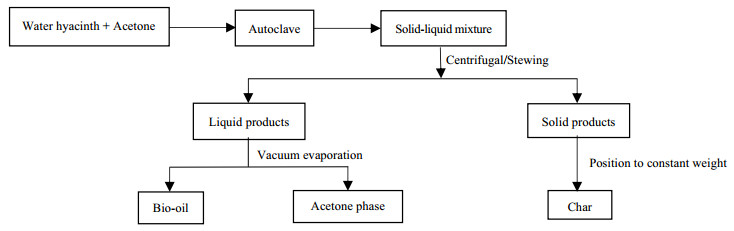
|
图 1 产物分离和处理过程 Fig.1 Flow chart of product separation and extraction process |
液相产物经减压蒸发后得到丙酮相和生物油,生物油中含有少量水分,用分析纯的有机溶剂-丙酮少许滴入生物油,水分溶于丙酮,丙酮沸点较低,蒸发时带出水分,周期性称重生物油至恒重即可。
实验采用气相色谱-质谱联用仪(GC/MS)对液相产物生物油的基本组成进行分析,气质联用仪产自日本岛津仪器厂,型号为GC/MS-QP2010plus,色谱柱选用Rtx-Wax型极性毛细管柱,规格30 m×0.25 mm×0.25 μm;以高纯氦气为载气,流量为3.0 mL·min-1;谱库为NIST5.0数据库;气化器工作温度为250 ℃,柱箱初始温度为40 ℃,采用程序升温以5 ℃·min-1的升温速率加热至180 ℃,然后再以15 ℃·min-1升温至250 ℃;进样口温度为250 ℃;溶剂延迟时间为3.5 min;进样量为1 μL;分流比为10:1。
液相产物生物油的组成结构通过到岛津公司FTIR NICOLET iS 50傅里叶变换红外光谱仪进行测定分析。液相产物生物油的热值采用型号为ZDHW-2A的全自动量热仪测定,酸值参照GB264-83《石油产品酸值测定法》测定。
三相产物的产率由下式计算:
| $ 油产率\omega ({\rm{oil}}) = \frac{{{m_1}}}{{{m_0}}} \times 100\% $ |
| $ 碳产率\omega [{\rm{c}}] = \frac{{{m_2}}}{{{m_0}}} \times 100\% $ |
| $ 生产率\omega [{\rm{g}}] = \frac{{{m_0} - {m_1} - {m_2}}}{{{m_0}}} \times 100\% $ |
式中:m0为水葫芦质量(5 g),m1为生物油质量,g,m2为固相产物质量,g。
为获得客观的实验结果,提高实验结果的重现性,每次生物油组分含量测试实验都进行了3次。本文给出了测量值的平均值和偏差。
3 结果与讨论 3.1 结果分析在生物质液化时,液化温度、生物质与溶剂质量比(水葫芦和丙酮的质量比)和液化时间等对实验有一定程度的影响,需要对其进行优化,使得后续实验建立在较优的前期工艺的基础上,只有这样实验过程的响应值才会更为明显。由于正交实验方法在工艺优化实验中体现出的正交性、代表性和综合可比性,使其成为优化工艺的一种高效的实验方法。由于生物质液化性质随其组成(或种类)变化大,不适合前期考察,故此处选水葫芦为代表,以液化温度、质量比和液化时间为考察因素进行混合水平(L155×32)的正交试验优化前期工艺参数,以便更好地进行后续实验。本实验有3个因素,液化温度为5水平,液化时间为3水平,质量比也为3水平,但由于质量比为1:15时,液化时微型高压反应釜压力过大,超过安全阀值,故实验只采用质量比1:5、1:10 2个水平,运用拟水平法(在没有合适的混合水平正交表可使用时,可以对因素虚拟水平,将水平少的因素归入水平多的因素正交表中,表面上把这个因子想象成与该列水平数相等,而实际上将该列多余的水平用这个因子的某个水平代替,即此水平多重复几次)处理,将质量比1:5、1:10两个水平在拟水平的位置上多重复几次。考察因素及水平详见表 2。
|
|
表 2 液化过程工艺优化因素水平表 Table 2 Liquefaction process optimization factor level table |
以表 2中因素和水平设计正交实验,选用混合正交表(L155×32)为正交实验方案,进行实验,以含水生物油产率(以下简称产油率)为衡量标准分析正交实验结果,见表 3。
|
|
表 3 实验方案(L155×32)及结果分析表 Table 3 Experimental scheme (L155×32) and result analysis |
表 3是液化过程前期工艺优化混合正交实验(L155×32)结果表,对于正交实验无法直接从原始实验结果中得到详细的实验信息,需要对其进一步处理。按照正交试验直观分析处理方法,对上述实验结果进行处理后得到均值及极差。根据均值及极差的大小得到:各因素影响大小为A > B > C,优组合为:A4B2C2,此组合在15组正交试验中出现且产油率为22.43%。
为了更好的分析各因素的显著性,需要对结果进行方差分析,对比F值,判断因素显著性。具体分析见表 4。
|
|
表 4 正交试验(L155×32)方差分析结果表 (α=0.05) Table 4 Results of orthogonal test (L155×32) variance analysis (α=0.05) |
表 4是液化正交实验方差分析结果,由表中可见在α=0.05水平下因素A(液化温度)为显著性影响因素,其F比值高于F临界值,而其余两个因素均为不显著影响因素。
从图 2混合正交试验效应曲线图中可以直观的看到液化温度的影响最大,较优的液化温度为270 ℃,温度太高或太低都会使产油率下降。对于水葫芦和丙酮的质量比及液化时间两个因素,产油率的变化趋势都是先升后降,且两种因素对产油率基本没有影响,且混合正交实验结果的最优组合产油率(22.43%)低于同样在270 ℃时A4B1C3组合的产油率(22.54%),按照A4B1C3组合进行液化实验后得到产油率为22.54%,大于其他组,证明A4B1C3组合是最佳产油率组合。
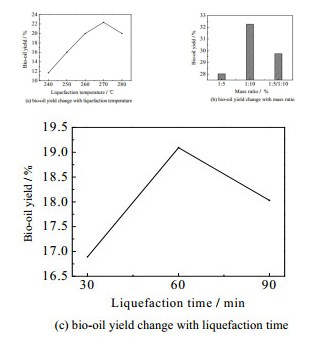
|
图 2 液化正交实验(L155×32)各因素效应曲线图 Fig.2 Profiles of factors in liquefaction orthogonal experiments (L155×32) |
所以,经混合正交实验(L155×32)对前期液化工艺参数实验考察后得到优化后的参数为:液化温度为270 ℃;水葫芦和丙酮的质量比为1:5;液化时间为90 min。
3.2 结果讨论水葫芦的液化实验最佳条件结果表明液化温度为产油率的显著性影响因素,所以在最佳水葫芦和丙酮的质量比为1:5及停留时间90 min下,探究了不同温度(240、250、260、270、280 ℃)对生物油产率、热值、酸值及生物油组分分布及变化的影响规律。
3.2.1 液化温度对水葫芦液化产物产率的影响在停留时间为90 min及水葫芦和丙酮的质量比为1:5的条件下探究不同液化温度对三相产物产率的影响,不同液化温度对液化产物产率的影响规律如图 3所示。随着液化温度的升高,生物油的产率先升高后降低,在液化温度为270 ℃时产油率最高为22.54%,生物质炭的产率随着温度的升高而下降,可能因为液化初始阶段只发生生物质的解聚作用,在反应的后一阶段发生再聚合作用导致残渣的产生。该变化趋势和文献[18]中木屑在180、250、280 ℃水热液化制取生物油产率变化趋势一致,研究发现温度对生物油产率的影响是因为温度的升高会导致生物质内部的裂解加剧,从而使得液体产物增多;液化温度进一步升高,液体产物发生在聚合反应,从而使得液体产物产率降低。在文献[19]粪肥在温度260~340 ℃水热液化也发现了生物油产率同样的变化,作者认为由于温度升高,大量的生物质发生了解聚作用造成生物油产率升高。文献[20]发现水葫芦的分解在低温阶段只生成一些小分子化合物,当温度高于280 ℃时才发生二次聚合反应。适当提高反应温度对液化是有利的,提高液化得率,但过高的反应温度又会促使中间产物分解转化为气体物质或焦炭,导致液体产物产率降低。而气体产率随着温度的升高先升高后下降。
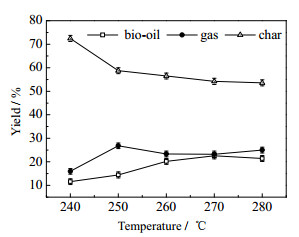
|
图 3 液化温度对水葫芦直接液化产物产率的影响 Fig.3 Effects of temperature on product yields during direct liquefaction of water hyacinth |
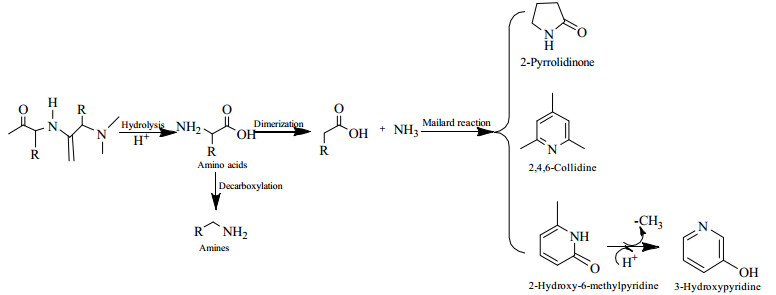
实验采用GC/MS对生物油进行分析,研究温度对生物油组成的影响。不同温度下水葫芦液化制得的生物油组分按化学基团进行分类的化合物种类及相对应的峰面积(峰面积的大小在一定程度上代表了化合物含量的多少[21])如表 5所示。把生物油组分分为酸类、酮类、酯类、醇类、酚类、烃类、芳香类及含氮化合物等各类物质(含有多种官能团的分子,按照其主要官能团进行分类)。从表 5可知,随着温度的升高,酮类化合物含量先降低再升高,酸类化合物、酚类化合物和含氮化合物含量先升高后降低。如图 4所示,生物油中的酸类物质主要来自于生物质原料中纤维素和半纤维素的分解,以乙酸为主,生物油中的其他酸类化合物是水葫芦中酯降解生成的。酮酸类物质进一步发生脱羧反应可以得到相应的酮类物质,而(R)-(-)-甘油醇缩丙酮((R)-(-)-2, 2-dimethyl-1, 3-dioxolane-4-methanol)则可能来自苯衍生物如氨基酸芳基的开环分解[22],两分子乙酸经过脱水及去二氧化碳生成丙酮,两分子丙酮经过自身脱水反应生成4-羟基-4-甲基-2-戊酮(4-hydroxy-4-methyl-2-pentanone),再通过取代、脱水反应分别得到具有类似结构的酮类物质如4-甲基-3-戊烯-2-酮(4-methyl-3-penten-2-one),以上2种产物是液相产物中含量较高的具有链状结构的酮类物质。水葫芦原料中的蛋白质受热分解产生含氮化合物,含氮化合物发生脱羧或脱氨基反应生成相应的氨类和酸类物质并释放出CO2和NH3。另外,生物油中含有的含氮杂环化合物如2, 4, 6-三甲基吡啶(2, 4, 6-collidine)、2-吡咯烷酮(2-pyrrolidinone)和2-羟基-6-甲基吡啶(2-hydroxy-6- methylpyridine)等主要是水葫芦中蛋白质液化过程中水解产生氨基酸类化合物,然后在经过二聚化作用生成短链脂肪酸,之后短链脂肪酸和氨气经过一系列反应生成的[23],之后2-羟基-6-甲基吡啶经过去甲基加氢的作用生成3-羟基吡啶(3-hydroxypyridine),蛋白质液化生成含氮化合物的过程如图 5所示。
|
|
表 5 水葫芦液化生物油组分按化学基团进行分类的种类及相对应的峰面积 Table 5 Total peak areas of different groups of chemicals families from direct liquefaction of water hyacinth |
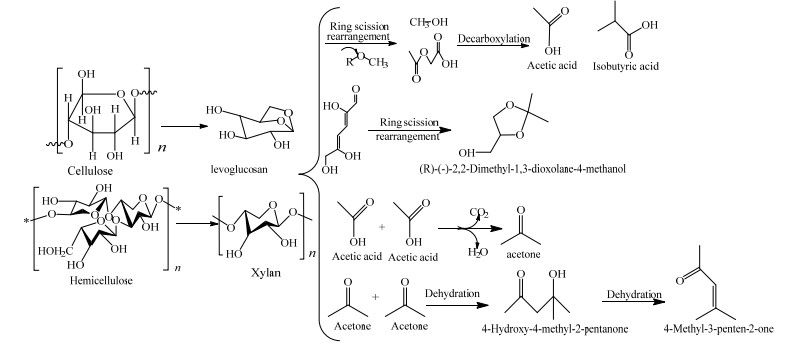
|
图 4 纤维素和半纤维素液化主要路径及产物 Fig.4 Pathways and products of hemicellulose and cellulose liquefaction |
|
图 5 蛋白质液化生成含氮化合物的过程 Fig.5 Transformation of protein into nitrogenous compounds during liquefaction |
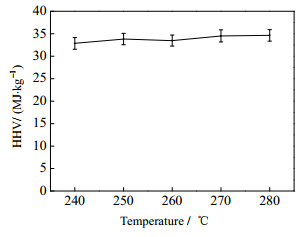
生物油的热值又称发热量,是指在一定温度下,单位质量(气体燃料为单位容积)的燃料完全燃烧后,在冷却至原有温度时所释放的热量,是衡量燃料品质的重要指标,其值大小与生物油的组成关系密切。液化温度对水葫芦液化制生物油热值的影响规律如图 6所示。液化温度从240升至280 ℃,生物油热值基本依次升高,在液化温度为高温段270、280 ℃时,生物油热值为34.51 MJ·kg-1左右,明显高于低温段240、250 ℃的热值(32.86 MJ·kg-1),水葫芦液化制得的生物油热值明显高于在500 ℃时水葫芦单独热解的热值(28.39 MJ·kg-1)[24]。由表 5中可知,结合生物油的组成分析,随着温度的升高,高温段酚类化合物含量、烃类化合物含量和芳烃类化合物含量明显高于低温段,在3者的共同作用下,生物油的热值表现为随着温度的升高而逐渐升高。
|
图 6 液化温度对水葫芦液化生物油热值的影响 Fig.6 Effects of temperature on heating values of bio-oil from water hyacinth liquefaction |
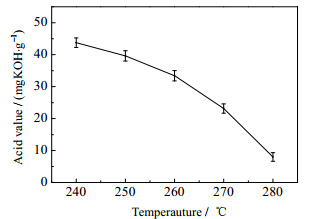
生物油酸值是指中和1 g生物油中游离脂肪酸所需氢氧化钾的mg数。酸值的大小与生物油的应用密切相关,是检验油类对金属的腐蚀性性能的重要参数。液化温度对水葫芦液化制生物油酸值的影响规律如图 7所示。液化温度从240升至280 ℃,生物油酸值依次下降,而且降低幅度越来越大,当液化温度在高温段270、280 ℃时,生物油酸值最低为8.02 mgKOH·g-1,比在低温段240、250 ℃时最大幅度降低了81.67%,酸值降低非常明显。从表 5中可知,随着温度的升高,高温段酸类化合物含量明显低于低温段,这与生物油酸值的变化情况刚好对应。又因为酸类化合物是影响生物油酸值大小的主要物质,其含量高,酸值大,相反酸值就小。从而解释了升高温度可以有效的降低生物油酸值,进而降低生物油的腐蚀性。
|
图 7 液化温度对水葫芦液化生物油酸值的影响 Fig.7 Effects of temperature on acid values of bio-oil during water hyacinth liquefaction |
在丙酮溶剂中,水葫芦直接液化(温度240~280 ℃),生物油产率先升高后下降;热值升高、酸值降低。在高温段,生物油中酚类、烃类、芳烃类以及含氮化合物含量明显高于低温段,而酸类化合物含量明显低于低温段,组分变化趋势和生物油热值、酸值的变化情况一致。结果表明直接液化处理水葫芦废弃物制取生物油是一种制取高热值燃料的方法。
| [1] |
GOYAL H B, SEAL D, SAXENA R C. Bio-fuels from thermochemical conversion of renewable resources:A review[J]. Renewable & Sustainable Energy Reviews, 2008, 12(2): 504-517. |
| [2] |
DEMIRAL I, SENSOZ S. The effects of different catalysts on the pyrolysis of industrial wastes (olive and hazelnut bagasse)[J]. Bioresource Technology, 2008, 99(17): 8002-8007. DOI:10.1016/j.biortech.2008.03.053 |
| [3] |
TSAI W T, LEE M K, CHANG Y M. Fast pyrolysis of rice straw, sugarcane bagasse and coconut shell in an induction-heating reactor[J]. Journal of Analytical & Applied Pyrolysis, 2006, 76(1): 230-237. |
| [4] |
KIM S S, KIM J, PARK Y H, et al. Pyrolysis kinetics and decomposition characteristics of pine trees[J]. Bioresource Technology, 2010, 101(24): 9797-9802. DOI:10.1016/j.biortech.2010.07.094 |
| [5] |
CZERNIK S, BRIDGWATER A V. Overview of applications of biomass fast pyrolysis oil[J]. Energy & Fuels, 2004, 18(2): 590-598. |
| [6] |
赵娜, 李宝霞, 华美玉. 两种金属盐对稻壳热解生物油的影响[J]. 高校化学工程学报, 2016, 30(3): 604-610. ZHAO N, LI B X, HUA M Y. Effects of two metal salts on rice husk pyrolysis for bio-oil[J]. Journal of Chemical Engineering of Chinese Universities, 2016, 30(3): 604-610. |
| [7] |
郭艳, 王垚, 魏飞, 等. 杨木快速裂解过程机理研究[J]. 高校化学工程学报, 2001, 15(5): 440-445. GUO Y, WANG Y, WEI F, et al. Studies on the mechanism of poplar-wood flash pyrolysis process[J]. Journal of Chemical Engineering of Chinese Universities, 2001, 15(5): 440-445. DOI:10.3321/j.issn:1003-9015.2001.05.007 |
| [8] |
谢清若, 童张法, 韦藤幼, 等. 响应面法优化竹材热裂解制备生物油的工艺研究[J]. 高校化学工程学报, 2012, 26(3): 487-492. XIE Q R, TONG Z F, WEI T Y, et al. Optimization of bamboo pyrolysis process to prepare bio-oil by response surface methodology[J]. Journal of Chemical Engineering of Chinese Universities, 2012, 26(3): 487-492. DOI:10.3969/j.issn.1003-9015.2012.03.021 |
| [9] |
卫文娟, 李宝霞. 温度对水葫芦热解特性的影响[J]. 化工进展, 2013, 32(9): 2126-2129. WEI W J, LI B X. Effects of temperature on pyrolysis characteristics of water hyacinth[J]. Chemical Industry and Engineering Progress, 2013, 32(9): 2126-2129. |
| [10] |
张良, 周东, 张士成, 等.水葫芦低温液化制取生物油的试验研究[C].中国环境科学学会学术年会论文集)(4). 2010: 4165-4167. ZHANG L, ZHOU D, ZHANG S C, et al. Experimental investigation on low temperature liquefaction of water hyacinth for bio-oil[C]//Annual academic conference of Chinese society of environmental science (4). 2010: 4165-4167. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-HJKP201005004178.htm |
| [11] |
王知彩, 水恒福, 张德祥, 等. 水热处理对神华煤质的影响[J]. 燃料化学学报, 2006, 34(5): 524-529. WANG Z C, SHUI H F, ZHANG D X, et al. Effects of water heat treatment on shenhua coal quality[J]. Journal of fuel chemistry and technology, 2006, 34(5): 524-529. DOI:10.3969/j.issn.0253-2409.2006.05.003 |
| [12] |
SINGH R, BALAGURUMURTHY B, PRAKASH A, et al. Catalytic hydrothermal liquefaction of water hyacinth[J]. Bioresource Technology, 2015, 178: 157-165. DOI:10.1016/j.biortech.2014.08.119 |
| [13] |
THI B T N, LU K O, THI D T N, et al. Effect of subcritical water pretreatment on cellulose recovery of water hyacinth (Eichhornia crassipe)[J]. Journal of the Taiwan Institute of Chemical Engineers, 2017, 71: 55-61. DOI:10.1016/j.jtice.2016.12.028 |
| [14] |
LI W, PAN C, SHENG L, et al. Upgrading of high-boiling fraction of bio-oil in supercritical methanol[J]. Bioresource Technology, 2011, 102(19): 9223-9228. DOI:10.1016/j.biortech.2011.07.071 |
| [15] |
WANG L, PAN C Y, ZHANG Q J, et al. Upgrading of low-boiling fraction of bio-oil in supercritical methanol and reaction network[J]. Bioresource Technology, 2011, 102(7): 4884-4889. DOI:10.1016/j.biortech.2011.01.053 |
| [16] |
LIU Z, ZHANG F S. Effects of various solvents on the liquefaction of biomass to produce fuels and chemical feedstocks[J]. Energy Conversion & Management, 2008, 49(12): 3498-3504. |
| [17] |
KUNAR A, SINGH L K, GHOSH S. Bioconversion of lignocellulosic fraction of water-hyacinth (Eichhornia crassipes) hemicellulose acid hydrolysate to ethanol by Pichia stipitis[J]. Bioresource Technology, 2009, 100(13): 3293-3297. DOI:10.1016/j.biortech.2009.02.023 |
| [18] |
KARAGOZ S, BHASKAR T, MUTO A, et al. Low-temperature hydrothermal treatment of biomass: effect of reaction parameters on products and boiling point distributions[J]. Energy & Fuels, 2004, 18(1): 234-241. |
| [19] |
XIU S, SHAHBAZI A, SHIRLEY V, et al. Hydrothermal pyrolysis of swine manure to bio-oil:Effects of operating parameters on products yield and characterization of bio-oil[J]. Journal of Analytical & Applied Pyrolysis, 2010, 88(1): 73-79. |
| [20] |
ZHANG L, LI C J, ZHOU D, et al. Hydrothermal liquefaction of water hyacinth:Product distribution and identification[J]. Energy Sources, 2013, 35(14): 1349-1357. DOI:10.1080/15567036.2012.677937 |
| [21] |
DU Z, MOHR M, MA X, et al. Hydrothermal pretreatment of microalgae for production of pyrolytic bio-oil with a low nitrogen content[J]. Bioresource Technology, 2012, 120(3): 13-18. |
| [22] |
BHASKAR T, SERA A, MUTO A, et al. Hydrothermal upgrading of wood biomass:Influence of the addition of K2CO3, and cellulose/lignin ratio[J]. Fuel, 2008, 87(10/11): 2236-2242. |
| [23] |
BILLER P, ROSS A B. Potentia yields and properties of oil from the hydrothermal liquefaction of microalgae with different biochemical content[J]. Bioresource Technology, 2011, 102(1): 215-225. DOI:10.1016/j.biortech.2010.06.028 |
| [24] |
LIN H J, RONG C X, JIU B B, et al. Effects of chromium on pyrolysis characteristic of water hyacinth (Eichornia crassipes)[J]. Renewable Energy, 2018, 115: 676-684. DOI:10.1016/j.renene.2017.08.045 |




