锶因独特的物理化学性能而被广泛应用于电子、化工、材料等领域,天青石(SrSO4)和菱锶矿(SrCO3)是锶最重要的矿物来源,工业上常通过碳还原法获得锶的盐类化合物,但该方法对锶的利用率通常低于75%,每生产1吨碳酸锶产生2.5吨锶盐废渣,造成锶资源的大量浪费[1]。锶盐废渣中CaO质量分数高达42%,SrO质量分数达14%,同时还有镁、铝等化合物共存,若能将锶矿废渣中的Sr、Ca、Mg、Al等元素进行回收,既可提高锶资源的利用率,还能解决因含锶废渣堆积引起的环境污染问题,具有一定的社会效益和经济效益[2]。在锶盐废渣回收利用工艺中,常以HCl或NH4Cl作为浸取剂,将废渣中有用组分从固相转移至NH4+、Mg2+、Ca2+、Sr2+、Al3+、Cl−共存的混合溶液中,结合相分离技术手段,利用各盐溶解度差异进行混盐分离。因而,有必要开展NH4+、Mg2+、Ca2+、Sr2+、Al3+、Cl−共存体系相平衡与相图研究,获取各盐结晶析出规律,为锶盐分离纯化提供基础热力学数据。
氯化锶存在多种结晶形式SrCl2·mH2O(m=0, 1, 2, 6), 且结晶形式受温度和共存离子影响。因而,有必要开展含锶体系多温相平衡研究。针对含锶体系,国内外开展了如三元体系LiCl-SrCl2-H2O (273.2~348.2) K[3-6]、CaCl2-SrCl2-H2O (288.2~373.2) K[7-10]、SrCl2-MgCl2/AlCl3-H2O 298.2 K[11-12],研究发现:氯化锶易与氯化钙形成固溶体[(Sr,Ca)Cl2]·6H2O、[(Ca,Sr)Cl2]·6H2O;锂锶、锶镁共存体系中,298.2 K时氯化锶同时以SrCl2·6H2O、SrCl2·2H2O形式存在。学者还对四元体系NH4Cl-MgCl2-SrCl2-H2O 298.2 K[13]、KCl-CaCl2-SrCl2-H2O 288.2 K[14]、LiCl-KCl-SrCl2-H2O 298.2 K[15]、CaCl2-SrCl2-BaCl2-H2O 338.2 K[16]、MgCl2-SrCl2-AlCl3-H2O 298.2 K[17];五元体系LiCl-NaCl-KCl/CaCl2-SrCl2-H2O 298.2 K[18-19]、NaCl-KCl-MgCl2-SrCl2-H2O 373.2 K[20];七元体系LiCl-NaCl-KCl-MgCl2-CaCl2-SrCl2-H2O[21]等开展了相平衡研究。结果表明:与三元体系相比,同一温度下,体系中引入氯化铵、氯化钠、氯化钾、氯化铝后对氯化锶结晶形式未产生影响。四元体系NH4Cl-CaCl2-SrCl2-H2O是NH4+、Mg2+、Ca2+、Sr2+、Al3+、Cl−共存体系的关键子体系,暂未见其相平衡研究的相关报道。本课题组已开展了298.2 K时该四元体系包含的3个三元子体系:NH4Cl-SrCl2-H2O[22]、NH4Cl-CaCl2-H2O[22]、CaCl2-SrCl2-H2O相平衡研究,结果表明:氯化锶以SrCl2·6H2O、[(Sr, Ca)Cl2]·6H2O、[(Ca, Sr)Cl2]·6H2O这3种结晶形式存在于CaCl2-SrCl2-H2O体系中;其他2个三元体系中,氯化锶均以SrCl2·6H2O形式存在。为进一步获取铵锶钙共存氯化物体系中氯化锶结晶析盐规律,在前期三元体系研究的基础上,本研究采用等温溶解平衡法开展了298.2 K下四元体系NH4Cl-CaCl2-SrCl2-H2O相平衡研究,为含锶尾矿制备氯化锶提供理论依据和数据。
2 实验(材料和方法) 2.1 实验试剂与仪器主要试剂:NH4Cl、SrCl2·6H2O、AgNO3(分析纯AR,国药集团化学试剂有限公司);CaCl2·6H2O(AR,天津市科密欧化学试剂有限公司);铵(NH4+)、锶、钙单元素标准溶液来源于国家有色金属及电子材料分析测试中心。
主要仪器:分析天平(Practum224 - 1CN,Sartorius科学仪器(北京)有限公司,精度±0.000 1 g);高精度超级恒温水浴(HH - 601A,常州市金坛友联仪器研究所,精度±0.03 K);水浴振荡器(HZS - HA,哈尔滨市东联电子技术开发有限公司,精度±0.2 K);阿贝折射仪(WYA,上海仪电物理光学仪器公司,精度±0.000 2);火焰原子吸收光谱仪(iCE-3300,赛默飞世尔科技(中国)有限公司);离子色谱仪(CIC-D100,青岛盛瀚色谱技术有限公司);X射线衍射仪(DX-2700,丹东方圆仪器有限公司)。
2.2 实验方法298.2 K四元体系NH4Cl-CaCl2-SrCl2-H2O相平衡研究采用等温溶解平衡法。具体流程为:配制以三元子体系共饱点组成的基础饱和溶液,结合引入新盐的溶解度,按照一定梯度逐渐加入第3种新盐,在100 mL硬质玻璃瓶中配制一系列试液。将配制好试液的硬质玻璃瓶置于298.2 K恒温水浴振荡器中,以120 r⋅min−1不断振荡以促进体系达到平衡。持续振荡3周后,每隔48 h取上层清液进行分析,当试液中各离子质量分数连续3次分析变化小于0.5% 时,认为体系达到平衡。平衡后,分取固液相样品,测定平衡液相的密度、折光率及其组成,平衡固相采用X-ray粉晶衍射法进行鉴定。
2.3 分析方法Cl−采用AgNO3容量法测定[23];NH4+采用离子色谱法测定[24];Ca2+、Sr2+采用火焰原子吸收法测定[25-26]。平衡溶液密度采用称量瓶法测定,折光率采用阿贝折射仪(测定前用去离子水校正,并配以HH-601A高精度超级恒温水浴控温)测定。平行测定3次,取平均值为最后实验值。测量不确定度分别为:u(ρ)=0.2 kg⋅m−3,u(nD) =0.000 2,ur(w(Cl−))=0.003 0;ur(w(Ca2+))=ur(w(Sr2+))=0.005 0;ur(w(NH4+))=0.003 1,ρ为密度;nD为折光率;w为各离子的质量分数。
3 实验结果与讨论298.2 K四元体系NH4Cl-CaCl2-SrCl2-H2O溶解度数据列于表 1,溶解度分别采用质量分数w(B)和干基百分含量耶涅克指数(Jänecke index) [17] J(B)表示,其中B = NH4Cl,CaCl2,SrCl2,H2O。
|
|
表 1 298.2 K四元体系NH4Cl-CaCl2-SrCl2-H2O固液相平衡组成① Table 1 Composition of quaternary system NH4Cl-CaCl2-SrCl2-H2O at 298.2 K |
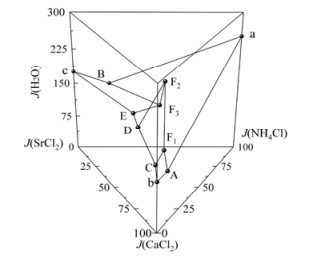
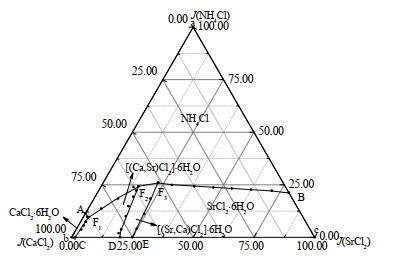
根据表 1中298.2 K四元体系NH4Cl-CaCl2-SrCl2-H2O的二元、三元和四元共饱点的溶解度数据,绘制了298.2 K四元体系NH4Cl-CaCl2-SrCl2-H2O的空间立体图,见图 1。根据表 1中实验数据,采用由顶向底面投影,绘制298.2 K四元体系NH4Cl-CaCl2-SrCl2-H2O稳定相图,见图 2。
|
图 1 298.2 K四元体系NH4Cl-CaCl2-SrCl2-H2O空间立体图 Fig.1 Space diagram of quaternary system NH4Cl-CaCl2-SrCl2-H2O at 298.2 K |
|
图 2 298.2 K四元体系NH4Cl-CaCl2-SrCl2-H2O稳定相图 Fig.2 Phase diagram of quaternary system NH4Cl-CaCl2-SrCl2-H2O at 298.2 K |
由图 1和2可知,298.2 K时该体系稳定相图由3个四元共饱点,7条单变量曲线和3个单盐以及2个固溶体结晶区组成,无复盐生成。图 1和2中点、线、区的意义分别为
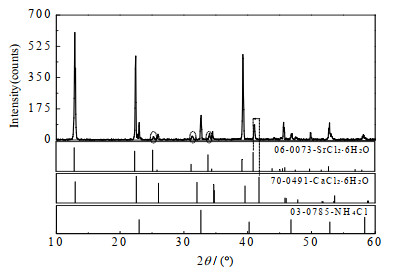
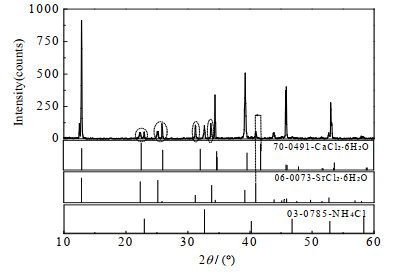
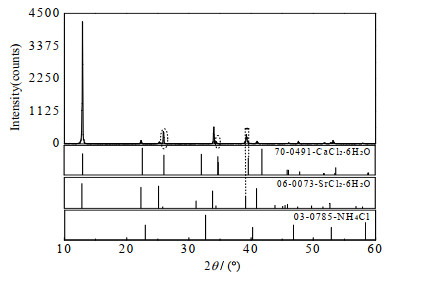
(1) 3个共饱点(F1、F2、F3)组成分别为:共饱点F1对应的平衡液相组成为w(NH4Cl)=3.73%,w(CaCl2)=34.75%,w(SrCl2)=0.83%,w(H2O)=60.69%;经X-ray粉晶衍射分析(见图 3)可知其平衡固相组成为NH4Cl+CaCl2·6H2O + [(Ca, Sr)Cl2]·6H2O。共饱点F2对应的平衡液相组成为w(NH4Cl)=7.03%,w(CaCl2)=17.53%,w(SrCl2) =4.49%,w(H2O)=70.95%;经X-ray粉晶衍射分析(见图 4)可知其平衡固相组成为NH4Cl+[(Ca,Sr)Cl2]·6H2O+[(Sr,Ca)Cl2]·6H2O。共饱点F3对应的平衡液相组成为w(NH4Cl)=9.20%,w(CaCl2)=18.14%,w(SrCl2)=8.00%,w(H2O)=64.66%;经X-ray粉晶衍射分析(见图 5)可知其平衡固相组成为NH4Cl+SrCl2·6H2O+[(Sr, Ca)Cl2]·6H2O。
|
图 3 共饱点F1处平衡固相XRD图谱 Fig.3 XRD pattern of the sample from the invariant point F1 |
|
图 4 共饱点F2处平衡固相XRD图谱 Fig.4 XRD pattern of the sample from the invariant point F2 |
|
图 5 共饱点F3处平衡固相XRD图谱 Fig.5 XRD pattern of the sample from the invariant point F3 |
(2) 7条单变量曲线,即两固一液饱和溶解度曲线,分别为:AF1:NH4Cl+CaCl2·6H2O;CF1:CaCl2·6H2O+[(Ca,Sr)Cl2]·6H2O;F1F2:NH4Cl+[(Ca,Sr)Cl2]·6H2O;DF2:[(Ca,Sr)Cl2]·6H2O+[(Sr,Ca)Cl2]·6H2O;F2F3:NH4Cl +[(Sr,Ca)Cl2]·6H2O;EF3:SrCl2·6H2O+[(Sr,Ca)Cl2]·6H2O;BF3:NH4Cl+SrCl2·6H2O。
(3) 5个结晶区分别对应2个固溶体结晶区:[(Ca,Sr)Cl2]·6H2O(CF1F2DC)、[(Sr, Ca)Cl2]·6H2O(DF2F3ED);3个单盐结晶区:NH4Cl(aAF1F2F3Ba)、CaCl2·6H2O(bAF1Cb)、SrCl2·6H2O(cBF3Ec)。结晶区面积按照CaCl2·6H2O、[(Sr,Ca)Cl2]·6H2O、[(Ca,Sr)Cl2]·6H2O、SrCl2·6H2O、NH4Cl的顺序依次增大,对应盐的溶解度逐渐减小。CaCl2对NH4Cl有较强盐析作用,铵钙锶共存氯化物体系中NH4Cl最先达到饱和,结晶从溶液中析出,其次析出SrCl2·6H2O。因而,可通过控制蒸发过程回收NH4Cl实现含锶尾矿溶浸过程中溶浸剂重复利用,并制得SrCl2·6H2O产品。
3.2 固溶体结晶形式讨论固溶体指具有相似化学性质的原子、离子或分子在相同或相似晶胞结构中出现位点替代时形成的均匀混合晶体。一般情况下,晶格类型相同、原子结构相似、晶格参数大小相近的化合物具备形成固溶体的基础条件。本研究体系中,CaCl2·6H2O和SrCl2·6H2O同属六方晶系,晶胞参数相近(CaCl2·6H2O:a = b = 7.876×10−10m,c = 3.954×10−10m;SrCl2·6H2O:a = b = 7.963×10−10m,c = 4.125×10−10 m,其中,a、b、c为3个晶轴方向上的单位平移向量的长度),Ca2+和Sr2+的离子半径分别为0.99×10−10和1.13×10−10 m,二者离子半径相近,且半径差值比
固溶体体系中,由于形成固溶体的2种纯盐晶胞参数不同,以其中一种纯盐为母相发生置换时,形成的固溶体的晶胞参数较2种纯盐发生改变,因而在固溶体对应的XRD谱图上表现为出峰角度会发生相对2种纯盐衍射角度的位移。基于此,在钙锶共存[7]、铵钾共存[27]的氯化物体系中,通过平衡固相XRD衍射峰的偏移和叠加对是否存在固溶体进行判断。本研究体系中涉及锶钙共存体系,根据固溶体中母相的不同,即固溶体中SrCl2和CaCl2组成比例的不同,将[(Srx,Ca1-x)Cl2]·6H2O固溶体分为富锶固溶体[(Sr,Ca) Cl2]·6H2O、富钙固溶体[(Ca,Sr) Cl2]·6H2O。以母相晶体(CaCl2·6H2O、SrCl2·6H2O)为基础,将共饱点处的XRD谱图与SrCl2·6H2O和CaCl2·6H2O的标准卡片进行对比,根据SrCl2·6H2O和CaCl2·6H2O特征峰的偏移和叠加来判断固溶体[(Sr,Ca) Cl2]·6H2O和[(Ca,Sr) Cl2]·6H2O是否存在。
图 3是共饱点F1处的XRD图谱,图中衍射峰与NH4Cl(PDF#: 03-0785)和CaCl2·6H2O(PDF#: 70-0491)标准卡片特征峰吻合较好,则该点处平衡固相中存在单盐NH4Cl和CaCl2·6H2O;2θ位于24°~26°和30°~34°时(图 3中虚线椭圆标注处),出现了SrCl2·6H2O(PDF#: 06-0073)的特征峰,2θ在40°~42°时,原CaCl2·6H2O对应的衍射峰向标准卡片SrCl2·6H2O特征峰对应的衍射角处偏移(图 3中箭头所指位置),说明此时固相CaCl2·6H2O中锶部分替代钙,形成富钙固溶体[(Ca,Sr) Cl2]·6H2O,因而共饱点F1处的平衡固相由NH4Cl、CaCl2·6H2O和富钙固溶体[(Ca,Sr) Cl2]·6H2O组成。
由4图可知:共饱点F2处衍射峰与NH4Cl(PDF#: 03-0785)标准卡片特征峰吻合较好,表明平衡固相中存在单盐NH4Cl;当2θ为22°~26°和30°~34°时(图 4中虚线椭圆标注处),F2的衍射图谱同时出现SrCl2·6H2O(PDF#: 06-0073)和CaCl2·6H2O(PDF#: 70-0491)标准卡片特征峰,且在2θ为40°~42°时(图 4中箭头所指位置),衍射峰位于纯SrCl2·6H2O和纯CaCl2·6H2O特征峰对应角度区间,结合三元体系CaCl2-SrCl2-H2O相平衡研究结果,说明此时体系中同时存在[(Ca,Sr) Cl2]·6H2O和[(Sr,Ca) Cl2]·6H2O。
从图 5可知:共饱点F3处衍射峰与纯盐NH4Cl(PDF#: 03-0785)和SrCl2·6H2O(PDF#: 06-0073)标准卡片特征峰吻合较好,表明该点处同时存在单盐NH4Cl和SrCl2·6H2O;2θ为26°~28°和34°~36°时(图 5中虚线椭圆标注处),出现CaCl2·6H2O的特征峰,2θ为38°~40°时(图 5中箭头所指位置),衍射峰向CaCl2·6H2O特征峰处偏移,说明此时在SrCl2·6H2O中钙部分替代锶,形成富锶固溶体[(Sr,Ca) Cl2]·6H2O。
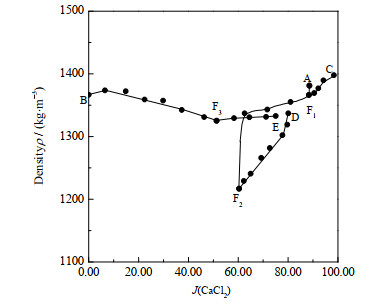
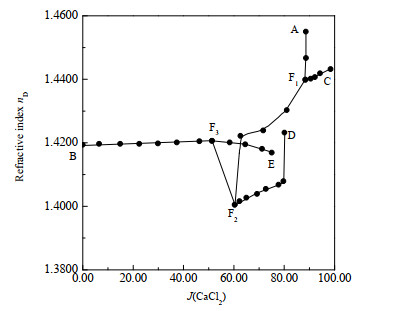
3.3 四元体系NH4Cl-CaCl2-SrCl2-H2O物化性质-组成图表 2为298.2 K时四元体系NH4Cl-CaCl2-SrCl2-H2O的密度、折光率数据。根据表 2数据,绘制了相应的密度-组成图(见图 6)和折光率-组成图(见图 7)。
|
|
表 2 298.2 K四元体系NH4Cl-CaCl2-SrCl2-H2O的密度、折光率数据① Table 2 Density ρ and refractive index nD of quaternary system NH4Cl-CaCl2-SrCl2-H2O at 298.2 K |
|
图 6 298.2 K四元体系NH4Cl-CaCl2-SrCl2-H2O密度-组成图 Fig.6 Density-composition diagram of quaternary system NH4Cl-CaCl2-SrCl2-H2O at 298.2 K |
|
图 7 298.2 K四元体系NH4Cl-CaCl2-SrCl2-H2O折光率-组成图 Fig.7 Refractive index-composition diagram of quaternary system NH4Cl-CaCl2-SrCl2-H2O at 298.2 K |
由图 6可知,在单变量曲线F1F2、AF1、CF1、DF2、EF3上,平衡液相密度随J(CaCl2)增大而增大;在单变量曲线BF3、F2F3上,平衡液相密度随J(CaCl2)的增大而减小。图 7中,在单变量曲线F1F2、AF1、CF1、DF2上,折光率随着J(CaCl2)的增大而增大;在单变量曲线EF3、F2F3上,折光率随J(CaCl2)的增大而呈下降趋势;在单变量曲线BF3上,随着J(CaCl2)的增大,折光率变化较小。
4 结论(1) 298.2 K四元体系NH4Cl-CaCl2-SrCl2-H2O为复杂体系,有单盐NH4Cl、SrCl2·6H2O、CaCl2·6H2O和固溶体[(Ca,Sr)Cl2]·6H2O和[(Sr,Ca)Cl2]·6H2O生成。
(2) 298.2 K稳定相图由3个共饱点,7条单变量曲线和5个结晶区组成。5种盐按照NH4Cl→SrCl2·6H2O→[(Ca,Sr)Cl2]·6H2O→[(Sr,Ca)Cl2]·6H2O→CaCl2·6H2O顺序析出,通过控制结晶过程可实现含锶尾矿溶浸工艺中NH4Cl的重复利用,并制备得到SrCl2·6H2O。
| [1] |
李波, 段东平, 王树轩, 等. 以碳酸锶废渣为原料制备高纯氯化锶[J]. 盐湖研究, 2013, 21(2): 58-61. LI B, DUAN D P, WANG S X, et al. The preparation of high purity strontium chloride from strontium carbonate waste[J]. Journal of Salt Lake Research, 2013, 21(2): 58-61. |
| [2] |
李常娥, 李国庭. 含锶废渣制备氯化锶新工艺研究[J]. 无机盐工业, 2020, 52(1): 79-81. LI C E, LI G T. Study on new technology of preparing strontium chloride from strontium-containing waste residue[J]. Inorganic Chemicals Industry, 2020, 52(1): 79-81. |
| [3] |
WANG X, ZHAO K Y, GUO Y F, et al. Experimental determination and thermodynamic model of solid-liquid equilibria in the ternary system (LiCl+SrCl2+H2O) at 273.15 K and its application in industry[J]. Journal of Solution Chemistry, 2019, 48(4): 528-545. DOI:10.1007/s10953-019-00864-4 |
| [4] |
LI X P, HE C X, GAO Y Y, et al. Studies on phase equilibria in the ternary system LiCl-SrCl2-H2O and the quaternary system KCl-LiCl-SrCl2-H2O at 308 K[J]. Journal of Chemical & Engineering Data, 2019, 64(9): 4077-4083. |
| [5] |
LI H X, GUO L J. Solubility and phase diagram investigation of the ternary system LiCl-SrCl2-H2O at 323.15 K and 348.15 K[J]. Fluid Phase Equilibria, 2020, 516: 112593. DOI:10.1016/j.fluid.2020.112593 |
| [6] |
GUO L J, SUN B, ZENG D W, et al. Isopiestic measurement and solubility evaluation of the ternary system LiCl-SrCl2-H2O at 298.15 K[J]. Journal of Chemical & Engineering Data, 2012, 57(3): 817-827. |
| [7] |
毕玉敬, 孙柏, 赵静, 等. 25 ℃时三元体系SrCl2-CaCl2-H2O相平衡研究[J]. 无机化学学报, 2011, 27(9): 1765-1771. BI Y J, SUN B, ZHAO J, et al. Phase equilibrium in ternary system SrCl2-CaCl2-H2O at 25℃[J]. Chinese Journal of Inorganic Chemistry, 2011, 27(9): 1765-1771. |
| [8] |
GUO L J, ZENG D W, YAO Y, et al. Isopiestic measurement and solubility evaluation of the ternary system (CaCl2+SrCl2+H2O) at T=298.15 K[J]. The Journal of Chemical Thermodynamics, 2013, 63: 60-66. DOI:10.1016/j.jct.2013.03.021 |
| [9] |
LI D, MENG L Z, GUO Y F, et al. Chemical engineering process simulation of brines using phase diagram and Pitzer model of the system CaCl2-SrCl2-H2O[J]. Fluid Phase Equilibria, 2019, 484: 232-238. DOI:10.1016/j.fluid.2018.11.034 |
| [10] |
GAO Y Y, YE C, ZHANG W Y, et al. Phase equilibria in the ternary system CaCl2-SrCl2-H2O and the quaternary system KCl-CaCl2-SrCl2-H2O at 373 K[J]. Journal of Chemical & Engineering Data, 2018, 63(8): 2738-2742. |
| [11] |
王林, 郑秋风, 刘敏, 等. 三元体系SrCl2+MgCl2+H2O 298 K相平衡测定及计算[J]. 高校化学工程学报, 2019, 33(4): 800-807. WANG L, ZHENG Q F, LIU M, et al. Phase equilibrium measurements and simulation of the SrCl2+MgCl2+H2O ternary system at 298 K[J]. Journal of Chemical Engineering of Chinese Universities, 2019, 33(4): 800-807. DOI:10.3969/j.issn.1003-9015.2019.04.004 |
| [12] |
YU X D, ZHENG Q F, WANG L, et al. Solid-liquid phase equilibrium determination and correlation of ternary systems NH4Cl+AlCl3+H2O, MgCl2+AlCl3+H2O and SrCl2+AlCl3+H2O at 298 K[J]. Fluid Phase Equilibria, 2020, 507: 112426. DOI:10.1016/j.fluid.2019.112426 |
| [13] |
ZHENG Q F, WANG L, ZHENG H, et al. Solid-liquid equilibria and Pitzer model simulation of the SrCl2-NH4Cl-MgCl2-H2O quaternary system at T=298 K[J]. Journal of Chemical & Engineering Data, 2018, 63(12): 4606-4613. |
| [14] |
LI D, SHI T, ZHAO H, et al. Phase equilibria in the quaternary systems (KCl+CaCl2+SrCl2+H2O) and(LiCl+NaCl+SrCl2+H2O) at 288.15 K and 0.1 MPa[J]. Journal of Chemical & Engineering Data, 2020, 65(11): 5266-5274. |
| [15] |
NIE G L, SANG S H, CUI R Z, et al. Measurements and calculations of solid-liquid equilibria in two quaternary systems: LiCl-NaCl-SrCl2-H2O and LiCl-KCl-SrCl2-H2O at 298 K[J]. Fluid Phase Equilibria, 2020, 509: 112458. DOI:10.1016/j.fluid.2020.112458 |
| [16] |
曹大群, 金艳, 陈杭, 等. 338.15 K时四元体系CaCl2-SrCl2-BaCl2-H2O相平衡测定及溶解度计算[J]. 化工学报, 2021, 72(10): 5028-5039. CAO D Q, JIN Y, CHEN H, et al. Phase equilibria determination and solubility calculation of the quaternary system CaCl2-SrCl2-BaCl2-H2O at 338.15 K[J]. CIESC Journal, 2021, 72(10): 5028-5039. |
| [17] |
郑秋风, 罗军, 陈帅, 等. 298.2 K四元体系MgCl2-SrCl2-AlCl3-H2O相平衡实验及溶解度计算[J]. 化工学报, 2020, 71(12): 5443-5451. ZHENG Q F, LUO J, CHEN S, et al. Measurements and simulation for aqueous quaternary system MgCl2-SrCl2-AlCl3-H2O at 298.2 K[J]. CIESC Journal, 2020, 71(12): 5443-5451. |
| [18] |
MENG L Z, LI D. Pitzer thermodynamic modeling study on solid-liquid equilibria of the quinary system LiCl-NaCl-CaCl2-SrCl2-H2O at 298.15 K[J]. RSC Advances, 2017, 7(86): 54313-54317. DOI:10.1039/C7RA11544J |
| [19] |
孙柏, 宋彭生, 李武, 等. 含锶油田水体系热力学和相平衡研究I. Sr, Na, K, Li // Cl-H2O体系[J]. 盐湖研究, 2015, 23(4): 50-58, 65. SUN B, SONG P S, LI W, et al. Thermodynamics and phase equilibria of the oil field brine with Sr system at 25 ℃ I. Sr, Na, K, Li // Cl-H2O system[J]. Journal of Salt Lake Research, 2015, 23(4): 50-58, 65. |
| [20] |
GAO Y Y, LI X P, HE X F, et al. Study of phase equilibria in quinary system NaCl -KCl -MgCl2 - SrCl2 - H2O at 373 K[J]. Journal of Chemical & Engineering Data, 2018, 63(12): 4497-4501. |
| [21] |
雷锦顺, 李东东, 庄子宇, 等. Li-Na-K-Mg-Ca-Sr-Cl-H2O七元体系多温相平衡性质的热力学模拟研究[J]. 盐湖研究, 2021, 29(3): 17-37. LEI J S, LI D D, ZHUANG Z Y, et al. Thermodynamic modeling of the phase equilibrium in the Li-Na-K-Mg-Ca-Sr-Cl-H2O system[J]. Journal of Salt Lake Research, 2021, 29(3): 17-37. |
| [22] |
WANG L, YU X D, LI M L, et al. Phase equilibrium for the aqueous ternary systems NH4+, Sr2+(Ca2+)//Cl--H2O at T=298 K[J]. Journal of Chemical Engineering of Japan, 2018, 51(7): 551-555. |
| [23] |
中国科学院青海盐湖研究所. 卤水和盐的分析方法[M]. 2版. 北京: 科学出版社, 1988: 69-72. Institute of Qinghai Salt-lake of Chinese Academy of Sciences.. Analytical methods of brines and salts[M]. 2nd ed. Beijing: Chinese Science Press, 1988: 69-72. |
| [24] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 工业循环冷却水中钠、铵、钾、镁和钙离子的测定离子色谱法: GB/T 15454-2009 [S]. 北京: 中国标准出版社, 2009. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. Industrial circulating cooling water-Determination of sodium, ammonium, potassium, magnesium and calcium-Ion chromatography: GB/T 15454-2009 [S]. Beijing: Standards Press of China, 2009. |
| [25] |
国家市场监督管理总局, 中国国家标准化管理委员会. 铝及铝合金化学分析方法第21部分: 钙含量的测定: GB/T 20975.21-2020 [S]. 北京: 中国标准出版社, 2020. State Administration for Market Regulation, Standardization Administration of the People's Republic of China. Method for chemical analysis of aluminium and aluminium alloys-Part 21: Determination of calcium content: GB/T 20975.21-2020 [S]. Beijing: Standards Press of China, 2020. |
| [26] |
国家市场监督管理总局, 国家标准化管理委员会. 铝及铝合金化学分析方法第17部分: 锶含量的测定: GB/T 20975.17-2020 [S]. 北京: 中国标准出版社, 2020. State Administration for Market Regulation, Standardization Administration of the People's Republic of China. Method for chemical analysis of aluminium and aluminium alloys-Part 17: Determination of strontium content: GB/T 20975.17-2020 [S]. Beijing: Standards Press of China, 2020. |
| [27] |
ZHONG Y L, CHEN J X, SU M, et al. Solid-liquid equilibrium, crystal type, solid solubility and thermal stability studies of potassium ammonium chloride solid solution[J]. Fluid Phase Equilibria, 2017, 439: 24-30. |




