1 前言
锂离子电池具有能量密度大、平均输出电压高、输出功率大、使用寿命长、无记忆效应等优点,不仅可以应用于便携式通讯设备等小型电子产品,在电动车、航空航天等领域也有很好的发展前景,并正向大型、动力、储能电池方向发展[1~7],世界各国纷纷出巨资开发电动汽车及其电源,有效缓解了汽车工业的发展对人类生存环境造成的巨大压力。锂离子电池不含汞、镉、铅等毒害大的重金属元素,因此,常被认为是绿色电池,对环境污染程度相对较小。但锂离子电池的正负极材料、电解质溶液等物质对环境和人体健康依然具有极大的危害性,如果将废旧锂离子电池直接填埋、焚烧、堆肥,其中的钴、镍、锂、锰等金属以及有毒电解液必将对大气、水、土壤造成严重的污染,而废旧锂离子电池的回收利用能够提高资源利用率、大幅降低生产成本。因此,随着锂离子电池用量的逐年增长,失效电池材料回收技术的研究刻不容缓。现有的回收废旧锂离子电池研究主要集中在钴酸锂、镍酸锂和锰酸锂等材料上,磷酸铁锂因材料中稀有金属含量不高一直没有受到研究者的重视。与传统的锂离子二次电池正极材料相比,LiFePO4晶格中Li+嵌脱对晶格的影响不大,具有更好的晶格稳定性与可逆性[8],且放电容量大、环境污染小[9]。另外,与其他锂离子电池正极材料相比,磷酸铁锂电池还在循环寿命和材料成本方面具有巨大的潜在优势,代表着动力电池正极材料未来的发展方向,被业界普遍看好[10]。随着磷酸铁锂电池用量的增大,废旧磷酸铁锂电池的数量必然越来越多,回收利用废旧磷酸铁锂电池的研究具有十分重要的意义。失效磷酸铁锂电池正极材料的主要组成元素为铝、锂、铁、磷和碳。材料经机械粉碎后,利用极性有机溶剂NMP[11]或强碱[12]溶解分离其中的铝,剩余的材料即为LiFePO4和碳粉的混合物。向该混合物中引入Li、Fe、P以调整此三种元素在材料中的摩尔比,再经球磨、惰性气氛下高温煅烧后可重新合成LiFePO4材料,但与首次合成的磷酸铁锂电池正极材料相比,该材料的电容量、充放电性能均有所下降[11]。将失效磷酸铁锂电池正极材料氧化分解回收锂、铁、磷、碳并重新利用才是治标治本的回收路径。
由于HCl为还原性酸,H2O2溶液与其混合后将缓慢分解,无法直接用于浸取LiFePO4。吴越等[13]采用硫酸和硝酸体系对LiFePO4与碳粉混合物进行了浸取回收锂、铁的研究。采用这两种酸性体系浸取回收失效磷酸铁锂电池正极材料锂提取率低、液固比高,导致浸出液中Li+的浓度较低,增加了沉锂难度;耗能高、反应效率低下,因而酸的过量程度高,后续余酸中和阶段必然需要消耗大量的碱;锂、铁分离效果差,LiFePO4氧化不完全、浸出渣中Li残留量高,严重影响了FePO4的回收再利用,浸出液中Fe3+含量高,浸出液净化过程中Fe3+沉淀时必然也会夹带一部分锂,不仅再次降低了锂的回收利用率,还会产生大量的除杂废料。这一系列的问题导致整个磷酸铁锂电池正极材料回收系统十分庞大、工序变得冗长、操作繁杂、原料用量大、废料产出高而且铁、锂都不能得到简便、有效的利用。为解决这些问题,本研究采用磷酸体系浸取失效磷酸铁锂电池正极材料,以高效率、低成本、零废料排放的方法实现更好的锂、铁分离效果,综合回收锂、铁、磷、碳。
2 实验
2.1 实验材料
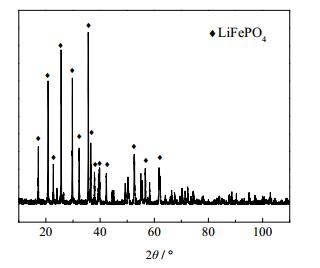
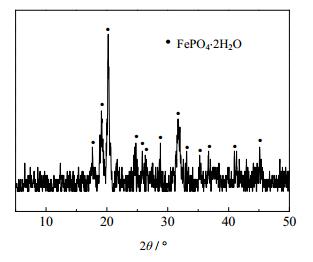
采用经粉碎、除铝后的失效磷酸铁锂电池正极材料进行实验研究,该材料由江西合纵锂业科技有限公司提供。其XRD图谱如图 1所示,主要成分如表 1所示。磷酸、双氧水、氢氧化钠:分析纯,由长沙升阳化工材料有限公司提供。
表 1(Tab. 1)
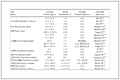
表 1 实验原料成分 Table 1 Composition of the experimental raw material
| Element types |
Fe |
Li |
P |
C |
Mg |
Na |
K |
| Percentage/%(wt) |
32.56 |
4.46 |
18.08 |
7.64 |
n.d. |
n.d. |
n.d. |
|
表 1 实验原料成分 Table 1 Composition of the experimental raw material |
2.2 主要设备
电感耦合等离子体发射光谱仪Agilent 710 ICP-OES:安捷伦科技有限公司提供。DF-101S集热式恒温加热油浴锅:巩义市予华仪器有限责任公司提供。
2.3 实验方法及效果评价
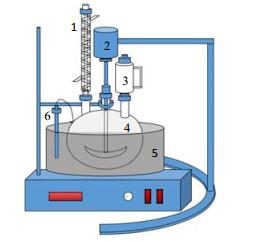
反应装置如图 2所示。将经破碎、除铝后的磷酸铁锂电池正极材料置于三项烧瓶中,按一定的液固质量比(即水与磷酸铁锂电池正极材料质量比)用水调浆并预热至指定温度后,打开恒压分液漏斗,在指定反应时间内匀速滴完其中的H3PO4-H2O2混合溶液进行反应,然后向体系中加入NaOH溶液中和余酸,将体系pH值调至弱酸性,最后过滤以实现液固分离。实验材料参照文献[14]、[15]进行成分分析,浸出液采用ICP-OES测定Li+、Fe3+浓度。锂浸出率、铁沉淀率分别按式(1)、式(2)计算。
|
$
x({\rm{Li)}} = \frac{{V \times c({\rm Li}^ + )}}{{m \times w_{\rm Li}^{}}} \times {100\% }
$
|
(1) |
|
$
r({\rm Fe}) = 1 - \frac{{V \times {{\rm c}}({\rm Fe}^{3 + })}}{{m \times {w_{\rm Fe}}}} \times {100\%}
$
|
(2) |
2.4 实验原理
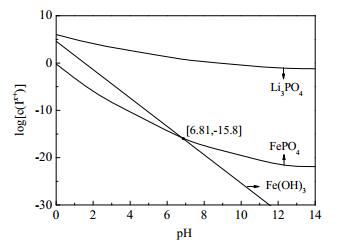
在磷酸体系中,磷酸根型体的分布系数δ(PO43-)与pH值、磷酸的各级电离平衡常数有关[16],所以将磷酸的各级电离平衡常数和Li3PO4、FePO4、Fe(OH)3的溶度积数据代入式(6)~(9)即可求得不同pH值条件下受磷酸根控制的Li+、Fe3+浓度([Li+]P和[Fe3+]P)以及受氢氧根控制的Fe3+浓度([Fe3+]OH),然后将所求得的离子浓度值取对数并对pH值作图即可得到在1 mol·L-1总磷条件下Li3PO4、FePO4、Fe(OH)3的沉淀趋势相对关系图,如图 3所示。离子的沉淀-溶解平衡与气压、溶液pH值、温度、其它离子种类及浓度等诸多因素有关,是一个十分复杂的平衡。虽然图 3并不能精确地反应出体系中离子的实际状态,但可以直观判断特定条件下同种离子以不同形式沉淀的相对趋势大小,依然可以起到十分重要的参考意义。由图 3可知,FePO4沉淀曲线始终位于Li3PO4沉淀曲线的下方,说明在磷酸体系当中,PO43-优先与Fe3+结合生成FePO4沉淀。再结合磷酸形体分布与pH值的关系[16]可知,磷酸体系溶液pH≤4.5,溶液中的锂主要以LiH2PO4的形式存在;pH≥4.5时,Li2HPO4不稳定,将会分解为LiH2PO4和Li3PO4。pH<6.81时FePO4沉淀趋势线位于Fe(OH)3的下方,证明该pH段为FePO4的沉淀优势区;相反地,pH>6.81段为Fe(OH)3的沉淀优势区。所以,H3PO4-H2O2混合溶液滴加完成后,采用NaOH溶液将体系pH值调至2.0~4.5即可将浸出液中剩余的铁沉淀为FePO4而非Fe(OH)3。式(10)为H3PO4-H2O2混合溶液浸取回收失效磷酸铁锂电池正极材料的化学反应方程式,H2O2、H3PO4的反应计量也由此式计算。该反应式各组分热力学数据如表 2所示,由此可计算出该反应的在标准状态下的△rGmΘ=-335.418 kJ·mol-1,说明该反应可以自发向右进行。
表 2(Tab. 2)

表 2 FeLiPO4氧化反应各组分在298.15 K下的热力学数据[17] Table 2 Thermodynamic data of different components used in FeLiPO4 oxidization at 298.15 K
| Components: |
FeLiPO4[18] |
H3PO4 |
H2O2 |
FePO4·2H2O |
H2PO4- |
H2O |
| △fGmΘ/kJ·mol-1 |
-1523.7 |
-1148.2 |
-120.4 |
-1645.48 |
-2271.55 |
-237.1 |
|
表 2 FeLiPO4氧化反应各组分在298.15 K下的热力学数据[17] Table 2 Thermodynamic data of different components used in FeLiPO4 oxidization at 298.15 K |
|
$
{{\rm H}_3}{\rm PO}_4 \rightleftarrows {{\rm H}_2}{\rm PO}_4^ - + {{\rm H}^ + };{ K_{{\rm a}1}} = 7.52 \times 10^{ - {3}}
$
|
(3) |
|
$
{{\rm H}_2}{\rm PO}_4^ - \rightleftarrows {\rm HPO}_4^{2 - } + {{\rm H}^ + };{K_{{\rm a}2}} = 6.31 \times 1{0^{ - 8}}
$
|
(4) |
|
$
{\rm HPO}_4^{2 - } \rightleftarrows {\rm PO}_4^{3 - } + {{\rm H}^ + };{K_{{\rm a}3}} = 4.43 \times 1{0^{ - 13}}
$
|
(5) |
|
$
[{\rm Fe}^{3 + }]_{\rm P} = \frac{{{K_{\rm sp}}({\rm FePO}_4)}}{{[{\rm TP}] \times [{\delta _{{\rm PO}_4^{3 - }}}]}}{;}\;{K_{\rm sp}}{({\rm FePO}_4)^{[19]}} = 1.3 \times 1{0^{ - 22}}
$
|
(6) |
|
$
[{\rm Fe}^{3 + }]_{\rm OH} = \frac{{{K_{\rm sp}}[{\rm Fe}{{({\rm OH})}_3}]}}{{{{[{\rm OH}^ - ]}^3}}};{K_{\rm sp}}{[{\rm Fe}{({\rm OH})_3}]^{[16]}} = 4.0 \times 1{0^{ - 38}}
$
|
(7) |
|
$
{[{\rm Li}^ + ]^3}_{\rm P} = \frac{{{K_{\rm sp}}({\rm Li}_3{\rm PO}_4)}}{{[{\rm TP}] \times [{\delta _{{\rm PO}_4^{3 - }}}]}};{K_{\rm sp}}{({\rm Li}_3{\rm PO}_4)^{[16]}} = 2.4 \times 1{0^{ - 4}}
$
|
(8) |
|
$
{\delta _{{\rm PO}_4^{3 - }}}^{[16]} = \frac{{{K_{{\rm a}1}}{K_{{\rm a}2}}{K_{{\rm a}3}}}}{{{{[{{\rm H}^ + }]}^3} + {K_{a1}}{{[{{\rm H}^ + }]}^2} + {K_{{\rm a}1}}{K_{{\rm a}2}}[{{\rm H}^ + }] + {K_{{\rm a}1}}{K_{{\rm a}2}}{K_{{\rm a}3}}}}
$
|
(9) |
|
$
2{\rm FeLiPO}_{4({\rm s})} + 2{{\rm H}_3}{\rm PO}_{4({\rm aq})} + {{\rm H}_2}{{\rm O}_{2({\rm aq})}} = = 2{\rm FePO}_4 \cdot 2{{\rm H}_2}{{\rm O}_{({\rm s})}} + 2{\rm LiH}_2{\rm PO}_{4({\rm aq})} + 2{{\rm H}_2}{{\rm O}_{({\rm l})}}
$
|
(10) |
3 结果与讨论
3.1 H2O2加入量的影响
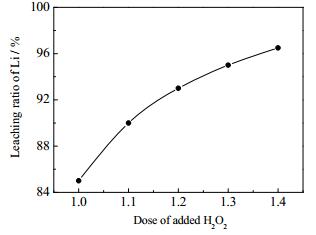
将经破碎、除铝后的失效磷酸铁锂电池正极材料用水按液固质量比2:1调浆,搅拌转速30 r·min-1,将体系预热至30℃后,耗时3 h匀速滴加完H3PO4-H2O2混合溶液。然后采用NaOH溶液将体系pH值调至3.5。其中H3PO4按反应计量加入,改变H2O2加入量以研究其对锂浸出率的影响,结果如图 4所示。由图 4可知,H2O2加入量越多,磷酸铁锂的氧化反应越充分,锂的浸出率也越高。当H2O2用量为1.2倍反应计量时,LiFePO4可被充分氧化。继续提高H2O2用量时,锂的浸出率增幅减小。H2O2为弱酸性,其用量的增加将导致中和余酸过程所需加入的NaOH增多,因此选用1.2倍H2O2用量进行以下研究。
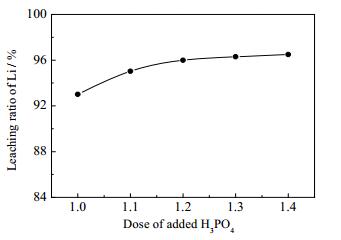
3.2 H3PO4加入量的影响
液固质量比=2:1,搅拌转速为30 r·min-1,将体系预热至30℃后,耗时3 h匀速加完H3PO4-H2O2混合溶液,采用NaOH溶液将体系pH值调至3.5。H2O2混为1.2倍反应计量,改变H3PO4加入量以研究其对锂浸出率的影响,结果如图 5所示。由图 5可知,H3PO4为1.1倍反应计量时,锂浸出率有2.01%的增长,继续增加H3PO4用量只能小幅增加锂浸出率,当H3PO4用量高于1.2倍反应计量时,锂浸出率基本不再增长。NaH2PO4对pH值的改变有较强的缓冲作用,所以增加H3PO4用量会大幅增加余酸中和阶段NaOH的消耗。因此选用1.1倍H3PO4用量进行后续的实验研究。
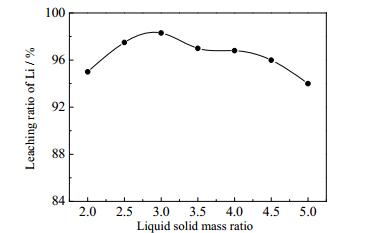
3.3 液固质量比的影响
将材料按一定液固质量比加水调浆并预热至30℃,搅拌转速为30 r·min-1,耗时3 h匀速加完H3PO4-H2O2混合溶液。然后采用NaOH溶液将体系pH值调至3.5。其中H2O2为1.2倍反应计量、H3PO4为1.1倍反应计量。液固质量比对锂浸出率的影响如图 6所示。当液固质量比为2:1~3:1时,调浆用水越多固体颗粒分散越均匀,滴入H3PO4-H2O2混合溶液时不易结块,因此锂浸出率随液固质量比增加而提高;液固质量比越大,颗粒分散程度越高,且滴入的混合溶液稀释程度越高,因而在液固质量比大于3:1时,锂的浸出率逐渐降低,当液固质量比为5:1时,固体颗粒过于分散,锂浸出率降幅较大。因此选用液固质量比=3:1较为合适。
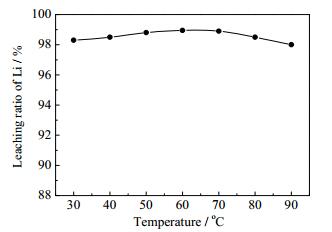
3.4 反应温度的影响
调浆液固质量比=3:1并预热至指定温度进行反应,搅拌转速为30 r·min-1,耗时3 h匀速加完H3PO4-H2O2混合溶液。采用NaOH溶液将体系pH值调至3.5。实验结果如图 7所示。由图 7可知,反应温度对锂的浸出率的影响并不明显。在30~60℃时,锂浸出率随温度升高逐渐提高;当温度高于60℃时,由于H2O2在温度过高时不稳定,还未将LiFePO4氧化就已经分解,因而锂浸出率出现了小幅下降的趋势。说明该反应在温度为30℃的条件下就有较高的反应效率且可达到较好的锂提取效果。
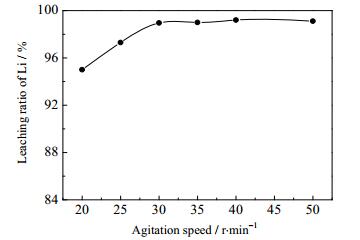
3.5 搅拌转速的影响
调浆液固质量比=3:1并预热至30℃进行反应,耗时3 h匀速加完H3PO4-H2O2混合溶液。然后加入NaOH溶液将体系pH值调至3.5,搅拌转速对锂浸出率的影响如图 8所示。在该液固反应过程中,LiFePO4在磷酸体系被氧化后将迅速生成固态FePO4∙2H2O粘附于未反应的浆料表面。若搅拌不充分,该过程将严重阻碍反应的进行。提高搅拌转速可以使反应原料与FePO4∙2H2O产物迅速分离,防止未反应浆料被FePO4∙2H2O包裹甚至产生结块现象而且可以使LiFePO4与H3PO4、H2O2的接触更加充分,反应得以迅速、平稳进行。由图 8可知,搅拌转速为20 r·min-1时,搅拌效果不佳,混合溶液滴入时有轻微结块现象;锂浸出率随搅拌转速提高,当搅拌转速为30 r·min-1时,锂浸出率提升至98.96%;继续增加搅拌转速,锂浸出率基本不变。因此30 r·min-1的搅拌转速即可达到良好的搅拌效果。
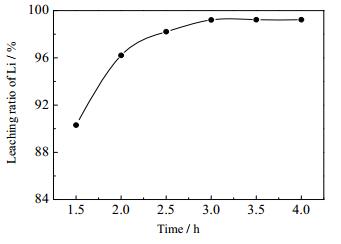
3.6 反应时间的影响
调浆液固质量比=3:1并将体系升温至30℃,搅拌转速为30 r·min-1,在指定时间内匀速加完H3PO4-H2O2混合溶液。然后加入NaOH溶液将体系pH值调至3.5,反应时间对锂浸出率的影响如图 9所示。反应时间为1.5 h时,H2O2-H3PO4混合溶液滴加速度过快,反应剧烈且不充分,浆料也有轻微结块、团球现象而无法继续反应;反应时间越长意味着H2O2-H3PO4混合溶液滴加速度越慢,反应进行得也越温和、充分。当反应耗时3 h以上时反应效果较好,锂的浸出率基本不再增长。
3.7 体系终态pH值的影响
调浆液固质量比=3:1并预热至30℃,搅拌转速为30 r·min-1,耗时3 h匀速加完H3PO4-H2O2混合溶液,然后加入NaOH溶液调节体系pH值。体系终态pH值对锂、铁分离效果的影响如表 3所示。由表 3可知,体系终态pH值在1.5~3.5时,锂浸出率变化不大,但当pH值升至4.0时,由于磷酸一氢锂不稳定,转化为磷酸二氢锂和磷酸锂,因而锂浸出率显著降低;浸出液中Fe3+的浓度随pH值升高迅速降低,与图 3所显示的趋势相符,当pH值升至3.5时降至0.01 mg·L-1,相应的铁的沉淀率达99.99%。
表 3(Tab. 3)

表 3 体系终态pH值对锂、铁分离效果的影响 Table 3 Effects of final pH value of the system on the separation of lithium and iron
| Final pH value of the system |
1.5 |
2.0 |
2.5 |
3.0 |
3.5 |
4.0 |
| Leaching ratio of Li |
99.23% |
98.98% |
99.08% |
98.91% |
99.21% |
92.55% |
| Concentration of Fe in leaching solution |
16.57 g·L-1 |
0.52 g·L-1 |
98.34 g·L-1 |
3.21 g·L-1 |
<0.01 g·L-1 |
n.d. |
|
表 3 体系终态pH值对锂、铁分离效果的影响 Table 3 Effects of final pH value of the system on the separation of lithium and iron |
3.8 锂、铁分离效果分析
在3.7节体系终态pH值为3.5组的实验中,浸出液与浸出渣成分分别列于表 4、表 5,浸出渣XRD图谱如图 10所示。由此可见,采用磷酸体系回收失效磷酸铁锂电池正极材料可达到十分理想的锂铁分离效果。浸出液可采用NaOH溶液将体系pH值调至8.0~10.0获取Li3PO4产品。沉锂母液为磷酸三钠溶液,经蒸发结晶即可得到磷酸三钠产品。浸出液也可经转型-碳化沉锂工序获取用途更加广泛的Li2CO3产品。由浸出渣成分、XRD分析结果可知,浸出渣为FePO4∙2H2O与碳粉的混合物且其中杂质金属元素的含量极低,可重新用于磷酸铁锂电池的制作。
表 4(Tab. 4)

表 4 浸出液成分 Table 4 Compositions of leaching solution
| Element types |
Li |
P |
Na |
Fe |
Mg |
K |
Cu |
Cr |
Pb |
| Concentration |
21.48 g·L-1 |
94.24 g·L-1 |
10.21 g·L-1 |
<0.01 m g·L-1 |
n.d. |
n.d. |
n.d. |
n.d. |
n.d. |
|
表 4 浸出液成分 Table 4 Compositions of leaching solution |
表 5(Tab. 5)

表 5 浸出渣成分 Table 5 Compositions of leaching residue
| Element types |
Fe |
C |
P |
Li |
Na |
K |
Mg |
Cu |
Cr |
Pb |
| Percentage/% |
29.32 |
5.51 |
16.52 |
≤0.10 |
≤0.08 |
≤0.03 |
n.d. |
n.d. |
n.d. |
n.d. |
|
表 5 浸出渣成分 Table 5 Compositions of leaching residue |
4 结论
与硝酸或硫酸体系相比,采用磷酸体系回收失效磷酸铁锂电池正极材料反应效率更高、成本更加低廉、操作更加简便、锂铁分离效果更好,而且可以实现所有元素综合利用、零废渣排放。将正极材料按液固质量比=3:1用水调浆并预热至30℃,搅拌转速为30 r·min-1。耗时3 h匀速滴完H3PO4-H2O2混合溶液,其中H2O2与H3PO4分别为1.2倍、1.1倍反应计量。然后采用NaOH溶液将体系pH值调至3.5。锂的浸出率为99.21%,铁的沉淀率为99.99%,浸出液中Fe3+浓度小于0.01 mg·L-1。浸出液为高浓度磷酸二氢锂溶液,可直接用于生产磷酸锂产品或经转型-碳化沉锂工序生产碳酸锂产品;浸出渣为杂质金属元素含量极少的FePO4∙2H2O与碳粉的混合物,可返回磷酸铁锂电池正极材料的制作。

Table
| 符号说明: |
| c(Fe3+) |
—浸出液中铁的浓度,g·L-1 |
r(Fe) |
—铁沉淀率,% |
| c(Li+) |
—浸出液中锂的浓度,g·L-1 |
[TP] |
—溶液中的总磷,mol·L-1 |
| [Fe3+]OH |
—羟基控制下的Fe3+浓度,mol·L-1 |
VL |
—浸出液体积,L |
| [Fe3+]P |
—磷酸根控制下的Fe3+浓度,mol·L-1 |
wLi |
—脱铝磷酸铁锂电池正极材料中的锂含量,% |
| [Li+]P |
—磷酸根控制下的Li+浓度,mol·L-1 |
wFe |
—脱铝磷酸铁锂电池正极材料中的铁含量,% |
| m |
—脱铝磷酸铁锂电池正极材料质量,g |
x(Li) |
—锂浸出率,% |
|
Table |
参考文献
| [1] |
Tanaka T, Ohta K, Arai N.
Year 2000 R & D status of large-scale lithium ion secondary batteries in the national project of Japan[J].
Journal of Power sources , 2001, 97(4): 2-6. |
| [2] |
Iwahori T, Mitsuishi I, Shirage S, et al.
Development of lithium ion and lithium polymer batteries for electric vehicle and home-use load leveling system application[J].
Electrochimica Acta , 2000, 45(8-9): 1509-1512. DOI:10.1016/S0013-4686(99)00366-7. |
| [3] |
Wakihara M.
Recent developments in lithium ion batteries[J].
Materials Science and Engineering R Reports , 2001, 33(4): 109-134. DOI:10.1016/S0927-796X(01)00030-4. |
| [4] |
Ritchie A G.
Recent developments and future prospects for lithium rechargeable batteries[J].
Journal of Powre Sources , 2001, 96(1): 1-4. DOI:10.1016/S0378-7753(00)00673-X. |
| [5] |
Weinstock I B.
Recent advances in the US Department of Energy's energy storage technology research and development programs for hybrid electric and electric vehicles[J].
Journal of Power Sources , 2002, 110(2): 471-474. DOI:10.1016/S0378-7753(02)00211-2. |
| [6] |
Majima M, Tada T, Ujiie S, et al.
Design and characteristics of large-scale lithium ion battery[J].
Journal of Power Sources , 1999, 81-82(3-4): 877-881. |
| [7] |
Majima M, Ujiie S, Yagasaki E, et al.
Development of 1kW·h class lithium ion battery for power storage[J].
Journal of Power Sources , 2001, 92(1-2): 108-119. DOI:10.1016/S0378-7753(00)00507-3. |
| [8] |
Zhou X F, Wang F, Zhu Y, et al.
Graphene modified LiFePO4 cathode materials for high power lithium ion batteries[J].
Journal of Materials Chemistry , 2011, 21(10): 3353-3358. DOI:10.1039/c0jm03287e. |
| [9] |
LU Qiang (卢强). Analysis and evaluation of electric vehicle power battery life cycle (电动汽车动力电池全生命周期分析与评价)[D]. Changchun (长春): Jilin University (吉林大学), 2014.
http://cdmd.cnki.com.cn/article/cdmd-10183-1014282030.htm |
| [10] |
ZHENG Ying(郑莹), LIU Yu(刘禹), DONG Chao(董超), et al.
Progress of waste lithium iron phosphate battery recycling research(废旧磷酸铁锂电池回收研究进展)[J].
Chinese Journal of Power Sources(电源技术) , 2014, 38(6): 1172-1175. |
| [11] |
LIANG Li-jun (梁立君). Study on recovery and synthesis of LiFePO4 as cathode material of waste lithium ion battery (废旧锂离子电池正极材料 LiFePO4 的回收及合成的研究) [D]. Dalian (大连): Dalian Jiaotong University (大连交通大学), 2012.
http://cdmd.cnki.com.cn/Article/CDMD-10150-1013523165.htm |
| [12] |
PAN Ying-jun (潘英俊). Recovery and reuse of waste lithium ion battery using lithium iron phosphate as cathode material (以磷酸铁锂为正极材料的废旧锂离子电池回收及再利用) [D]. Harbin (哈尔滨): Harbin Institute of Technology (哈尔滨工业大学),
2012.
http://cdmd.cnki.com.cn/Article/CDMD-10213-1013038932.htm |
| [13] |
WU Yue(吴越), PEI Feng(裴锋), JIA Lu-lu(贾蕗路), et al.
Recovery of aluminum, iron and lithium from waste lithium iron phosphate battery(从废旧磷酸铁锂电池中回收铝、铁和锂)[J].
Chinese Journal of Power Sources(电源技术) , 2014, 38(4): 629-631. |
| [14] |
BAI Xiao-yan(白晓艳), ZHANG Chao(张超), MA Xiao-li(马小利), et al.
Determination of three main elements in lithium iron phosphate by ICP-OES(ICP-OES法测定磷酸铁锂中锂铁磷的分析方法)[J].
Chinese Journal of Power Sources(电源技术) , 2015, 39(8): 1641-1642. |
| [15] |
BAI Xiao-yan(白晓艳), MA Xiao-li(马小利), YANG Rong(杨容), et al.
Analytical method of impurity elements in LiFePO4 by ICP-AES(ICP-AES法测定磷酸铁锂中杂质元素的分析方法)[J].
Chinese Journal of Power Sources(电源技术) , 2016, 40(1): 41-43. |
| [16] |
QI Mei-ling(齐美玲), ZHAO Zheng-tong(赵郑通). Quantitative analytical chemistry(定量分析化学)[M].Beijing(北京): Beijing Institute of Technology Press(北京理工大学出版社), 2009.
|
| [17] |
ZHAO Zhong-wei(赵中伟), LIU Xu-heng(刘旭恒).
Thermodynamic analysis of Li-Fe-P-H2O system(Li-Fe-P-H2O系热力学分析)[J].
Transactions of Nonferrous Metals Society of China(中国有色金属学报) , 2006, 16(7): 1257-1263. |
| [18] |
LIN Chuan-xian(林传仙), BAI Zheng-hua(白正华), ZHANG Zhe-ru(张哲儒). Handbook of thermodynamic data for minerals and related compounds(矿物及有关化合物热力学数据手册)[M].Beijing(北京): Science Press(科学出版社), 1985.
|
| [19] |
Petrucci R H(PetrucciR H), Harwood W S(HarwoodW S), Herring F G(HerringF G). General chemistry:principles and modern applications(普通化学:原理与现代应用)[M].8th ed.Beijing(北京): Higher Education Press(高等教育出版社), 2004: A25-A27.
|