目前,硝基/硝胺基取代的氮杂环(吡唑、咪唑、三唑、四唑、四嗪、呋咱等)含能化合物及高氮含能离子盐衍生物的合成及性能研究,受到世界各国含能材料研究者的重点关注[1-3],该类化合物普遍具有高的正生成热,高氮、低碳/氢含量使该类化合物容易达到氧平衡,且产气量大,分解产物主要为清洁无污染的氮气,未来在高能混合炸药、低特征信号推进剂和气体发生剂等领域具有潜在应用前景[4-5]。1, 5-二氨基四唑是一种氮、氢含量高的重要含能材料前驱体,其分子中氨基具有较强反应活性,可衍生成硝胺基、氧化偶氮基等含能基团,从而设计、合成出多种性能优异的新型高能量密度材料[6-7]。FISCHER等[8]于2015年首次设计并合成了新型高能量密度化合物-1, 5-二硝胺基四唑(DNAT),国内西安近代化学研究所[9]随后也开展了相关合成及性能研究工作。DNAT的晶体密度为1.93 g·cm-3,氮氧含量高达92.62%,理论爆速为9.41 km·s-1,理论爆压为41.9 GPa,计算生成热为486.3 kJ·mol-1,能量水平明显优于典型硝胺类含能材料奥克托金(HMX)。DNAT作为一种性能优异的新型含能化合物,未来在含能材料领域具有潜在的应用前景。然而,由于DNAT分子结构中存在的硝胺基官能团酸性较强,导致其室温易吸潮水解,长期储存稳定性较差,与火炸药配方的主要金属组分相容性较差,从而严重限制和影响了其进一步工艺放大和应用探索研究。
本文以1-甲氧基甲酰基-1, 5-二氨基四唑(MCDAT)为原料,合成出高能材料DNAT及其含能离子盐—铵盐、肼盐、羟胺盐、3, 4-二氨基呋咱盐、1, 5-二氨基四唑盐、脒基脲盐、1-羟基-5-氨基四唑盐和3, 6-二肼基四嗪盐样品,完成目标物结构表征;有效改进DNAT铵盐和肼盐的合成工艺路线,简化操作,显著提高合成收率;利用DSC方法研究目标物的热性能;采用Gaussian 09程序[10]中的CBS-4M方法和Kamlet-Jacobs爆轰方程[11]预估目标化合物的爆轰性能,为进一步性能测试及应用探索研究提供基础数据。
2 实验部分 2.1 试剂与仪器试剂:氢氧化钾、甲醇、乙腈、浓氨水(质量分数25%~28%)、水合肼(质量分数80%)、羟胺水溶液(质量分数50%)等,分析纯,成都市科龙化工试剂厂;盐酸(2 mol·L-1)、1-甲氧基甲酰基-1, 5-二氨基四唑(MCDAT)[9]、五氧化二氮、3, 4-二氨基呋咱、1, 5-二氨基四唑、脒基脲硝酸盐、1-羟基-5-氨基四唑、3, 6-二肼基四嗪, 均为实验室自制。
仪器:美国Nicolet公司NEXUS 870型傅里叶变换红外光谱仪;瑞士BRUKER公司AV 500型超导核磁共振仪;德国Elementar公司Vario EL Ⅲ型自动微量有机元素分析仪;德国Netzsch公司DSC-204差示扫描量热仪。
2.2 合成路线以MCDAT为原料,经硝解、酸化、中和、复分解等反应制备了DNAT及其有机含能离子盐,合成路线见图 1。
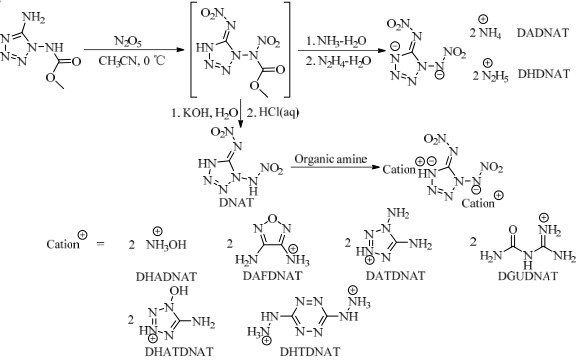
|
图 1 DNAT及其含能离子盐的合成路线 Fig.1 Synthetic routes of DNAT and its energetic ion salts |
搅拌下,将0.55 g (3.5 mmol) MCDAT分散到10.5 mL无水乙腈中,在0 ℃加入10.5 mL含1.13 g (10.5 mmol)五氧化二氮乙腈溶液,加完后0~5 ℃反应1 h,然后加入2.83 g (21.0 mmol)质量分数为25%~28%的氨水溶液反应1 h,过滤,滤饼经冰水洗、甲醇洗、干燥得1, 5-二硝胺基四唑二铵盐0.49 g,收率为62.5%。1H-NMR (DMSO-d6, 500 MHz), δ: 7.24(s, 8H, 2NH4+);13C-NMR (DMSO-d6, 125 MHz), δ : 154.23;IR (KBr) ν (cm-1): 3 178, 1 509, 1 403, 1 357, 1 290, 1 279, 1 227, 1 097, 1 032, 911, 855;Anal. Calcd. for CH8N10O4 (%): C 5.36, H 3.60, N 62.49;found C 5.45, H 3.56, N 62.41。
2.3.2 DHDNAT的合成冰水浴下,将0.55 g (3.5 mmol) MCDAT分散到10.5 mL无水乙腈中,在0 ℃加入11.0 mL含1.13 g (10.5 mmol)五氧化二氮乙腈溶液,加完后0~5 ℃反应1 h,然后加入1.31 g (21.0 mmol)水合肼溶液反应1 h,过滤,滤饼经冰水洗、甲醇洗、干燥得1, 5-二硝胺基四唑二肼盐0.52 g,收率为58.5%。1H-NMR (DMSO-d6, 500 MHz), δ: 7.13(s, 10H, 2N2H5+);13C-NMR (DMSO-d6, 125 MHz), δ: 154.16;IR (KBr) ν (cm-1): 3 244, 3 140, 3 035, 2 981, 2 697, 1 576, 1 507, 1 439, 1 412, 1 357, 1 301, 1 238, 1 100, 1 083, 1 035, 964;Anal. Calcd. for CH10N12O4(%): C 4.73, H 3.97, N 66.13; found C 4.79, H 3.93, N 66.21。
2.3.3 DNAT的合成将2.21 g (14.0 mmol) MCDAT加入42.0 mL乙腈中,冰水浴冷却至0~5 ℃,滴加42.0 mL含4.54 g (42.0 mmol)五氧化二氮的乙腈溶液,加完后在0~5 ℃反应1 h,然后加入42.0 mL含4.7 g (84.0 mmol)氢氧化钾的水溶液,继续搅拌0.5 h,减压蒸出溶剂得淡黄色固体;将上述淡黄色固体加入70.0 mL甲醇中搅拌2 h,过滤、自然风干得白色固体;将上述白色固体加入到44.0 mL 2.0 mol·L-1的盐酸中搅拌0.5 h,用乙酸乙酯萃取(40 mL×4),无水硫酸镁干燥,减压蒸出乙酸乙酯得2.11 g白色固体,收率为79.3%。1H-NMR (DMSO-d6, 500 MHz), δ: 12.22 (s, 2H, 2NH);13C-NMR (DMSO-d6, 125 MHz), δ: 147.60;IR (KBr) ν (cm-1): 3 205, 3 144, 1 596, 1 579, 1 508, 1 476, 1 453, 1 413, 1 332, 1 287, 1 245, 1 058, 1 037, 987, 844;Anal. Calcd. for CH2N8O4 (%): C 6.32, H 1.06, N 58.95; found C 6.44, H 1.16, N 59.09。
2.3.4 DHADNAT的合成室温下,将0.19 g (1.0 mmol) DNAT、3.0 mL甲醇加入反应瓶中,搅拌溶解,冰水浴冷却至0~5 ℃,滴加0.14 g羟胺水溶液(质量分数为50%),在此温度下反应0.5 h,过滤,滤饼经冰甲醇洗、干燥得0.22 g白色固体,收率为85.9%。1H-NMR (DMSO-d6, 500 MHz), δ: 8.82(s, 8H, 2NH3+OH);13C-NMR (DMSO-d6, 125 MHz), δ: 154.12;IR (KBr) ν (cm-1): 3 223, 3 073, 2 695, 1 595, 1 508, 1 432, 1 411, 1 359, 1 302, 1 239, 1 192, 1 099, 1 035, 1 006, 913, 859, 778;Anal. Calcd. for CH8N10O6 (%): C 4.69, H 3.15, N 54.68; found C 4.72, H 3.07, N 54.75。
2.3.5 DAFDNAT的合成室温下,将0.095 g (0.5 mmol) DNAT、2.0 mL甲醇加入反应瓶中,搅拌10 min后加入0.1 g (1.0 mmol) 3, 4-二氨基呋咱,升温至35 ℃反应1.5 h,冷却、蒸除溶剂,加入乙醚搅拌,过滤、干燥得0.15 g米色固体,收率为76.9%。1H-NMR (DMSO-d6, 500 MHz), δ: 5.80 (s, 10H, 2AFH+);13C-NMR (DMSO-d6, 125 MHz), δ: 148.26, 150.18;IR(KBr) ν (cm-1): 3 437, 3 322, 3 261, 3 198, 1 646, 1 508, 14 75, 1 352;Anal. Calcd. for C5H10N16O6 (%): C 15.39, H 2.58, N 57.43; found C 15.45, H 2.53, N 57.49。
2.3.6 DATDNAT的合成室温下,将0.19 g (1.0 mmol) DNAT、3.0 mL甲醇加入反应瓶中,冰水浴冷却下加入0.2 g (2.0 mmol) 1, 5-二氨基四唑,升温至40 ℃反应2 h,过滤、干燥得0.28 g淡黄色固体,收率为71.9%。1H-NMR (DMSO-d6, 500 MHz), δ: 6.37(s, 10H, 2DATH+);13C-NMR (DMSO-d6, 125 MHz), δ: 154.89;IR (KBr) ν (cm-1): 3 326, 3 238, 3 153, 1 656, 1 577, 1 470, 1 329, 1 109, 1 077, 1 002;Anal. Calcd. for C3H10N20O4 (%): C 9.23, H 2.58, N 71.78; found C 9.31, H 2.53, N 71.83。
2.3.7 DGUDNAT的合成室温下,将0.33 g (2.0 mmol)脒基脲硝酸盐、2.5 mL甲醇、4.5 mL水加入反应瓶中,搅拌溶解后,滴加2.0 mL含0.112 g (2.0 mmol)氢氧化钾的甲醇溶液,加完后搅拌10 min,继续加入0.19 g (1.0 mmol) DNAT,升温至35 ℃反应1.5 h,冰水浴冷却、过滤、干燥得0.32 g淡黄色固体,收率为81.2%。1H-NMR (DMSO-d6, 500 MHz), δ: 7.20 (s, 4H, 2NH2+), 8.13 (s, 8H, 4NH2), 9.76 (s, 2H, 2NH);13C-NMR (DMSO-d6, 125 MHz), δ: 154.08, 154.85, 155.86;IR (KBr) ν(cm-1): 3 416, 3 192, 1 765, 1 753, 1 703, 1 685, 1 641, 1 594, 1 506, 1 438, 1 329, 1 284, 1 091, 1 027, 922;Anal. Calcd. for C5H14N16O6 (%): C 15.23, H 3.58, N 56.84; found C 15.31, H 3.52, N 56.91。
2.3.8 DHATDNAT的合成室温下,将0.19 g (1.0 mmol) DNAT、3.0 mL甲醇加入反应瓶中,搅拌10 min后加入0.202 g (2.0 mmol) 5-氨基-1-羟基四唑,升温至50 ℃反应2 h,冷却、过滤除去不溶物,蒸除溶剂、干燥得0.34 g淡黄色固体,收率为71.9%。1H-NMR (DMSO-d6, 500 MHz), δ: 6.67 (s, 4H, 2NH2), 12.83 (s, 2H, 2OH);13C-NMR (DMSO-d6, 125 MHz), δ: 150.44, 153.99;IR(KBr) ν (cm-1): 3 410, 3 334, 3 191, 2 443, 1 674, 1 546, 1 335, 1 320, 1 277, 1 125, 1 068, 961;Anal. Calcd. for C3H8N18O6 (%): C 9.19, H 2.06, N 64.28; found C 9.24, H 1.97, N 64.35。
2.3.9 DHTDNAT的合成室温下,将0.095 g (0.5 mmol) DNAT、3.0 mL甲醇加入反应瓶中,搅拌10 min后加入0.071 g (0.5 mmol) 3, 6-二肼基四嗪,升温至45 ℃反应1.5 h,冷却、蒸除溶剂、干燥得0.15 g桔红色固体,收率为90.4%。1H-NMR (DMSO-d6, 500 MHz), δ: 10.01 (s, 8H, DHT2+);13C-NMR (DMSO-d6, 125 MHz), δ: 149.14, 162.11;IR(KBr) ν(cm-1): 3 427, 3 225, 1 691, 1 585, 1 551, 1 504, 1 379, 1 327, 1 281;Anal. Calcd. for C3H8N16O4 (%):C 10.85, H 2.43, N 67.46; found C 10.93, H 2.38, N 67.53。
3 结果与讨论 3.1 目标物的合成 3.1.1 DNAT及其含能离子盐的合成DNAT是一种新型高能硝胺含能化合物,本文以MCDAT为原料,经硝解、碱解、酸化等反应合成了DNAT,利用DNAT分子中的酸性氢与有机胺反应,成功合成出羟胺盐、3, 4-二氨基呋咱盐、1, 5-二氨基四唑盐、脒基脲盐、1-羟基-5-氨基四唑盐、3, 6-二肼基四嗪盐等6种DNAT含能离子盐,表征了化合物结构;1H-NMR谱中,大部分含能离子盐出现活泼氢,且发生质子交换,表现为较宽的单峰,13C-NMR谱中出现了DNAT2-的特征峰:δ 154×10-6左右的峰为DNAT2-的C信号。
3.1.2 DADNAT和DHDNAT合成方法改进文献[8]报道DADNAT和DHDNAT的合成过程主要为:在冰水浴冷却条件下,将MCDAT分散到无水乙腈中,在0 ℃与五氧化二氮的乙腈溶液发生硝解反应,然后加入氢氧化钾水溶液进行碱解反应得到1, 5-二硝胺基四唑二钾盐(DKDNAT),DKDNAT在盐酸水溶液中酸化生成1, 5-二硝胺基四唑(DNAT),最后分别与氨水、水合肼发生中和反应得到1, 5-二硝氨基四唑铵盐(DADNAT)和肼盐(DHDNAT),合成路线如图 2所示。该方法需要经硝解、碱解、酸化、复分解等4步反应才能得到DADNAT和DHDNAT,产物总收率均为42.5%,操作步骤较多、总收率较低。
本文对DADNAT和DHDNAT的合成工艺进行了改进,以MCDAT原料,经硝解、氨解/肼解等两步操作成功制备了DADNAT和DHDNAT,产物总收率分别为62.5%和58.5%,操作步骤较少、过程危险性较低、总收率较高,合成路线如图 3所示。
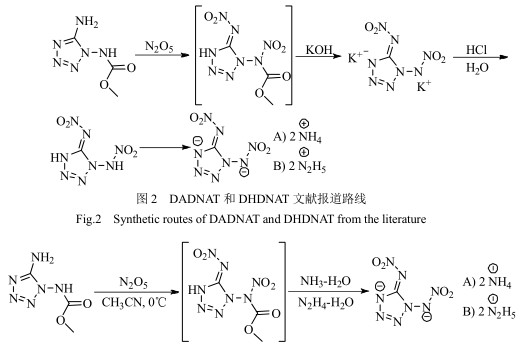
|
图 3 DADNAT和DHDNAT的改进合成路线 Fig.3 Improved synthetic routes of DADNAT and DHDNAT |
采用DSC方法对DNAT及8种含能离子盐的热稳定性进行了分析(实验条件:动态氮气气氛,压力为0.1 MPa,温度25~500 ℃,升温速率5 ℃·min-1,试样量0.5 ~1.0 mg,试样皿为铝盘),实验结果如图 4所示。
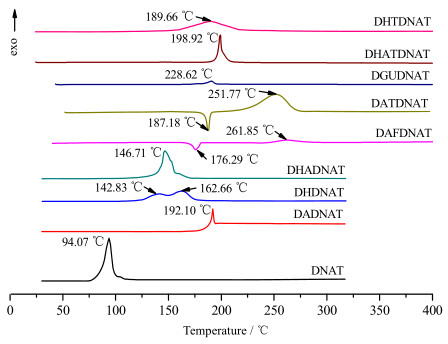
|
图 4 DNAT及其含能离子盐的DSC曲线 Fig.4 DSC curves of DNAT and its energetic ion salts |
从图 4中化合物的热分解曲线可以看出,含能离子盐DAFDNAT和DATDNAT分别存在一个明显的吸热熔化峰和一个放热分解峰,其中吸热熔化峰即为该化合物的熔点,分别为176.29和187.18 ℃,放热分解峰分别为261.85和251.77 ℃,表明上述两种化合物首先经历吸热熔化的相变过程过程,然后才发生热分解;而DNAT及其含能离子盐DADNAT、DHDNAT、DHADNAT、DGUDNAT、DHATDNAT和DHTDNAT,都没有吸热熔化峰,只存在放热分解峰,表明这些化合物的热分解没有经历吸热熔化的相变过程,而是固相直接热分解,热分解峰温依次为94.07、192.10、142.83、146.71、228.62、198.92和189.66 ℃,结果显示,8种含能离子盐较母体化合物DNAT具有更高的热分解温度,表现出更好的热稳定性。由此可见,将分子中含酸性氢的高能材料衍生成相应的含能离子盐,从而使化合物具有丰富的分子内或者分子间氢键,有望显著降低化合物酸性,进一步提高化合物的热稳定性。
3.3 DNAT及其含能离子盐的爆轰性能DNAT及其含能离子盐是一类淡黄色至黄褐色固体,可溶于二甲亚砜、二甲基甲酰胺等。采用Gaussian 09程序的密度泛函理论(DFT),获得B3LYP/6-31G**水平下目标物稳定优化构型,利用Monte-Carlo法[12]和CBS-4M方法[13]分别计算了所有化合物的密度和生成热;基于密度和生成热,利用Kamlet-Jacobs方程[10]预估了DNAT及其含能离子盐的爆轰性能,DNAT及其含能离子盐、TNT、RDX、HMX的性能对比见表 1。
|
|
表 1 DNAT及其含能离子盐的性能 Table 1 Properties of DNAT and its energetic ion salts |
由表 1实验结果可以看出,DNAT及其含能离子盐的固相生成热普遍较高,介于212.0~1 331.3 kJ·mol-1,其中1, 5-二氨基四唑盐具有最高固相生成热1 331.3 kJ·mol-1,远远高于常用硝胺炸药RDX (92.6 kJ·mol-1)和HMX (104.8 kJ·mol-1);DNAT及羟胺盐的爆速、爆压和爆热等性能均明显优于HMX,表现出优异的能量水平;而其余含能离子盐的爆轰性能大多优于或相当于RDX。因此,DNAT及其含能离子盐有望作为一类新型高能量密度材料应用于火炸药配方,显著改善配方的综合性能。
4 结论(1) 以1-甲氧基甲酰基-1, 5-二氨基四唑为原料,合成了DNAT及其8种含能离子盐,改进了DNAT的铵盐和肼盐的合成工艺,表征了目标化合物的结构。
(2) 采用DSC方法对目标化合物的热性能进行了研究,结果表明,含能离子盐较母体化合物DNAT具有更好的热稳定性。
(3) DNAT及其含能离子盐的固相生成热介于212.0~1 331.3 kJ·mol-1,远远高于硝胺炸药RDX (92.6 kJ·mol-1)和HMX (104.8 kJ·mol-1)。
(4) DNAT及其羟胺盐的爆速、爆压和爆热等爆轰性能均明显优于HMX,表现出优异的能量水平,有望作为一类新型高能量密度材料应用于含能材料配方。
| [1] |
GAO H, SHREEVE J M. Azole-based energetic salts[J]. Chemical Reviews, 2011, 111(11): 7377-7436. DOI:10.1021/cr200039c |
| [2] |
ZHANG Q, SHREEVE J M. Energetic ionic liquids as explosives and propellant fuels:A new journey of ionic liquid chemistry[J]. Chemical Reviews, 2014, 114(20): 10527-10574. DOI:10.1021/cr500364t |
| [3] |
黄晓川, 郭涛, 刘敏, 等. 联唑类含能化合物及其含能离子盐研究进展[J]. 含能材料, 2015, 23(3): 291-301. HUANG X C, GUO T, LIU M, et al. Review on bis-azoles and its energetic ion derivatives[J]. Chinese Journal of Energetic Materials (Hanneng Cailiao), 2015, 23(3): 291-301. |
| [4] |
FISCHER N, IZSÁK D, KLAPÖTKE T M, et al. The chemistry of 5-(tetrazol-1-yl)-2H-tetrazole:An extensive study of structural and energetic properties[J]. Chemistry-A European Journal, 2013, 19(27): 8948-8957. DOI:10.1002/chem.201300691 |
| [5] |
DIOPPOLD A A, KLAPÖTKE T M, OSWALD M. Asymmetrically substituted 5, 5'-bistriazoles-nitrogen rich materials with various energetic functionalities[J]. Dalton Transactions, 2013, 42(31): 11136-11145. DOI:10.1039/c3dt51205c |
| [6] |
TANG Y, YANG H, WU B, et al. Synthesis and characterization of a stable, catenated N11 energetic salt[J]. Angewandte Chemie International Edition, 2013, 52(18): 4875-4877. DOI:10.1002/anie.201300117 |
| [7] |
GÖBEL M, KLAPÖTKE T M. Development and testing of energetic materials:The concept of high densities based on the trinitroethyl functionality[J]. Advance Functional Materials, 2009, 19(3): 347-365. DOI:10.1002/adfm.200801389 |
| [8] |
FISCHER D, KLAPÖTKE T M, STIERSTORFER J. 1, 5-di(nitramino)tetrazole:High sensitivity and superior explosive performance[J]. Angewandte Chemie International Edition, 2015, 54(35): 10299-10302. DOI:10.1002/anie.201502919 |
| [9] |
LI Y N, BI F Q, WANG B Z, et al. Synthesis and properties of high energy materials based on 1, 5-di(nitramino)tetrazole[J]. Chinese Journal of Explosives & Propellants, 2015, 38(6): 16-20. |
| [10] |
FRISCH M J, TRUCKS G W, SCHLEGEL H B, et al. Gaussian 09, Gaussian, Inc.[C], Wallingford CT, 2009.
|
| [11] |
KAMLET M J, JACOBS S J. Chemistry of detonation I. A simple method for calculating detonation properties of CHNO explosives[J]. Journal of Chemistry Physical, 1968, 48(1): 23-35. DOI:10.1063/1.1667908 |
| [12] |
RICE B M, HARE J J, BYRD E F E. Accurate predictions of crystal densities using quantum mechanical molecular volumes[J]. Journal of Chemistry Physical A, 2007, 111(42): 10874-10879. DOI:10.1021/jp073117j |
| [13] |
MONTGOMERY J A, FRISCH M J, OCHTERSKI J W, et al. A complete basis set model chemistry Ⅶ. use of the minimum population localization method[J]. Journal of Chemistry Physical, 2000, 112(15): 6532-6542. DOI:10.1063/1.481224 |




