2. 安徽六国化工股份有限公司,安徽 铜陵 244000
2. Anhui Liuguo Limited Liability Company, Tongling 244000, China
CaSO4·2H2O广泛存在于油气生产、湿法烟气脱硫和磷酸浸提等化工产业,是一种工业废料,但其转化为α-CaSO4·0.5H2O后是一种高附价值的资源。有研究表明,高长径比的α-CaSO4·0.5H2O抗压强度达到37.6 MPa[1],可以用作高分子和陶瓷中作为强化材料。低长径比的α-CaSO4·0.5H2O颗粒水化后可作药物载体[2],具备优良的可注射性[3]。
KONG等[4]研究添加晶种、调配结晶温度[5]、过饱和度[6]和改变体系pH值[7]等方法制备可控长径比的α-CaSO4·0.5H2O。在α-CaSO4·0.5H2O晶体自发成核和晶体生长过程中,羧基类物质如丙二酸二钠、琥珀酸二钠、乙二胺四乙酸二钠等,释放出大量的羧基会络合溶液中的钙离子,对晶体新相的成核速率生长具有强烈的阻滞作用,抑制HH的生长[8-10]。
BOSBACH等[11]研究工作证明了微量的柠檬酸盐会吸附在晶体特定晶面的活性位点上,或与金属阳离子络合形成表面共沉淀[12-13],延缓新相的产生。LANZÓN等[14]发现柠檬酸会在结晶体系中电离出柠檬酸根,抑制α-CaSO4·0.5H2O水化为CaSO4·2H2O的过程,其形貌和机械形貌产生较大差异。Saha等[15]利用TR-cryo-TEM技术发现,柠檬酸通过其羧基与钙离子形成无序的非晶相抑制了CaSO4·2H2O的成核与生长。但以上研究柠檬酸对α-CaSO4·0.5H2O结晶影响,缺少对其结晶过程如转化速率、相应诱导时间和生长周期等定量描述。CHEN等[16]和TIAN等[17]发现NH4+会与溶液中可溶性离子通过复杂的相互作用促进CaSO4·2H2O的溶解,减少了向α-CaSO4·0.5H2O的转化时间。
本文选用C6H17N3O7作为α-CaSO4·0.5H2O形貌控制剂,以CaSO4·2H2O为原料,研究其对晶体形貌和结晶过程的影响。
2 实验(材料与方法) 2.1 实验材料与仪器 2.1.1 实验材料CaSO4·2H2O,AR;C6H17N3O7,AR;国药集团药业股份有限公司;去离子水,实验室自制。
2.1.2 实验仪器威海自控反应釜有限公司产WHF-0.5型高压反应釜(釜体500 mL,内径65 mm,内置有长薄叶螺旋桨式搅拌桨、蛇形冷凝管、温度感应器,外置泄压阀和取样阀);昆山市超声仪器有限公司产KQ3200DE型数控超声波清洗器;上海三发科学仪器有限公司产DZF-6050型真空干燥箱。
2.2 实验方法称量CaSO4·2H2O与去离子水混合,预热至55 ℃后,将一定量的C6H17N3O7溶于混合浆液,分别制成试样B和试样C,控制搅拌速率60 r·min-1,加热速率2.5 ℃·min-1升温至130 ℃,反应2 h,取样趁热过滤。过滤所得的样品用无水乙醇洗涤后,放置真空干燥箱内45℃干燥8 h,制得样品用于测试与表征。
试样A表示溶液中不添加C6H17N3O7;试样B表示溶液中C6H17N3O7浓度为2.0×10-4 mol·L-1;试样C表示溶液中C6H17N3O7浓度为2.0×10-3 mol·L-1。
2.3 测试和表征方法采用X射线衍射仪(XRD,X'Pert PRO MPD,荷兰帕纳科公司)测试样品相态组成;采用傅里叶红外光谱仪(FT-IR,Nicolet 67,美国尼高力仪器公司)分析样品特征基团;采用X射线光电子能谱测定元素结合能(XPS,ESCALAB250Xi,美国赛默飞世尔科技公司);采用场发射扫描电子显微镜(SEM,SU8020型,日本株式会社日立制作所)和场发射透射电子显微镜(TEM,JEM-2100F型,日本株式会社日立制作所)表征样品微观形貌和组成;采用热重分析仪(TG,STA449F3,德国耐驰仪器制造有限公司)测定α-CaSO4·0.5H2O的结晶水含量和生长速率;采用差热示差扫描量热仪(DSC,Q2000,美国TA公司)测定样品的热稳定性;采用原子吸收分光光度法(AAS,AA-6300C,日本岛津公司)测定溶液中Ca2+浓度;采用氯化钡重量法[GB/T]测定SO42-的浓度;过饱和度利用S=[Ca2+][SO42-]/Ksp计算[18]。
3 实验结果与讨论 3.1 α-CaSO4·0.5H2O转化热力学平衡分析使用HSC 6.0软件计算在130 ℃水热条件下所涉及的热力学反应热力学参数,如表 1所示。(NH4)2SO4、Ca(OH)+、Ca(OH)2和HSO4-为130 ℃水热条件稳定存在的可溶性产物,因为他们的Ksp分别为100.14、102.51、104.44和103.48,且ΔG均 < 0。α-CaSO4·0.5H2O的生成是溶解再结晶的过程,可溶性Ca2+ (包括Ca2+、Ca(OH)+和Ca(OH)2)和SO42- (SO42-、(NH4)2SO4、NH4HSO4和H2SO4)浓度发生了改变,上述的反应影响了CaSO4·2H2O溶解平衡,所以会促进CaSO4·2H2O的溶解[16]。
|
|
表 1 热力学平衡反应 Table 1 Thermodynamic equilibrium reactions |
表 2为柠檬酸铵在185 ℃的物化性质,柠檬酸铵可能会裂解生成异丙醇,对结晶体系的液相萃取,使用GC-MS检测柠檬酸铵是否分解产生异丙醇,体系中未检测到异丙醇的特征峰,表明在0.27 MPa和130 ℃的反应条件下柠檬酸铵只能出柠檬酸根阴离子。
|
|
表 2 柠檬酸铵的物化性质 Table 2 Physicochemical properties of ammonium citrate |
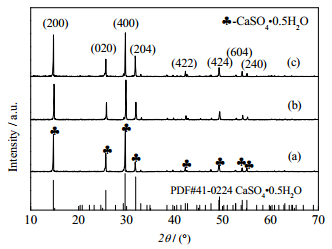
如图 1所示为不同试样的XRD图谱。不同试样产物的XRD特征衍射峰与α-CaSO4·0.5H2O标准PDF卡片特征峰(PDF#41-0224)相对应,硫酸钙的晶型均为α-CaSO4·0.5H2O。
|
图 1 不同C6H17N3O7浓度下产物的XRD图 Fig.1 XRD patterns of products prepared with different concentrations of C6H17N3O7 |
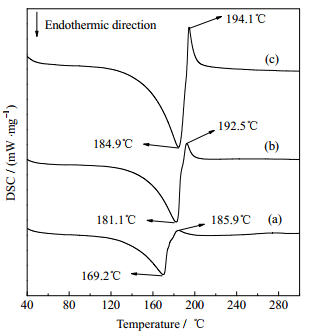
如图 2所示为不同试样的α-CaSO4·0.5H2O的DSC曲线。试样A的DSC曲线在169.2 ℃产生现吸热峰,对应α-CaSO4·0.5H2O脱除H2O的吸热峰值[6]。样品在185.9 ℃处产生尖锐放热峰,表明硫酸钙在测试过程中转变为热力学更稳定的晶型[19]。试样B在181.1 ℃处产生吸热峰,在192.5 ℃处产生放热峰;试样C在184.9 ℃处产生吸热峰,在194.1 ℃处产生放热峰,较试样A和试样B峰值均有所升高,表明C6H17N3O7添加剂可提高α-CaSO4·0.5H2O的热稳定性。
|
图 2 不同C6H17N3O7浓度下制备α-CaSO4·0.5H2O的DSC曲线 Fig.2 DSC curves of α-CaSO4·0.5H2O prepared with different concentrations of C6H17N3O7 (a) sample A (b) sample B (c) sample C |
如图 3所示为不同试样的SEM和TEM照片。由图 3(a)~(c)可见,不同浓度C6H17N3O7对制备出的α-CaSO4·0.5H2O形貌影响较大。添加浓度提高,α-CaSO4·0.5H2O由针状向柱状转变。其中图 3(d),3(e)和3(f)分别为添加2.0×10-3 mol·L-1 C6H17N3O7下α-CaSO4·0.5H2O晶体的高分辨透射电子显微镜(HRTEM)、电子光斑衍射(SEAD) (图 3(d)中小图)、TEM和X射线能谱仪探测仪(EDS)图。经计算,图 3(d)中晶格条纹的晶格间隙为0.599 nm,该数值对应α-CaSO4·0.5H2O(001)晶面的晶格间隙数值,表明晶体沿(001)晶面方向生长。SEAD图显示制备的晶体为单晶,EDS结果显示Ca、S和O原子比为1:1.1:4.8,接近1:1:4.5,表明晶体为α-CaSO4·0.5H2O。相应的长径比见表 3。

|
图 3 不同C6H17N3O7浓度下制备α-CaSO4·0.5H2O的SEM图和TEM图 Fig.3 SEM and TEM micrographs of α-CaSO4·0.5H2O prepared with different concentrations of C6H17N3O7 SEM: (a) sample A (b) sample B (c) sample C TEM: (d, e, f)-sample C |
|
|
表 3 不同C6H17N3O7浓度下制备α-CaSO4·0.5H2O的形貌和长径比 Table 3 Morphology and aspect ratios of α-CaSO4·0.5H2O prepared with different concentrations of C6H17N3O7 |
随着溶液中C6H17N3O7浓度逐渐增大,α- CaSO4·0.5H2O晶体的长度降低、直径增大,长径比减小,当添加2.0×10-3 mol·L-1 C6H17N3O7时,α-CaSO4·0.5H2O晶体的长径比接近2:1,说明C6H17N3O7对α-CaSO4·0.5H2O沿c轴方向的生长有明显的抑制作用,控制晶体长轴的生长速率接近短轴的生长速率。
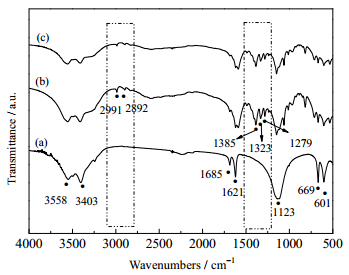
如图 4所示为不同试样的红外光谱图。样品在3 558和3 403 cm−1处出现吸收宽峰,对应α-CaSO4·0.5H2O结晶水和表面羟基的特征峰[20],1 685和1 621 cm−1处对应α-CaSO4·0.5H2O中SO42-的γ1伸缩振动峰[20],1 123 cm−1处对应SO42-的γ3伸缩振动峰,669和601 cm−1处对应SO42-的γ4伸缩振动峰[21]。
|
图 4 不同C6H17N3O7浓度下制备α-CaSO4·0.5H2O的红外图谱 Fig.4 Infrared spectra of α-CaSO4·0.5H2O prepared with different concentrations of C6H17N3O7 (a) sample A (b) sample B (c) sample C |
对比无添加C6H17N3O7的α-CaSO4·0.5H2O的FT-IR全谱图,CaSO4·2H2O本身特征基团未发生变化,但(b)和(c)在2 991,2 892 cm−1处产生了─CH2─的不对称和对称伸缩振动峰[21],(b)和(c)在1 385、1 323和1 279 cm−1附近出现新的吸收峰,对应RCOO−在1 320~1 210 cm−1处的C─O伸缩振动[1],表明样品中存在RCOO-,这些变化表明柠檬酸根结合α-CaSO4·0.5H2O中Ca2+的活性位点,影响到红外光谱吸收峰。
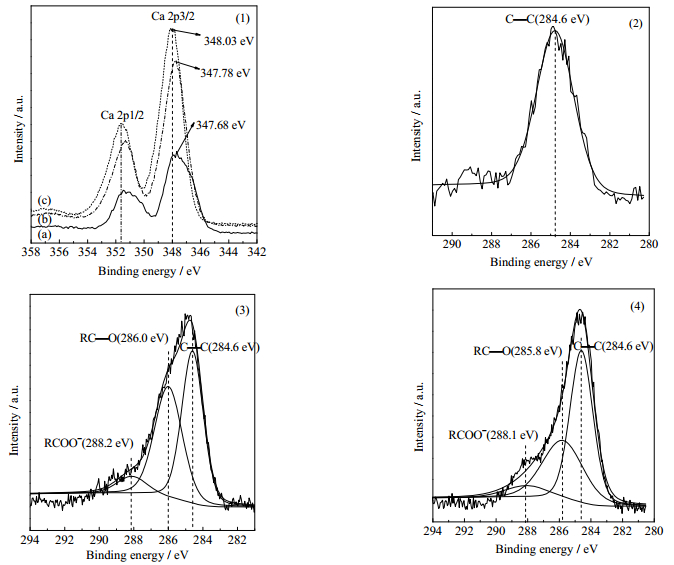
如图 5所示为不同浓度C6H17N3O7下制备的α-CaSO4·0.5H2O的XPS图谱。图 5(1)中Ca 2p3/2结合能随添加C6H17N3O7浓度提高而增大,表明硫酸钙晶格中Ca2+周围的化学氛围发生了改变。图 5(2)显示试样A中碳谱(C 1s)结合能为284.6 eV,和背景标准值一致。图 5(3)表明试样B的C 1s的结合能,除284.6 eV外,还出现了两处结合能较高的谱峰,分别是286.0 eV对应的RC─O和288.2 eV对应的RCOO- [22],表明羧酸根与α-CaSO4·0.5H2O表面Ca2+发生了络合作用。图 5(4)显示试样C,C 1s的结合能除284.6 eV外,还产生了285.8和288.1 eV两处结合能谱峰,分别对应RC─O和RCOO-谱峰,此现象与图 5(3)相似。XPS图谱表明α-CaSO4·0.5H2O表面的Ca2+活性位点与柠檬酸根发生络合,影响了C 1s谱峰。
|
图 5 不同C6H17N3O7浓度下制备α-CaSO4·0.5H2O的XPS图谱 Fig.5 XPS spectra of α-CaSO4·0.5H2O prepared with different concentrations of C6H17N3O7 (1) Ca 2p (2) C 1s-sample A (3) C 1s-sample B (4) C 1s-sample C |
如表 4所示为不同试样产物表面的元素组成。表 4显示随着添加C6H17N3O7浓度的提高,α-CaSO4·0.5H2O表面氧硫比(O/S)从3.87增加到4.05,再增加到4.09,说明C6H17N3O7的柠檬酸根已经络合α-CaSO4·0.5H2O表面的Ca2+,使得在α-CaSO4·0.5H2O表面上引入额外的O原子,导致O/S比值的提高。
|
|
表 4 不同C6H17N3O7浓度下制备α-CaSO4•0.5H2O 晶体表面的元素组成 Table 4 Surface elemental composition of α-CaSO4•0.5H2O prepared with different concentrations of C6H17N3O7 |
如图 6所示为不同试样的α-CaSO4·0.5H2O生长速率[7]。图 6(1)表明随着添加C6H17N3O7浓度的提高,CaSO4·2H2O向α-CaSO4·0.5H2O转化的时间逐渐变长;图 6(2)表明α-CaSO4·0.5H2O的生长周期(即转化时间)从45 min增加到65 min,再增加到120 min;诱导时间从10 min增加到20 min,再增加到40 min。C6H17N3O7抑制了CaSO4·2H2O向α-CaSO4·0.5H2O转化,且随浓度增大,抑制效果加强。此现象与Chen [16]的研究结果相悖,反应体系中同时存在柠檬酸根和NH4+时,柠檬酸根抑制效应大于NH4+促进效应,故总体表现出C6H17N3O7延缓了CaSO4·2H2O向α- CaSO4·0.5H2O的转化。
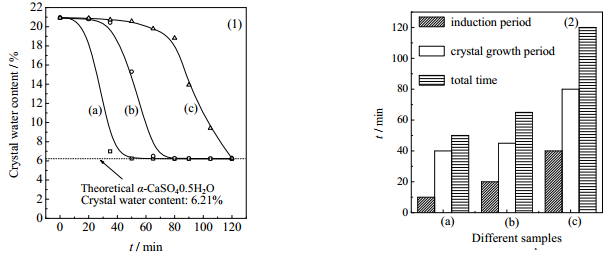
|
图 6 不同C6H17N3O7浓度时CaSO4·2H2O向α-CaSO4·0.5H2O转化速率图(1)和相应诱导时间、生长时间和生长周期图(2) Fig.6 Conversion (1) and induction time, growth and growing cycle (2) of CaSO4·2H2O to α-CaSO4·0.5H2O under different concentrations of C6H17N3O7 (a) sample A (B) sample B (C) sample C |
如表 5所示为不同试样溶液中Ca2+浓度、SO42-浓度和过饱和度值(S)。在试样A条件下,反应溶液中Ca2+浓度与SO42-浓度较高,故过饱和度值S也较高。在试样B和C时,Ca2+浓度与SO42-浓度接近,均低于试样A的浓度值,致使S值下降。根据成核速率公式,结晶体系过饱和度值降低,会减缓晶体成核速率和生长速率,提高晶体表面产生二次成核的概率,即在结晶体系中已生成的晶体周围产生新的晶核,新晶核的出现减缓原有晶体的生长[23],此现象与图 3(b)相符;当结晶体系中过饱和度值提高,会增快晶体的成核速率与生长速率,降低晶体表面产生二次成核的概率,缩短晶体生长时间,晶体的长径比增大[23],减弱了晶体表面的粘附现象(图 3(a))。在结晶体系中,柠檬酸根会和溶液中Ca2+发生络合,致使结晶过饱和度值下降而抑制成核。
|
|
表 5 不同试样溶液中的成分及过饱和度 Table 5 Composition and supersaturation degrees of solutions |
如表 6所示为α-CaSO4·0.5H2O相关晶面Ca2+和SO42-的分布及比例。从表 6中可以看出,(001)晶面Ca:SO4最大,Ca2+分布密度相对较大,具有更高的活性位点,柠檬酸根会优先络合在(001)晶面,致使(001)晶面的生长受到强烈地抑制,长短轴的相对生长速率发生了改变,α-CaSO4·0.5H2O晶体由针状的形貌,转变为短柱状的形貌,其影响机制如图 7所示。
|
|
表 6 α-CaSO4·0.5H2O相关晶面Ca2+和SO42-的分布[20] Table 6 Distribution of Ca2+ and SO42– on facets of α-CaSO4·0.5H2O crystals |

|
图 7 C6H17N3O7控制α-CaSO4·0.5H2O生长示意图 Fig.7 Schematic diagram of α-CaSO4·0.5H2O crystal growth controlled by C6H17N3O7 |
当添加C6H17N3O7浓度为2.0×10-3 mol·L-1时,可以制备出长径比为2:1的α-CaSO4·0.5H2O晶体;C6H17N3O7的添加可提高制备出α-CaSO4·0.5H2O的热稳定性;柠檬酸根会和α-CaSO4·0.5H2O中Ca2+的活性位点结合,并降低体系中α-CaSO4·0.5H2O的过饱和度,有效地抑制了α-CaSO4·0.5H2O晶体沿c轴方向的生长;在CaSO4·2H2O向α-CaSO4·0.5H2O转化过程中,C6H17N3O7的加入,延长了晶体的诱导时间与生长时间,并且此抑制效果随着C6H17N3O7添加浓度提高而增强。
符号说明:
|
|
| [1] |
JIA C Y, CHEN Q S, ZHOU X, et al. Trace NaCl and Na2EDTA mediated synthesis of α-calcium sulfate hemihydrate in glycerol-water solution[J]. Industrial & Engineering Chemistry Research, 2016, 55(34): 9189-9194. |
| [2] |
DOADRIO J C, ARCOS DCABANAS M V, VALLET R M, et al. Calcium sulphate-based cements containing cephalexin[J]. Biomaterials, 2004, 25(13): 2629-2635. DOI:10.1016/j.biomaterials.2003.09.037 |
| [3] |
WANG P, LEE E J, PARK C S, et al. Calcium sulfate hemihydrate powders with a controlled morphology for use as bone cement[J]. Journal of the American Ceramic Society, 2008, 91(6): 2039-2042. DOI:10.1111/j.1551-2916.2008.02358.x |
| [4] |
KONG B, GUAN B H, YANG L C, et al. Influence of seed crystal and modifier on the morphology of α-calcium sulfate hemihydrate prepared by salt solution method in pilot scale[J]. Advanced Materials Research, 2010, 16(70): 8-12. |
| [5] |
GUAN B H, JIANG G M, FU H L, et al. Thermodynamic preparation window of alpha calcium sulfate hemihydrate from calcium sulfate dihydrate in non-electrolyte glycerol-water solution under mild conditions[J]. Industrial & Engineering Chemistry Research, 2011, 50(23): 13561-13567. |
| [6] |
FU H L, GUAN B H, JIANG G M, et al. Effect of supersaturation on competitive nucleation of caso4 phases in a concentrated cacl2 solution[J]. Crystal Growth & Design, 2017, 12(3): 1388-1394. |
| [7] |
GUAN B H, SHEN Z X, WU Z B, et al. Effect of pH on the preparation of α-calcium sulfate hemihydrate from FGD gypsum with the hydrothermal method[J]. Journal of the American Ceramic Society, 2008, 91(12): 383-3840. |
| [8] |
CHEN Q S, JIA C Y, LI Y, et al. α-calcium sulfate hemihydrate nanorods synthesis:a method for nanoparticle preparation by mesocrystallization[J]. Langmuir, 2017, 33(9): 2362-2369. DOI:10.1021/acs.langmuir.7b00013 |
| [9] |
TANG Y B, GAO J M. Investigation of the effects of sodium dicarboxylates on the crystal habit of calcium sulfate α-hemihydrate[J]. Langmuir, 2017, 33(38): 9637-9644. DOI:10.1021/acs.langmuir.7b02380 |
| [10] |
CHEN Q S, JIANG G M, JIA C Y, et al. A facile method to control the structure and morphology of α-calcium sulfate hemihydrate[J]. Crystengcomm, 2015, 17(44): 8549-8554. DOI:10.1039/C5CE01923K |
| [11] |
BOSBACH D, JR M F H. Gypsum growth in the presence of growth inhibitors:a scanning force microscopy study[J]. Chemical Geology, 1996, 132(4): 227-236. |
| [12] |
MISRA D N. Interaction of citric acid with hydroxyapatite:surface exchange of ions and precipitation of calcium citrate[J]. Journal of Dental Research, 1996, 75(6): 1418-25. DOI:10.1177/00220345960750061401 |
| [13] |
PHILLIPS B L, LEE Y J, REEDER R J, et al. Organic coprecipitates with calcite:NMR spectroscopic evidence[J]. Environmental Science & Technology, 2005, 39(12): 4533-4539. |
| [14] |
LANZ N M, GARC A-RUIZ P A. Effect of citric acid on setting inhibition and mechanical properties of gypsum building plasters[J]. Construction & Building Materials, 2012, 28(1): 506-511. |
| [15] |
SAHA A, LEE J, PANCERA S M, et al. New insights into the transformation of calcium sulfate hemihydrate to gypsum using time-resolved cryogenic transmission electron microscopy[J]. Langmuir, 2012, 28(30): 11182-11187. DOI:10.1021/la3024474 |
| [16] |
CHEN H Y, WANG J, HOU S C, et al. Influence of NH4Cl on hydrothermal formation of α-CaSO4·0.5H2O whiskers[J]. Journal of Nanomaterials, 2015, 16(1): 99-105. |
| [17] |
田萍, 宁朋歌, 曹宏斌, 等. 二水硫酸钙在铵盐溶液中溶解度测定及热力学计算[J]. 过程工程学报, 2012, 12(4): 625-630. TIAN P, NING P G, CAO H B, et al. Solubility measurement of calcium sulfate dihydrate in NH4Cl-(NH4)2SO4 solutions and thermodynamic calculation[J]. The Chinese Journal of Process Engineering, 2012, 12(4): 625-630. |
| [18] |
HOU S C, WANG J, XUE T Y, et al. Supersaturation-induced hydrothermal formation of α-CaSO4·0.5H2O whiskers[J]. Crystengcomm, 2015, 17(10): 2141-2146. DOI:10.1039/C4CE02361G |
| [19] |
FELDMANN T, DEMOPOULOS G P. Influence of impurities on crystallization kinetics of calcium sulfate dihydrate and hemihydrate in strong hcl-cacl2 solutions[J]. Industrial & Engineering Chemistry Research, 2013, 52(19): 6540-6549. |
| [20] |
JIANG G M, CHEN Q S, JIA C Y, et al. Controlled synthesis of monodisperse α-calcium sulfate hemihydrate nanoellipsoids with a porous structure[J]. Physical Chemistry Chemical Physics, 2015, 17(17): 11509-11515. DOI:10.1039/C5CP00804B |
| [21] |
ZHAO W P, WU Y M, XU J, et al. Effect of ethylene glycol on hydrothermal formation of calcium sulfate hemihydrate whiskers with high aspect ratios[J]. Rsc Advances, 2015, 5(62): 50544-50548. DOI:10.1039/C5RA07712E |
| [22] |
MAO J W, JIANG G M, CHEN Q S, et al. Influences of citric acid on the metastability of α-calcium sulfate hemihydrate in CaCl2 solution[J]. Colloids & Surfaces A Physicochemical & Engineering Aspects, 2014, 443: 265-271. |
| [23] |
姚连增. 晶体生长基础[M]. 合肥: 中国科学技术大学出版社, 1995. YAO L Z. Crystal growth basis[M]. Hefei: University of Science and Technology of China Press, 1995. |




