2. 天津大学 机械工程学院, 天津 300072;
3. 中国电子科技集团公司第十八研究所 化学与物理电源重点实验室, 天津 300384
2. School of Mechanical Engineering, Tianjin University, Tianjin 300072, China;
3. National Key Laboratory of Science and Technology on Power Sources, Tianjin Institute of Power Sources, Tianjin 300384, China
聚合物电解质具有自身柔韧性好、易加工、低成本等优势,使其更适合于固态电池的大规模生产[1-3]。目前,研究较多的聚合物基体有聚醚类、聚丙烯腈、聚甲基丙烯酸甲酯、聚硅氧烷、聚偏氟乙烯、聚偏氟乙烯-六氟丙烯共聚物、聚离子液体等[4-6]。根据导电离子的种类,可以将聚合物电解质分为2大类,即双离子聚合物电解质和单离子聚合物电解质[7]。双离子聚合物电解质由聚合物基体和双离子锂盐组成,其中阴、阳离子均可移动。由于阴离子的运动与聚合物基体中路易斯碱性位点的运动高度耦合,所以阳离子(Li+)的移动性通常低于其对应的阴离子。单离子聚合物电解质是将阴离子固定在聚合物主链上或提供阴离子受体,只有Li+发生迁移。在锂电池充放电过程中,由于电极与电解质仅交换Li+,故而阴离子会在电极表面聚集产生浓度梯度。这将增加电极的极化,导致电池的电压损失以及内部阻抗升高,从而影响电池循环性能[8]。因此,一般情况下,双离子聚合物电解质具有更高的离子电导率,而单离子聚合物电解质具有更高的Li+迁移数。
为设计出满足实际需求的聚合物电解质,其关键性能应满足4个要求:较高的离子电导率、宽的电化学稳定窗口、适宜的Li+迁移数及良好的机械性能。然而,先进的固态电池研究不仅侧重于最大限度地提高固态电解质的离子电导率,还致力于整合电极和固态电解质之间的界面稳定性[9-11]。因此,构建稳定的电极/电解质界面,是实现全固态电池高效运行的关键。本综述讨论了聚合物固态电解质与电极界面存在的主要问题,并分别总结了聚合物电解质与电池正极材料和锂金属负极之间的界面改善方法,为高能量密度全固态锂电池的设计开发提供指导。
2 聚合物固态电解质与正极材料界面与优化 2.1 聚合物电解质与正极的界面问题正极与聚合物电解质的界面问题主要涉及2个方面:界面接触和界面稳定性[12-13]。固态聚合物电解质难以做到像电解液一样完全润湿电极表面,所以聚合物电解质与电极之间会存在点接触,实际接触面积非常有限。这使得电解质和正极之间容易出现空隙、裂纹,会导致界面阻抗大幅度增加,限制了Li+在界面处的传输效率。Zheng等[14]利用扫描电子显微镜(scanning electron microscopy,SEM)观察了LiFePO4正极与聚氧化乙烯(polyethylene oxide,PEO)之间的界面,结果显示电极-电解质界面接触并不紧密,之间存在微米级空隙。此外,电池在循环过程中,正极材料的活性物质会发生体积形变,也会造成相界面之间的接触面积降低,导致活性物质的利用率下降。
正极和聚合物电解质界面的电化学稳定性对全固态电池的稳定运行至关重要,影响因素涉及很多方面,包括聚合物电解质的氧化分解、正极与电解质之间的副反应以及长周期循环过程中电池界面的老化。Yang等[15]认为PEO在高电压下的分解与分子结构中的氧原子有关,即主链中的C─O键和末端─OH。作者通过实验发现,端基为─OCH3的聚乙二醇二甲醚的电化学窗口比端基为─OH的聚乙二醇(polyethylene glycol,PEG)高0.25 V。电压升高时,─OH会被氧化成─COOH(Li),并进一步生成Li2O,而主链中C─O键只在电压高于4.3 V时才会发生氧化。因此,─OH端基的不稳定性是导致PEG电解质电化学窗口较低的主要因素。此外,Nie等[16]采用原位微分电化学质谱检测出LiCoO2表面催化作用是PEO在4.2 V析出氢气的根本原因。即PEO被氧化后,将减弱C─H键的强度。随后H质子被双三氟甲基磺酰亚胺离子(bis(trifluoromethane sulfonimide),TFSI-)夺走,形成氢化的HTFSI,对PEO和LiCoO2均具有较高的腐蚀性。同时,HTFSI进一步扩散到负极,与锂金属发生反应,产生氢气。
2.2 正极界面优化策略在提升正极和聚合物电解质的界面稳定性方面,目前已有大量的研究工作,并取得了突破性进展。主要的优化策略:(1) 正极材料改性;(2) 引入人工界面层;(3) 电解质原位聚合。
构建由活性材料和聚合物电解质组成的复合正极可作为提高界面处离子传输、减少界面阻抗的有效方法。Wan等[17]采用PEO作为正极黏合剂,将Li7La3Zr2O12纳米线嵌入复合正极,并且利用高温使正极中的PEO与纳米线熔合,形成集成化全固态电池结构。该结构能有效增强正极与聚合物电解质之间的界面相容性和稳定性,保证长循环过程中Li+的高效传输(图 1(a))。
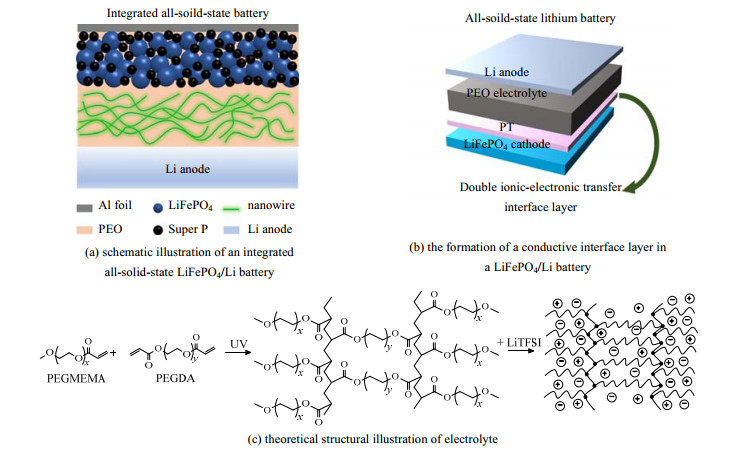
|
图 1 正极界面优化策略 Fig.1 Optimization strategy of anode interface |
在正极与电解质之间引入人工界面层,不但可以改善循环过程中正极与固态电解质的物理接触,而且能抑制界面上的副反应和相互扩散。Zheng等[14]通过在PEO电解质中原位电化学聚合2, 2'-联噻吩(polythiophene,PT),在电极与电解质界面处形成了离子-电子传导界面层(图 1(b))。对于全固态LiFePO4/PT-PEO-PT/Li电池,正极-电解质界面处形成的导电PT层,可以使界面电阻降低7倍,并在循环1 000圈后实现94% 的容量保持率,在2 C倍率下循环时具有较低的极化电压。
除了上述2种方法,采用原位聚合制备电解质薄膜可以扩大活性材料和电解质的有效接触面积,促进界面电荷转移并稳定正极结构。原位聚合技术包括热聚合和光聚合2种方式,其中光聚合在室温下制备速度快,聚合活化能低,也更加快捷安全。Wei等[18]将聚乙二醇单甲醚甲基丙烯酸酯单体(polyethylene glycol methyl ether methacrylate,PEGMEMA)和聚乙二醇二丙烯酸酯单体(polyethylene glycol diacrylate,PEGDA)引入LiMn0.8Fe0.2PO4正极的表面,通过原位紫外聚合(ultraviolet,UV)的方式合成交联聚合物固态电解质(图 1(c))。该电池在0.1 C下可提供164.7 mA·h·g−1的可逆容量,在0.2 C下循环240次后,仍能保持134.4 mA·h·g−1的比容量。Liu等[19]采用类似方法,在LiNi0.6Co0.2Mn0.2O2正极表面直接涂覆一层聚醚丙烯酸酯(polyether acrylate,PEA)前驱体。然后,以多孔聚乙烯隔膜作为支撑骨架,通过交联法形成一体化的电池结构。这种原位聚合得到的集成电池比传统电池表现出更快的Li+扩散系数,在降低界面电阻的同时,极大提高了固态电池的倍率性能。
综合以上分析,3种优化方法中,构建复合正极策略在提升Li+传输的连续性、形成界面渗透通道和抑制活性材料体积变化方面具有突出优势。而采用引入人工界面层的方式可以有效避免电极与聚合物电解质之间的副反应,降低界面阻抗。此外,电解质原位聚合是提高电极/电解质界面接触性能最为简便的方法。并且,该策略能够制备出超薄聚合物,简化封装与生产工艺,实现体积能量密度的提升。当然,正极界面优化技术目前还存在很多挑战,如正极材料的组分优化、人工界面层的兼容性以及制备方法简化等。未来的研究重点也将偏向于聚合前驱液的筛选、提升电解质膜自身柔韧性以及导锂性能等。
3 聚合物固态电解质与锂金属负极界面与优化 3.1 聚合物电解质与负极的界面问题由于锂金属具有超高的理论比容量(3 860 mA·h·g−1)、极小的密度(0.53 g·cm−3)、最低的电化学电势(相对于标准氢电极,−3.04 V)等优势,因此使用锂金属作为电池负极是实现高能量密度电池的必由之路[20-22]。然而,聚合物电解质与锂负极的界面问题依旧突出,这涉及2个方面:界面稳定性和枝晶生长[23-24]。当聚合物电解质与锂金属接触时,伴随着聚合物的还原和结构变化,会在锂负极表面形成一层钝化膜。以PEO电解质为例,当其与金属锂接触时,会生成CF3自由基,进而从聚合物主链中夺取氢原子。并且,锂负极还会进一步破坏聚合物主链上C─O键,形成Li─O─R型化合物[25]。因此,需要通过调整结构单元提高聚合物电解质的抗还原能力。另外,聚合物中锂盐的存在也会影响钝化膜的组成。Zhao等[26]通过在PEO电解质中加入三元锂盐体系(LiTFSI、LiBOB、LiNO3),使其在循环过程中形成较为稳定且含有O═S═O和CF3基团的固态电解质界面层(solid electrolyte interphase,SEI)。
全固态电池经过长时间的循环后,锂负极的体积变化、枝晶和死锂的形成给电池安全带来严峻挑战。从本质上讲,锂枝晶的形成是一种典型的金属电沉积过程,这涉及Li+在不同界面上的运输和电化学还原过程。由于还原反应可以在电极表面上快速发生,所以锂负极表面Li+通量及其分布成为决定锂沉积行为的主要因素。然而,锂负极表面通常会出现局部电流分布不均匀的现象,直接导致枝晶状的锂沉积[27]。Zhang等[28]通过光学显微镜观察到PEO聚合物基体中锂枝晶的形貌,作者认为枝晶的产生是导致固态电池循环寿命降低和最终失效的直接原因。
3.2 锂负极界面优化策略目前已经探索出一些用于电解质与锂负极界面的改进策略,主要概括为2个方面:(1) 聚合物电解质改性;(2) 构建人工SEI膜。
通过调整聚合物基体与添加剂成分来优化聚合物电解质,可以有效改善聚合物电解质的机械强度,增强电解质的电化学性能。例如,Ma等[29]合成了一种交替主链的氟化聚合物电解质,它是由三氟氯乙烯和乙二醇甲基乙烯基醚的活性自由基交替共聚反应制得。这种电解质保持了聚三氟氯乙烯的化学相似性,但没有结晶性,同时电化学窗口扩大到5.3 V。该电解质表现出一定的弱溶剂化效应,有利于在锂负极侧形成富含LiF的SEI,实现电池的长期稳定循环。为了诱导均匀的锂沉积,Xu等[30]通过调整丁二腈(succinonitrile,SN)与PEO的物质的量比(约1:4),使其在固态电解质中形成Li+传输的快速通道。通过固体核磁共振(nuclear magnetic resonance,NMR)分析后发现,复合电解质的7Li信号发生前移,这表明PEO与Li+相互作用减弱,使得电解质的离子电导率提高了100倍,同时促进锂的均匀沉积。
构建人工SEI膜可以有效增强锂负极和聚合物电解质之间的界面接触性能,并抑制枝晶生长。Gao等[31]认为理想的SEI应具备以下条件:厚度足以隔绝电子隧穿;足够高的Li+电导率;在工作电压和温度范围内具有良好的化学稳定性;良好的力学稳定性;能够容纳体积膨胀;发生形变时不破裂。然而,现实中锂金属表面的SEI无法同时满足上述要求,所以研究人员在固态电解质和锂金属界面处引入一层人工SEI来提高锂金属电池的循环稳定性。鉴此,Deng等[32]利用紫外光聚合技术在锂金属和聚偏氟乙烯(polyvinylidene difluoride,PVDF)之间构建一层超薄的高浓度氟化盐中间层(6 μm)作为SEI用于稳定锂负极,搭配LiNiO2正极的固态电池表现出优异的电化学性能,在0.5 C时拥有200 mA·h·g−1的放电容量,经过200次循环后容量保持率为81%,平均库仑效率为99.5%(图 2)。
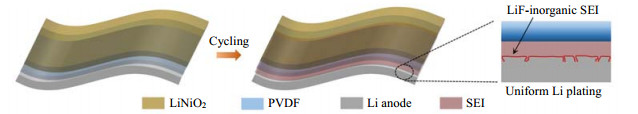
|
图 2 负极界面优化策略 Fig.2 Optimization strategy of cathode interface |
综上所述,聚合物电解质与锂负极之间界面的改性策略可以通过多种方法实现,包括调整聚合物基体、开发新型锂盐、掺杂添加剂、设计复合电解质以及构建人工SEI等。从电池层面看,聚合物电解质改性不仅能够提升电解质本身的电化学性能,还可以增强电解质与正负极的界面相容性,维持电池的稳定循环。相比之下,构建人工SEI能够防止聚合物与锂金属的副反应发生,并且在降低界面阻抗、缓解锂负极的体积膨胀和抑制枝晶生长方面优势明显。实际应用中,为了增强负极界面的稳定性,可能需要多种策略协同进行,从而实现最佳效果。
4 总结与展望本综述针对固态电池内聚合物电解质与正、负极界面存在的问题,归纳了各种改善方法与策略,以便对聚合物电解质材料进行功能设计和改造,为高能量密度的聚合物固态电池研发提供理论依据。
聚合物电解质和电极之间的界面是构建高性能全固态锂金属电池的关键之处,包括增强高电压正极侧的界面稳定性和抑制锂负极侧枝晶的生长。在正极侧,一般采用复合正极和电解质原位聚合的策略来提高界面的相容性和稳定性。在负极侧,主要是通过构建人工SEI和聚合物电解质改性来抑制锂枝晶的生长。除了对以上策略的改进和提升,未来关于聚合物固态电解质的研究还应关注以下几方面:
(1) 室温离子电导率的提升。目前聚合物电解质在低温下的离子导电性和长循环寿命方面仍不能与传统液态电解质相媲美,这是其商业化应用的最大障碍。为了替代传统锂离子电池,进一步提高聚合物电解质的室温导电率已成为主要的研究目标。
(2) 电极/电解质界面处的离子传输机制。全固态电池固-固界面反应的本质仍然不明确,需要进一步揭示界面的离子传输机制,这对于提高界面稳定性和组装全固态电池至关重要。此外,长循环过程中固态电池的界面演变,值得给予更多的关注。
(3) 发展原位聚合工艺。电解质原位聚合可由功能单元制备聚合物电解质,一次性组装出固态电池,增强界面接触,降低界面电阻,提升电化学性能。然而,引发剂的初始量和残留量、引发剂与电极之间存在的副反应、单体聚合度的控制、聚合单体的分子结构对电池性能的影响等诸多问题需要进一步研究。
| [1] |
SEN S, TREVISANELLO E, NIEMöLLER E, et al. The role of polymers in lithium solid-state batteries with inorganic solid electrolytes[J]. Journal of Materials Chemistry A, 2021, 9(35): 18701-18732. DOI:10.1039/D1TA02796D |
| [2] |
LI H, XU Z, YANG J, et al. Polymer electrolytes for rechargeable lithium metal batteries[J]. Sustainable Energy & Fuels, 2020, 4(11): 5469-5487. |
| [3] |
MENG N, ZHU X, LIAN F. Particles in composite polymer electrolyte for solid-state lithium batteries: A review[J]. Particuology, 2021, 60: 14-36. |
| [4] |
ISIKLI S, RYAN K M. Recent advances in solid-state polymer electrolytes and innovative ionic liquids based polymer electrolyte systems[J]. Current Opinion in Electrochemistry, 2020, 21: 188-191. DOI:10.1016/j.coelec.2020.01.015 |
| [5] |
WU Y, LI Y, WANG Y, et al. Advances and prospects of PVDF based polymer electrolytes[J]. Journal of Energy Chemistry, 2022, 64: 62-84. DOI:10.1016/j.jechem.2021.04.007 |
| [6] |
QIAN W, TEXTER J, YAN F. Frontiers in poly(ionic liquid)s: Syntheses and applications[J]. Chemical Society Reviews, 2017, 46(4): 1124-1159. DOI:10.1039/C6CS00620E |
| [7] |
ZHOU D, SHANMUKARAJ D, TKACHEVA A, et al. Polymer electrolytes for lithium-based batteries: advances and prospects[J]. Chem, 2019, 5(9): 2326-2352. DOI:10.1016/j.chempr.2019.05.009 |
| [8] |
DENG K, ZENG Q, WANG D, et al. Single-ion conducting gel polymer electrolytes: design, preparation and application[J]. Journal of Materials Chemistry A, 2020, 8(4): 1557-1577. DOI:10.1039/C9TA11178F |
| [9] |
LIM H D, PARK J H, SHIN H J, et al. A review of challenges and issues concerning interfaces for all-solid-state batteries[J]. Energy Storage Materials, 2020, 25: 224-250. DOI:10.1016/j.ensm.2019.10.011 |
| [10] |
MIAO X, WANG H, SUN R, et al. Interface engineering of inorganic solid-state electrolytes for high-performance lithium metal batteries[J]. Energy & Environmental Science, 2020, 13(11): 3780-3822. |
| [11] |
BANERJEE A, WANG X, FANG C, et al. Interfaces and interphases in all-solid-state batteries with inorganic solid electrolytes[J]. Chemical Reviews, 2020, 120(14): 6878-6933. DOI:10.1021/acs.chemrev.0c00101 |
| [12] |
CHEN R, LI Q, YU X, et al. Approaching practically accessible solid-state batteries: Stability issues related to solid electrolytes and interfaces[J]. Chemical Reviews, 2020, 120(14): 6820-6877. DOI:10.1021/acs.chemrev.9b00268 |
| [13] |
NIE K, HONG Y, QIU J, et al. Interfaces between cathode and electrolyte in solid state lithium batteries: Challenges and perspectives[J]. Frontiers in Chemistry, 2018, 6: 616. DOI:10.3389/fchem.2018.00616 |
| [14] |
ZHENG J, SUN C, WANG Z, et al. Double ionic-electronic transfer interface layers for all solid-state lithium batteries[J]. Angewandte Chemie International Edition, 2021, 60(34): 18448-18453. DOI:10.1002/anie.202104183 |
| [15] |
YANG X F, JIANG M, GAO X J, et al. Determining the limiting factor of the electrochemical stability window for PEO-based solid polymer electrolytes: Main chain or terminal ─OH group[J]. Energy & Environmental Science, 2020, 13(5): 1318-1325. |
| [16] |
NIE K H, WANG X L, QIU J L, et al. Increasing poly(ethylene oxide) stability to 4.5 V by surface coating of the cathode[J]. ACS Energy Letters, 2020, 5(3): 826-832. DOI:10.1021/acsenergylett.9b02739 |
| [17] |
WAN Z, LEI D, YANG W, et al. Low resistance-integrated all-solid-state battery achieved by Li7La3Zr2O12 nanowire upgrading polyethylene oxide (PEO) composite electrolyte and PEO cathode binder[J]. Advanced Functional Materials, 2019, 29(1): 1805301. DOI:10.1002/adfm.201805301 |
| [18] |
WEI Z, ZHANG T, WANG M, et al. Formation of excellent cathode/electrolyte interface with UV-cured polymer electrolyte through in situ strategy[J]. Journal of the Electrochemical Society, 2021, 168(2): 020511. DOI:10.1149/1945-7111/abdeed |
| [19] |
LIU Q Y, JING M X, LI R, et al. Highly adaptable poly(ether-acrylate) solid electrolyte for cathode/electrolyte interface integration and application in lithium metal-free solid-state batteries[J]. ACS Applied Energy Materials, 2021, 4(11): 12989-12997. DOI:10.1021/acsaem.1c02622 |
| [20] |
ALBERTUS P, ANANDAN V, BAN C, et al. Challenges for and pathways toward Li-metal-based all-solid-state batteries[J]. ACS Energy Letters, 2021, 6(4): 1399-1404. |
| [21] |
YOON K, LEE S, OH K, et al. Challenges and strategies towards practically feasible solid-state lithium metal batteries[J]. Advanced Materials, 2022, 34(4): 2104666. DOI:10.1002/adma.202104666 |
| [22] |
HATZELL K B, CHEN X C, COBB C L, et al. Challenges in lithium metal anodes for solid-state batteries[J]. ACS Energy Letters, 2020, 5(3): 922-934. DOI:10.1021/acsenergylett.9b02668 |
| [23] |
EBADI M, MARCHIORI C, MINDEMARK J, et al. Assessing structure and stability of polymer/lithium-metal interfaces from first-principles calculations[J]. Journal of Materials Chemistry A, 2019, 7(14): 8394-8404. DOI:10.1039/C8TA12147H |
| [24] |
BARAI P, HIGA K, SRINIVASAN V. Lithium dendrite growth mechanisms in polymer electrolytes and prevention strategies[J]. Physical Chemistry Chemical Physics, 2017, 19(31): 20493-20505. DOI:10.1039/C7CP03304D |
| [25] |
GRANVALET-MANCINI M L, HANRATH T, TEETERS D. Characterization of the passivation layer at the polymer electrolyte/lithium electrode interface[J]. Solid State Ionics, 2000, 135(1/2/3/4): 283-290. |
| [26] |
ZHAO Q, CHEN P, LI S, et al. Solid-state polymer electrolytes stabilized by task-specific salt additives[J]. Journal of Materials Chemistry A, 2019, 7(13): 7823-7830. DOI:10.1039/C8TA12008K |
| [27] |
LUO Z, LI S, YANG L, et al. Interfacially redistributed charge for robust lithium metal anode[J]. Nano Energy, 2021, 87: 106212. DOI:10.1016/j.nanoen.2021.106212 |
| [28] |
ZHANG J, ZHAO N, ZHANG M, et al. Flexible and ion-conducting membrane electrolytes for solid-state lithium batteries: Dispersion of garnet nanoparticles in insulating polyethylene oxide[J]. Nano Energy, 2016, 28: 447-454. DOI:10.1016/j.nanoen.2016.09.002 |
| [29] |
MA M Y, SHAO F, WEN P, et al. Designing weakly solvating solid main-chain fluoropolymer electrolytes: Synergistically enhancing stability toward Li anodes and high-voltage cathodes[J]. ACS Energy Letters, 2021, 6(12): 4255-4264. DOI:10.1021/acsenergylett.1c02036 |
| [30] |
XU S, SUN Z, SUN C, et al. Homogeneous and fast ion conduction of PEO-based solid‐state electrolyte at low temperature[J]. Advanced Functional Materials, 2020, 30(51): 2007172. DOI:10.1002/adfm.202007172 |
| [31] |
GAO Y, DU X, HOU Z, et al. Unraveling the mechanical origin of stable solid electrolyte interphase[J]. Joule, 2021, 5(7): 1860-1872. DOI:10.1016/j.joule.2021.05.015 |
| [32] |
DENG T, CAO L, HE X, et al. In situ formation of polymer-inorganic solid-electrolyte interphase for stable polymeric solid-state lithium-metal batteries[J]. Chem, 2021, 7(11): 3052-3068. DOI:10.1016/j.chempr.2021.06.019 |




