2. 新药创制与药物安全性评价河南省协同创新中心,河南 郑州 450001;
3. 郑州大学 化工与能源学院,河南 郑州 450001;
4. 郑州大学 药学院,河南 郑州 450001
2. Collaborative Innovation Center of New Drug Research and Safety Evaluation, Zhengzhou 450001, China;
3. School of Chemical Engineering and Energy, Zhengzhou University, Zhengzhou 450001, China;
4. School of Pharmaceutical Sciences, Zhengzhou University, Zhengzhou 450001, China
普瑞巴林 (Pregabalin),化学名为 (S)-3-(氨甲基)-5-甲基己酸,是辉瑞公司研发的新型钙通道调节剂型药物,为美国和欧洲认可的第一个可同时适用于糖尿病性神经痛和带状疱疹神经痛治疗的药物[1]。自2004年首次在美国上市以来,迅速在全球80多个国家和地区得到应用[2],其在临床上应用的领域也越来越广泛,近年来在全球的处方药物销售额中连续排在前20名[3, 4]。
溶解度是药物的物性数据之一,在制药行业中的分离、结晶及药剂设计等方面都至关重要。经国内外文献检索发现,有关普瑞巴林溶解度的研究仅有一篇近期发表的论文[5],该文献报道了普瑞巴林在甲醇、异丙醇、水及其混合溶剂中的溶解度数据,而本文在普瑞巴林的工艺研究中,应用到了乙醇、丙酮、四氢呋喃等多种溶剂及其混合溶剂,普瑞巴林在相关溶剂中溶解度的测定未见公开报道。
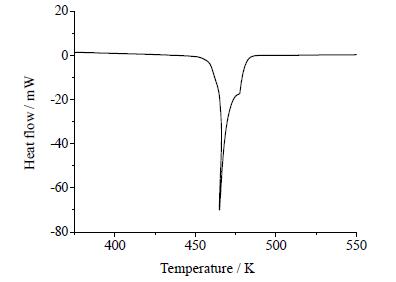
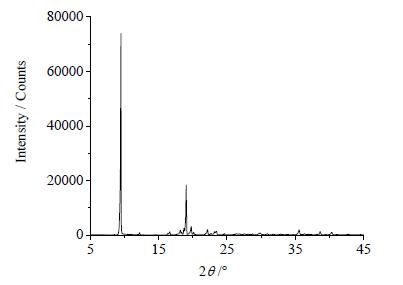
普瑞巴林是多晶型药物,本文选择其报道最多且已商品化的晶型Ⅰ进行溶解度测定。该晶型经DSC测定,在458~478 K处有特征吸收峰 (如图 1);经粉末衍射测定,其2θ角在9.5±0.2,12.3±0.2,16.7±0.2,18.3±0.2,19.1±0.2和19.8±0.2°处有特征吸收峰 (如图 2)。采用平衡法,测定了不同温度条件下普瑞巴林在水、乙醇、丙酮等七种纯溶剂及丙酮-水混合溶剂中的溶解度,并选用适宜的经验模型拟合出溶解度曲线,为普瑞巴林结晶过程的研究提供了热力学基础数据。
|
图 1 普瑞巴林的DSC特征图 Fig.1 DSC curve of pregabalin |
|
图 2 普瑞巴林的PXRD特征图 Fig.2 PXRD pattern of pregabalin |
普瑞巴林,由武汉远成共创科技有限公司提供,经高效液相色谱仪检测,纯度大于99.5%;纯化水,实验室自制;甲醇、乙醇、丙酮及乙酸乙酯 (EAC) 均为分析纯,由天津科密欧化学试剂公司提供;四氢呋喃 (THF) 与N, N-二甲基甲酰胺 (DMF) 均为分析纯,由国药集团化学试剂公司提供。
BT-125D型分析天平,德国赛多利斯集团;SYC型超级恒温水槽,郑州凯鹏实验设备有限公司;双层玻璃反应釜,郑州中原玻璃厂;精密温度计,郑州中原玻璃厂;DSC/TGA同步热分析仪SDT Q600,美国TA仪器公司;D8Advance型X射线衍射仪,布鲁克 (北京) 科技有限公司 (Bruker)。
2.2 实验方法采用平衡法[6~10],将过量的普瑞巴林加入装有溶剂的双层玻璃反应釜中,以精度为0.1 K的温度计监测釜内溶液温度。在恒定温度下通过磁力搅拌24 h以上使其达到固液平衡,再在同样的温度下静止12 h。然后通过移液管吸取适量上层清液,并通过装有孔径为0.2 μm滤头的注射器过滤,将过滤后的饱和溶液转移至干燥的空玻璃蒸发皿 (称重为m0) 中,天平称重为m1,最后放入真空干燥器中干燥,充分干燥48 h至重量不变后,天平称重为m2。转移过程中所使用的设备都提前进行过预热并操作迅速,以防止转移过程中因溶液温度变化及溶剂蒸发损失所造成的误差。为确保所测定数据为普瑞巴林晶型Ⅰ的溶解度,需监测在固液平衡过程中普瑞巴林的稳定性,即晶型是否发生变化,因此在每次转移饱和溶液后,用药匙取下层未溶解固体,低温真空干燥后进行DSC分析,以判断其是否发生晶型变化[11]。
所有的测定都在同样的条件下重复三次,求其平均值,以减小实验误差。
由本实验测定的数据计算普瑞巴林在纯溶剂中溶解分数的公式是:
| ${{x}_{i}}=\frac{{({{m}_{2}}-{{m}_{0}})}/{{{M}_{1}}}\;}{{({{m}_{2}}-{{m}_{0}})}/{{{M}_{1}}+{({{m}_{1}}-{{m}_{2}})}/{{{M}_{2}}}\;}\;}$ | (1) |
而普瑞巴林在丙酮-水混合溶剂中的溶解分数的计算公式是:
| ${{x}_{i}}=\frac{{({{m}_{2}}-{{m}_{0}})}/{{{M}_{1}}}\;}{{({{m}_{2}}-{{m}_{0}})}/{{{M}_{1}}+{({{m}_{1}}-{{m}_{2}})\cdot {{x}_{m}}}/{{{M}_{2}}+{({{m}_{1}}-{{m}_{2}})\cdot (1-{{x}_{m}})}/{{{M}_{3}}}\;}\;}\;}$ | (2) |
由于普瑞巴林是极性化合物,考虑到各种固液平衡模型的适用场合,首先选用修订的Apelblat经验方程拟合普瑞巴林在溶剂中的溶解度数据,Apelblat模型假定溶液的焓变为温度的线性函数,修订简化后可用于关联物质的溶解度与温度间的关系,其方程的具体形式如下[12]:
| $\ln {{x}_{i}}=A+{B}/{T+C\cdot \ln T}\;$ | (3) |
Acree等人提出的 (CNIBS)/Redlich-Kister方程,可用于计算物质在二元溶剂体系中的溶解度[13]。选用此模型模拟普瑞巴林在丙酮-水二元组分中的溶解度数据。其简化的方程形式为:
| $\ln {{x}_{i}}={{B}_{0}}+{{B}_{1}}\cdot x+{{B}_{2}}\cdot {{x}^{2}}+{{B}_{3}}\cdot {{x}^{3}}+{{B}_{4}}\cdot {{x}^{4}}$ | (4) |
以上两个模型均用相对偏差ε及平均相对偏差σ来检验结果的一致性,其定义分别为:
| $\varepsilon ={\left| {{x}_{cl}}-{{x}_{i}} \right|}/{{{x}_{i}}}\;$ | (5) |
| $\sigma =\frac{1}{n}\cdot \sum\limits_{i=1}^{n}{\left| {({{x}_{cl}}-{{x}_{i}})}/{{{x}_{i}}}\; \right|}$ | (6) |
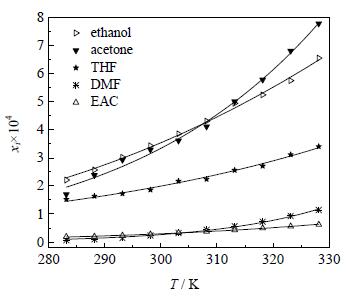
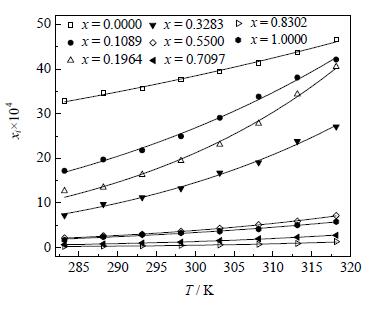
普瑞巴林在纯溶剂中的溶解度数据及模拟值如表 1,图 3、4所示。通过热分析仪检测普瑞巴林达到固液平衡后剩余的固体,其DSC数据与测定前无可检测到的变化,可认为普瑞巴林在溶解过程中未发生晶型转变,即在所考察的固液平衡体系中可长时间保持稳定。从图 3、4可以看出:普瑞巴林在各种溶剂中的溶解度均随着温度的升高逐渐增大,且其在纯溶剂中的溶解度顺序为水>甲醇>乙醇,丙酮>四氢呋喃>乙酸乙酯,DMF;较低温度时普瑞巴林在乙醇中的溶解度大于在丙酮中的,在乙酸乙酯中的溶解度大于在DMF中的,而在较高温度时情况相反。将结果与文献测定的普瑞巴林在纯溶剂水及甲醇中的溶解度数据进行比较,发现相差较小,平均相对偏差为0.06,应该属于产品差异、操作环境温度不同及仪器设备的差别等原因引起的实验数据的波动。
| 表 1 普瑞巴林在纯溶剂中的溶解度 Table 1 Solubility of pregabalin in pure solvents |

|
图 3 普瑞巴林在所有纯溶剂中的溶解度 Fig.3 Solubility of pregabalin in all pure solvents |
|
图 4 普瑞巴林在部分纯溶剂中的溶解度 Fig.4 Solubility of pregabalin in part of pure solvents |
通过Origin 8.0软件对溶解度数据关于修订的Apelblat方程进行拟合,均关联良好,均有决定系数R2≥0.99,拟合所得到的无因次参数A、B、C的数值列于表 2。从表 1、2中可以看出均有相对偏差ε<0.15,平均相对偏差σ<0.05,说明测定的普瑞巴林在纯溶剂中的溶解度与计算得到的理论值吻合较好,修订的Apelblat方程适用于解释普瑞巴林在所研究的温度和溶剂范围中的溶解度数据。对于所测的每种溶剂,普瑞巴林的溶解度随着温度的升高而增大,说明其溶解过程是吸热的。
| 表 2 纯溶剂中修订的Apelblat方程拟合对应得到的无因次模型参数、R2及σ Table 2 Parameters of modified Apelblat equation for pregabalin solubility fitting in pure solvents |
普瑞巴林在丙酮-水混合溶剂中的溶解度数据及模拟值如表 3,图 5、6所示。通过分析固液达到平衡后剩余固体的DSC数据,也未发现普瑞巴林在此固液平衡体系中发生晶型变化。数据表明,对于每种固定的丙酮-水混合溶剂组分,普瑞巴林的溶解度均随着温度的升高而增大,而在同一温度条件下普瑞巴林的溶解度随着丙酮摩尔分数的增大而减小,当丙酮在二元混合溶剂中摩尔分数达到0.83时,溶解度几乎为0。原因可能是普瑞巴林分子中含极性基团,从而与水中形成的氢键发生作用,使得普瑞巴林溶解;但混合溶剂中的丙酮分子更容易与水中形成的氢键结合,从而降低了普瑞巴林的溶解性,当丙酮的摩尔分数在0.83附近时,混合溶剂中以丙酮为主,丙酮分子几乎占据了水中所有氢键的位置,而普瑞巴林在丙酮中的溶解度又相对较小,所以此时普瑞巴林的溶解度接近0,当丙酮的摩尔分数远远大于水时,普瑞巴林的溶解度则逐渐接近其在纯丙酮中的溶解度[13]。这种规律,也可以用“相似相溶”原理进行解释。与文献[5]中普瑞巴林在甲醇-水及异丙醇-水混合溶剂中的溶解度存在最大值相比,普瑞巴林在丙酮-水混合溶剂中存在溶解度最小值对普瑞巴林的溶析结晶过程等方面更有意义。通过Origin 8.0软件对该数据关于修订的Apelblat方程、(CNIBS)/Redlich-Kister方程进行拟合,均关联良好,其决定系数均有R2≥0.99,拟合所得到的无因次参数数值列于表 4、5。
|
图 5 普瑞巴林在丙酮-水混合溶剂中的溶解度随温度的变化 Fig.5 Solubility variation of pregabalin in acetone-water mixtures as a function of temperature |
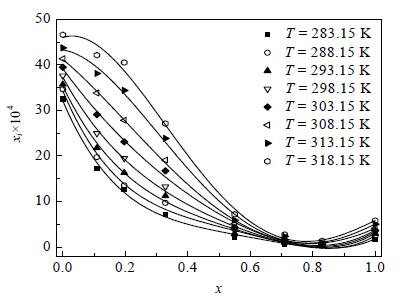
|
图 6 普瑞巴林在丙酮-水混合溶剂中的溶解度随丙酮摩尔分数变化 Fig.6 Solubility variation of pregabalin in acetone-water mixtures as a function of acetone mole fraction |
| 表 3 普瑞巴林在丙酮与水的溶剂中的溶解度 Table 3 Solubility of pregabalin in acetone-water mixed solvents |
| 表 4 丙酮-水混合溶剂中关于修订Apelblat方程拟合对应得到的无因次模型参数、R2及σ Table 4 Parameters of modified Apelblat equation for pregabalin solubility fitting in acetone-water mixtures |
| 表 5 丙酮-水混合溶剂中关于 (CNIBS)/Redlich-Kister方程拟合对应得到的模型参数、R2及σ Table 5 Parameters of (CNIBS)/Redlich-Kister equation for pregabalin solubility fitting in acetone-water mixtures |
通过平衡法测定了普瑞巴林在七种纯溶剂及丙酮-水混合溶剂中的溶解度,在所测溶剂中溶解度均随温度的升高而增大,应用修订的Apelblat模型拟合数据,关联结果良好。普瑞巴林在丙酮-水混合溶剂中的溶解度随着丙酮摩尔分数的增加而减少,在丙酮摩尔分数达到0.83附近时溶解度最小,接近0。引入温度参数采用 (CNIBS)/Redlich-Kister模型进行修正,结果显示关联良好,改善了模型单因素预测的缺陷,有效地提高了普瑞巴林在二元混合溶剂中溶解度的预测精度。
| 符号说明: | |||
| A, B, C | —修订的Apelblat方程参数 | x | —丙酮在混合溶剂中的摩尔分数 |
| B0, B1, B2, B3, B4 | —(CNIBS)/R-K方程参数 | xcl | —溶质摩尔分数的理论值 |
| M1, | —溶质普瑞巴林的分子摩尔质量,g×mol-1 | xi | —溶质摩尔分数的测定值 |
| M2, M3 | —溶剂的分子摩尔质量,g×mol-1 | xm | —丙酮在混合溶剂中的质量分数 |
| R2 | —拟合优度判定系数 | ε | —相对偏差 |
| T | —温度,K | σ | —平均相对偏差 |
| [1] | Living with Fibromyalgia, drugs approved to manage pain:Federal Drug Administration[S]. Washington, DC:FDA, 2008. |
| [2] | Lee C H, Liou H H. Pregabalin activates ROMK1 channels via cAMP-dependent protein kinase and protein kinase C[J]. European Journal of Pharmacology , 2014, 740(5): 35-44. |
| [3] | Lindsley C W. 2013 Trends and statistics for prescription medications in the United States:CNS highest ranked and record number of prescriptions dispensed[J]. Acs Chemical Neuroscience , 2015, 6(3): 356-357. DOI:10.1021/acschemneuro.5b00049. |
| [4] | Lindsley C W. The top prescription drugs of 2012 globally:biologics dominate, but small molecule CNS drugs hold on to top spots[J]. Acs Chemical Neuroscience , 2013, 4(6): 905-907. DOI:10.1021/cn400107y. |
| [5] | Cogoni G, Souza B D, Croker D M, et al. Solubility of (s)-3-(aminomethyl)-5-methylhexanoicacid in pure and binary solvent mixtures[J]. Journal of Chemical and Engineering Data , 2016, 61(1): 587-593. DOI:10.1021/acs.jced.5b00736. |
| [6] | SUN Peng(孙鹏), LIU Jun-guo(刘俊果), YANG Yu-huai(杨玉淮), et al. Determination and correlation of solubilities of avermectins in different systems of alcohol-water(阿维素在不同醇-水溶剂体系中溶解度的测定与关联)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学) , 2010, 24(5): 735-738. |
| [7] | Mudalip S K A, Bakar M R A, Jamal P, et al. Solubility and dissolution thermodynamic data of mefenamic acid crystals in different classes of organic solvents[J]. Journal of Chemical and Engineering Data , 2013, 58(12): 3447-3452. DOI:10.1021/je400714f. |
| [8] | SUN Xian-xiang(孙贤祥), CHEN Yu-ting(陈玉婷), XIA Tian-xi(夏天喜). Measurement and prediction of solubility of s-timolol-d-tartrate salt in organic solvents(S-噻吗洛尔-D-酒石酸非对映体盐在有机溶剂中的溶解度测定和预测)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2012, 26(1): 7-12. |
| [9] | YUE Jin-cai(岳金彩), ZHU Nan-nan(朱南南), LIU Xian-hong(刘先红), et al. Measurement and correlation of the solubility of 4-tert-butylphenol in NaCl solution(对叔丁基苯酚在盐水中溶解度的测定及关联)[J]. Chemical Industry and Engineering(化学工业与工程) , 2014, 31(1): 33-37. |
| [10] | Shen Y M, Liu Z F, Li T, et al. Determination and correlation of solubility of tylosintartratein alcohol mixtures[J]. Journal of Chemical Thermodynamics , 2015, 80: 128-134. DOI:10.1016/j.jct.2014.08.026. |
| [11] | Zhang Y, Liu J J, Zhang L, et al. Solubility of 2, 5-di-tert-butylhydroquinone and process design for its purification using crystallization[J]. Journal of Chemical and Engineering Data , 2015, 60(7): 1968-1974. DOI:10.1021/je501049c. |
| [12] | WANG Wei(汪伟), ZHANG Yan(张彦), WANG Ya-yun(王亚运), et al. Measurement and correlation of the solubility of aluminium ethoxide(三乙醇铝溶解度的测定及关联)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学) , 2015, 29(6): 1293-1295. |
| [13] | YANG Jiu-li(杨久利), SHA Zuo-liang(沙作良), YANG Li-bin(杨立斌), et al. Measurement and correlation of glycine solubility in acetone-water mixture(甘氨酸在丙酮-水混合溶剂中溶解度的测定与关联)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2015, 29(2): 471-475. |




