工业革命以后,随着人口的增长以及工业生产活动的不断扩大,CO2的排放量也逐年增多,加剧了全球变暖和气候的异常[1, 2]。因此需要开发有效的CO2捕集和分离的方法以减少CO2的直接排放。目前,CO2捕集和分离方法主要包括有机胺溶液吸收法、膜分离法、金属有机材料吸附法[3]、离子液体吸收法[4]等。相对于溶剂吸收法,固体吸附法兴起比较晚,具有工艺简单、对设备腐蚀性小、吸附剂回收再生能耗低等优点,因此受到许多研究人员的关注[5, 6]。研究人员利用介孔氧化硅材料(如SBA-15[5],KIT-6[6]和MCM-41[7~9])的高比表面积和大孔容等特性对其表面进行了有机胺修饰,提高了吸附剂的CO2吸附量与选择性[10]。然而这种固体吸附剂制备过程较为繁琐[11, 12],且需要使用有机溶剂,因此寻找更加简单的方法制备固体吸附剂更具有实际意义。
近年来,“干水”的研究越来越成为研究的热点[13, 14]。“干水”是由水和疏水性二氧化硅纳米粒子高速搅拌制备而成的一种“粉末状”的水[15],水的比例可达95%。它的外观为固态粉末,具有比液态水高得多的比表面。Farhang等[16]制备了“干水”并将其应用于CO2捕捉[16],Dawson等[17]使用碱性干水进行二氧化碳捕获,碱溶液可以与水以及二氧化硅纳米粒子通过高速搅拌混合成外观为固体的“干基”吸附剂。该吸附剂比未混合有二氧化硅纳米粒子的碱溶液有更大的表面积可用于CO2的捕获,这样使得CO2的吸收更加容易进行,从而大大提高了CO2吸收性能[17]。
由此可见,“干水”的快速制备方法相对于常见的将有机胺湿法负载在多孔材料上的方法要简单得多。而目前尚无将有机胺和疏水性纳米SiO2混合后快速搅拌得到胺基固态吸附剂的报道[18]。有机胺(如PEI)具有较多的胺基基团,有利于提高吸附剂对酸性气体CO2的吸附性能,因此在本研究中以快速搅拌的方法将聚乙烯亚胺(PEI)负载疏水性纳米SiO2载体表面,并将其用于捕捉CO2,考察温度以及有机胺的负载量等对CO2吸附量的影响,并探究“干胺”的循环使用性能。
2 实验部分 2.1 试剂与仪器聚乙烯亚胺(PEI,Mw= 1200) 购自成都科龙公司,聚乙烯亚胺是一种无色或淡黄色液体,有吸湿性,由于其具有氨基和亚甲基,是一种“双亲”高分子聚合物。疏水性气相纳米二氧化硅(以下全文统称SiO2)购自Sigma-Aldrich公司。所用化学试剂均为分析纯。
采用S4800型扫描电子显微镜(SEM)和JEOL-2100F透射电子显微镜(TEM)对吸附剂样品的形貌进行了表征。采用NOVA 4000e型物理吸附仪对吸附剂的比表面积、孔容和孔径分布等参数进行了表征。采用NETZSCH公司的STA 449C热重分析仪(TG)测试吸附剂的热稳定性以及有机胺的负载量。吸附剂在N2气氛下从室温以10℃·min-1的升温速率升至800℃,根据其失重量计算其有机胺的实际负载量。
2.2 实验过程本文采用高速搅拌法对SiO2载体进行有机胺修饰。在家用料理机中先加入1.0 g SiO2后,再将一定量的聚乙烯亚胺(PEI)加入到料理机中,经过60 s快速搅拌(搅拌速度16, 000 r·min-1)即可得到有机胺改性的SiO2吸附剂。改性后的吸附剂虽含有一定量的液体有机胺,但外观仍为粉末状的固体。吸附剂标记为xPEI/SiO2,“x”代表改性的吸附剂中PEI的质量百分比。如,SiO2载体负载了50%(wt) PEI,标记为50PEI/SiO2。负载后的吸附剂的密度经测量约为200 kg·m-3。
为了和工业上真实的测试条件接近,本研究在固定床反应器中采用穿透曲线法测试吸附剂的CO2吸附性能,采用Oic-20质谱仪对尾气进行在线分析。具体操作步骤如下:在内径为6 mm,外径为8 mm,长度为250 mm的石英反应管中间部位放入0.2 g吸附剂,装填高度约为45 mm,为了防止实验过程中发生堵塞,故填充较为松散,反应管两端塞有石英棉。在N2 (流量20 mL·min-1)气氛中将吸附床层以5℃·min-1的升温速率从室温加热到100℃并保持1 h,目的是除去吸附剂预吸附的少量杂质气体及水分。预处理结束后待冷却至吸附温度后,通入10%CO2/N2(10 mL·min-1)进行CO2吸附直至饱和。此外选取50PEI/SiO2进行四次吸附-脱附循环实验,样品首先在100℃ N2 (20 mL·min-1)预处理1 h,除去H2O和CO2等吸附物,然后降至吸附温度90℃下,10% CO2/N2 (10 mL·min-1)吸附直至饱和,100℃下N2 (20 mL·min-1)脱附100 min使得吸附剂进行循环再生。进行四次CO2吸附-脱附实验来考察PEI/SiO2型吸附剂的循环使用性能。
3 结果与讨论 3.1 表征图 1(a)和1(b)分别是SiO2载体和负载PEI后的吸附剂TEM照片。由图 1(a) SiO2载体TEM图像上可以清楚地看出SiO2纳米粒子的平均直径约为10 nm,SiO2纳米粒子之间存在着大量的堆积孔。图 1(b)是负载PEI后的吸附剂的TEM照片。从图 1(b)TEM图像上可以清楚地看出SiO2纳米粒子并没有明显的变化。由此可见,PEI并没有对SiO2纳米粒子造成明显的破坏。

|
图 1 SiO2和50PEI/SiO2 TEM图 Fig.1 TEM micrographs of SiO2 and 50PEI/SiO2 |
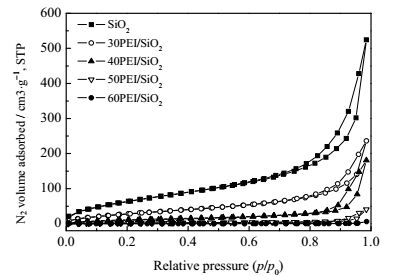
图 2给出了SiO2载体在PEI修饰前后的N2吸-脱附等温线。从图中可以看出SiO2的吸脱附曲线在相对压力P/Po= 0.8~0.99处有一个H3型滞后环,这是由于多层吸附后介孔中的毛细管凝聚现象引起的,表明SiO2粒子之间由于相互堆积在一起而具有不规则的介孔孔道。在N2吸-脱附等温线图可以看到PEI的负载量在50%之前样品的物理吸附曲线均呈明显的H3型,而当样品的负载量达到60%时,曲线中的滞后环基本消失了,这是因为对该载体进行有机胺修饰后部分有机胺填充到SiO2的堆积孔道中导致吸附剂对N2的吸附能力下降。
|
图 2 SiO2, 30PEI/SiO2, 40PEI/SiO2, 50PEI/SiO2和60PEI/SiO2样品的N2吸-脱附等温线 Fig.2 Nitrogen adsorption-desorption isotherms of SiO2, 30PEI/SiO2, 40PEI/SiO2, 50PEI/SiO2 and 60PEI/SiO2 |
表 1给出了SiO2在PEI修饰前后的比表面积、孔容、孔径大小等参数。从表中可以看出,未负载PEI的SiO2载体比表面积为236 m2·g-1,孔容为0.81 cm3·g-1,堆积孔平均孔径为13.6 nm。负载了50% PEI后其比表面积为7 m2·g-1,孔容为0.06 cm3·g-1,堆积孔平均孔径为36.3 nm。而负载60% PEI的吸附剂比表面积仅为0.9 m2·g-1,孔容仅为0.01 cm3·g-1,堆积孔平均孔径为37.2 nm。对比于没有负载疏水性SiO2载体,PEI负载后的SiO2吸附剂的堆积孔径则有明显的增大,这是由于PEI负载在直径约8 nm SiO2粒子表面形成了较大的粒子,粒子之间的空隙增大从而导致堆积孔平均孔径增大,堆积孔的存在有利于CO2与PEI的充分接触从而减少传质阻力,提高了吸附剂的CO2的吸附性能。PEI负载后的SiO2吸附剂的比表面积和孔容呈现出明显下降的趋势,这是由于液体的比表面积可以忽略,PEI负载在SiO2的表面或SiO2颗粒间堆积孔,导致比表面和孔容的明显下降。
| 表 1 SiO2修饰前后的孔结构参数 Table 1 Pore parameters of SiO2 before and after modification |
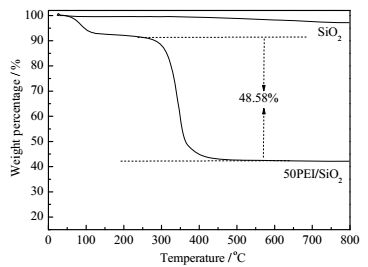
为了评价PEI在SiO2载体上的实际负载量以及50PEI/SiO2吸附剂的热稳定性,研究利用热分析仪采用程序升温的方法对其进行了测试。图 3给出了SiO2和50PEI/SiO2吸附剂的热重(TG)曲线。从图 3可知,SiO2样品在整个升温过程基本没有明显的失重过程,表明其中SiO2在室温到800℃的性质非常稳定。而50PEI/SiO2的热重曲线显示有两个明显失重过程,其中在室温到120℃之前的主要失重量为10%,其失重过程归因于样品表面吸附的水和其他预吸附的杂质气体的脱附。样品在300℃时出现了一个第二个明显的失重过程,在325℃左右失重速度加快,在500℃左右失重基本结束。第二个失重过程主要是由于PEI在高温下的挥发脱附行为引起的。从500℃一直到800℃,样品质量无明显变化表明有机胺PEI在500℃已基本脱附完毕。因此从热重曲线可以看出负载有机胺PEI的样品在300℃以下可以稳定存在。根据300℃到500℃失重的量可以估算出实际PEI负载量,约为48.58%,与理论负载量50%比较接近,表明在负载过程中有机胺基本无损失或损失非常小。
|
图 3 SiO2和50PEI/SiO2的热重曲线 Fig.3 TG curves of SiO2 and 50PEI/SiO2 |
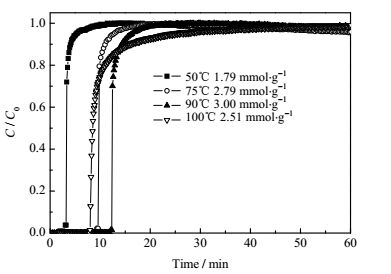
由于实际的烟道气具有一定温度,因此研究不同温度下吸附CO2具有一定的应用指导意义。在最佳的温度条件下,有机胺与CO2的反应活性达到最大。前期研究表明,吸附温度对吸附剂的CO2吸附性能有重要影响[19]。如作者前期考察有机胺TEPA(四乙烯五胺)负载在介孔泡沫氧化硅以及介孔氧化硅纳米管上后,吸附剂的最佳温度为75℃[19, 20]。图 4给出了50PEI/SiO2吸附剂在50、75、90和100℃的CO2吸附穿透曲线,从图中可以看出,随着吸附温度的升高吸附剂对CO2气流的穿透时间呈先增大后降低的趋势。吸附剂的CO2饱和吸附量如图 4所示,50℃时50PEI/SiO2的CO2捕捉量仅为1.79 mmol·g-1-adsorbent,在90℃时达到3.00 mmol·g-1-adsorbent。继续升温至100℃,吸附量下降到了2.51 mmol·g-1-adsorbent。因此可以得出结论该吸附剂最佳的吸附温度为90℃。这种现象可能是由于PEI与CO2的反应是吸热反应,升高温度有利于吸附的进行。此外低温下粘稠的有机胺的流动性较差,低温下CO2的吸附是受动力学控制的过程,有机胺与CO2分子不能进行充分的相互作用,所以吸附剂的CO2吸附量较低[20, 21]。随着温度的升高,负载在SiO2载体上的PEI分子的灵活性和延展性得到增强,有利于CO2分子扩散到活性位,从而有利于PEI与CO2发生充分相互作用,使得CO2吸附量增加。但随着温度的不断升高,反应的逆反应过程增强,使得PEI与CO2反应的产物分解加剧即CO2的脱附增强从而导致吸附剂的吸附量下降,不利于CO2吸附。因此过低温度与过高温度都不利于CO2吸附,所以在后续的实验中选择90℃为吸附温度。
|
图 4 不同温度下50PEI/SiO2的CO2吸附量 Fig.4 CO2 uptake of 50PEI/SiO2 at different temperatures |
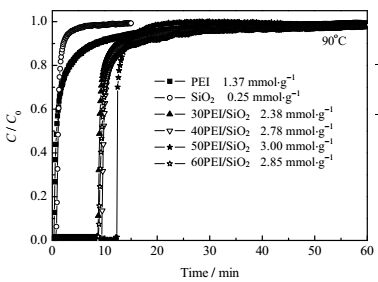
为了考察载体SiO2在复合吸附剂中的作用,对纯PEI和不同负载量的PEI/SiO2的吸附性能进行了对比。图 5给出了纯PEI、SiO2载体以及不同PEI负载量的SiO2吸附剂的CO2穿透曲线图。如图 5所示SiO2载体的CO2吸附量低,仅为0.25 mmol·g-1,说明了SiO2载体本身对CO2的吸附作用极低。纯PEI在90℃时对CO2的吸收量为1.37 mmol·g-1-PEI,这是由于纯的PEI分子量比较大,粘稠流动性差,CO2气体与PEI的相界面积小,比表面积几乎可以忽略,与CO2作用受到传质作用的影响比较大,导致其CO2吸收量较少。而负载PEI后的SiO2吸附剂对CO2吸附能力则有了很大的提高,如30PEI/SiO2的吸附量是2.38 mmol·g-1-adsorbent,40PEI/SiO2的吸附量可达2.78 mmol·g-1-adsorbent。这是因为有机胺负载在SiO2上更有利于有机胺的分散,使得有机胺上的活性组分更容易与酸性气体CO2发生相互作用,使吸附更易发生,所以负载PEI后吸附剂的CO2吸附量相比纯PEI的样品多。随着负载量的增多,CO2的吸附性能呈现先增大后减少的趋势,在50PEI/SiO2的吸附量可达3.00 mmol·g-1-adsorbent。进一步提高PEI负载量至60%后,吸附剂的CO2吸附量下降到2.85 mmol·g-1-adsorbent。值得注意的是,如果将吸附性能以PEI负载量计算,如表 2所示,50PEI/SiO2的吸附性能可达6 mmol·g-1-PEI,也就是说,负载后的吸附剂比纯胺的CO2吸附性能提高了约3.4倍。因此SiO2的作用是使得有机胺充分分散,有利于CO2与有机胺的接触和反应,从而提高了CO2的吸附性能。
|
图 5 不同有机胺负载量对CO2吸附量的影响 Fig.5 Effects of PEI loading on CO2 adsorption |
| 表 2 不同PEI负载量的PEI/SiO2吸附剂的CO2吸附性 Table 2 CO2 adsorption capacities of SiO2 with various PEI loadings |
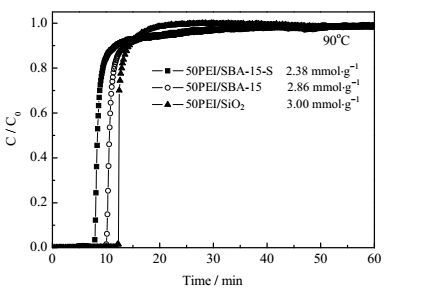
有机胺修饰的SBA-15用于CO2捕捉近年来报道较多[21, 22]。如前文所述,有机胺负载在SBA-15上的步骤较为繁琐,需经过超声、加热冷凝回流,炒干等步骤。为了考察氧化硅载体与SBA-15载体的差别,图 6给出了50PEI/SiO2吸附剂与传统湿法浸渍方法负载的PEI负载量为50%的SBA-15吸附剂(50PEI/SBA-15) 以及用快速搅拌方法制备的PEI负载量为50%的SBA-15吸附剂(50PEI/SBA-15-S)的穿透曲线。由图 6可以看出,在相同的吸附条件下50PEI/SBA-15的CO2吸附量为2.86 mmol·g-1-adsorbent,而50PEI/SiO2的CO2吸附量可达3.00 mmol·g-1-adsorbent。此外采用快速搅拌的方法将PEI负载在SBA-15载体上制备的50PEI/SBA-15-S吸附剂的CO2的吸附量仅为2.38 mmol·g-1-adsorbent,这有可能是因为采用快速搅拌的方法,胺难以充分进入SBA-15的介孔孔道中,导致吸附剂的CO2吸附性能下降。而SiO2由于粒子非常小,几乎不存在内孔,通过快速搅拌即可以将PEI较好地分散在SiO2表面,从而具有较好的吸附性能。此外由于PEI/SiO2型吸附剂有成本低、制备简单等优点,因此相比较于SBA-15基吸附剂具有更大的潜在实用价值。
|
图 6 50PEI/SiO2、50PEI/SBA-15-S和50PEI/SBA-15的CO2穿透曲线 Fig.6 CO2 breakthrough curves of 50PEI/SiO2, 50PEI/SBA-15-S and 50PEI/SBA-15 adsorbents |
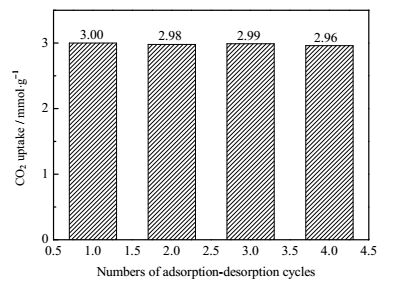
为了满足工业上的实际需要,吸附剂还应该具有良好的稳定性。以50PEI/SiO2样品为例,通过吸附-脱附循环实验考察了吸附剂的稳定性。图 7给出了吸附剂重复四次吸附-脱附的实验结果,从图中可以看出,在反复吸附-脱附四次后样品的吸附量没有发生明显的变化,图 3的热重表征曲线也表明PEI在300℃以下基本稳定,所以制备的吸附剂具有良好的稳定性及可再生性。
|
图 7 50PEI/SiO2吸附剂循环实验 Fig.7 CO2 uptake of 50PEI/SiO2 in 4 adsorption-desorption cycles |
采用高速搅拌法将PEI负载到SiO2载体上制备了固态胺吸附剂,这种吸附剂的制备方法快捷、简单,无需使用溶剂,且成本大大降低。采用穿透曲线法对吸附剂的CO2吸附性能进行了测试。结果表明,随着有机胺PEI负载量的增加,PEI/SiO2型吸附剂CO2的吸附量是先增大后减少的趋势,50PEI/SiO2吸附剂的CO2吸附量最大;随着温度的升高,吸附剂的CO2吸附性能呈先增大后减小的趋势,在90℃吸附量达到最大(3.00 mmol·g-1-adsorbent),且比常见的PEI/SBA-15吸附剂具有更优的吸附性能。所以采用快速搅拌法将PEI负载到SiO2载体上制备的固态胺吸附剂,对CO2的脱除具有一定的应用前景。
| [1] | Liu L, Deng Q F, Ma T Y, et al. Ordered mesoporous carbons:citric acid-catalyzed synthesis, nitrogen doping and CO2 capture[J]. Journal of Materials Chemistry , 2011, 21(40): 16001-16009. DOI:10.1039/c1jm12887f. |
| [2] | Samanta A, Zhao A, Shimizu G K H, et al. Post-combustion CO2 capture using solid sorbents:a review[J]. Industrial & Engineering Chemistry Research , 2012, 51(4): 1438-1463. |
| [3] | JIANG Ning(姜宁), DENG Zhi-yong(邓志勇), WANG Gong-ying(王公应), et al. The preparation of metal organic framework materials and the application in the separation of CO2 adsorption(金属有机框架材料的制备及在吸附分离CO2中的应用)[J]. Progress In Chemistry(化学进展) , 2014, 26(10): 1645-1654. |
| [4] | ZHOU Ling-yun(周凌云), FAN Jing(樊静), WANG Jian-ji(王键吉). Ionic liquid CO2 capture(离子液体捕集CO2)[J]. Progress In Chemistry(化学进展) , 2011, 23(11): 2270-2275. |
| [5] | Pramod C V, Upenday K, Mohan V, et al. Hydrotalcite SBA-15 composite material for efficient carbon dioxide capture[J]. Journal of CO2 Utilization , 2015, 12: 109-115. DOI:10.1016/j.jcou.2015.05.002. |
| [6] | Kishor R, Ghoshal A K. N-1-(3-trimethoxysilylpropyl)diethylenetriamine grafted KIT-6 for CO2/N2 selective separation[J]. RSC Advances , 2016, 6(2): 898-909. DOI:10.1039/C5RA20489E. |
| [7] | Loganthan S, Tikmani M, Ghoshal A K. Pore-expanded MCM-41 for CO2 adsorption:experimental and isotherm modeling studies[J]. Chemical Engineering Journal , 2015, 280: 9-17. DOI:10.1016/j.cej.2015.05.103. |
| [8] | Sanz R, Calleja G, Arencibia A, et al. CO2 capture with pore-expanded MCM-41 silica modified with amino groups by double functionalizaiton[J]. Microporous And Mesoporous Materials , 2015, 209: 165-171. DOI:10.1016/j.micromeso.2014.10.045. |
| [9] | Belmabkhout Y, Serna-Guerrero R, Sayari A. Adsorption of CO2-containing gas mixtures over amine-bearing pore-expanded MCM-41 silica:application for gas purification[J]. Industrial & Engineering Chemistry Research , 2010, 49(1): 359-365. |
| [10] | Han J, Du Z, Zou W, et al. Moisture-responsive hydrogel impregnated in porous polymer foam as CO2 adsorbent in high-humidity flue gas[J]. Industrial & Engineering Chemistry Research , 2015, 54(31): 7623-7631. |
| [11] | Lee M S, Park S J. Silica-coated multi-walled carbon nanotubes impregnated with polyethyleneimine for carbon dioxide capture under the flue gas condition[J]. Journal of Solid State Chemistry , 2015, 226: 17-23. DOI:10.1016/j.jssc.2015.01.031. |
| [12] | Liu F Q, Li W, Zhao J, et al. Covalent grafting of polyethyleneimine on hydroxylated three-dimensional grapheme for superior CO2 capture[J]. Journal of Materials Chemistry A , 2015, 3(23): 12252-12258. DOI:10.1039/C5TA01536G. |
| [13] | Farhang F, Nguyen T D, Nguyen A V. Non-destructive high-resolution X-ray micro computed tomography for quantifying dry water particles[J]. Advanced Powder Technology , 2014, 25(4): 1195-1204. DOI:10.1016/j.apt.2014.06.006. |
| [14] | Park J, Shin K, Kim J, et al. Effect of hydrate shell formation on the stability of dry water[J]. The Journal of Physical Chemistry C , 2015, 119(4): 1690-1699. DOI:10.1021/jp510603q. |
| [15] | Binks B P, Murakami R. Phase inversion of particle-stabilized materials from foams to dry water[J]. Nature Materials , 2006, 5(11): 865-870. DOI:10.1038/nmat1757. |
| [16] | Farhang F, Nguyen A V, Sewell K B. Fundamental investigation of the effects of hydrophobic fumed silica on the formation of carbon dioxide gas hydrates[J]. Energy & Fuels , 2014, 28(11): 7025-7037. |
| [17] | Dawson R, Stevens L A, Williams O S A, et al. "Dry bases":carbon dioxide capture using alkaline dry water[J]. Energy & Environmental Science , 2014, 7(5): 1786-1791. |
| [18] | Podenko L S, Nesterov A N, Drachuk A O, et al. Formation of propane hydrates in frozed dry water[J]. Russian Journal of Applied Chemistry , 2013, 86(10): 1509-1514. DOI:10.1134/S1070427213100078. |
| [19] | Yao M L, Dong Y Y, Hu X, et al. Tetraethylenepentamine-modified silica nanotubes for low-temperature CO2 capture[J]. Energy & Fuels , 2013, 27(12): 7673-7680. |
| [20] | Yao M L, Dong Y Y, Feng X X, et al. The effect of post-processing conditions on aminosilane functionalizaiton of mesocellular silica foam for post-combustion CO2 capture[J]. Fuel , 2014, 123(5): 66-72. |
| [21] | Wang X X, Schwartz V, Clark J C, et al. Infrared study of CO2 sorption over "molecular basket" sorbent consisting of polyethylenimine-modified mesoporous molecular sieve[J]. The Journal of Physical Chemistry C , 2009, 113(17): 7260-7268. DOI:10.1021/jp809946y. |
| [22] | Wang X X, Ma X L, Song C S, et al. Molecular basket sorbents polyethylenimine-SBA-15 for CO2 capture from flue gas:Characterization and sorption properties[J]. Microporous Mesoporous Materials , 2013, 169(169): 103-111. |




