沼气发酵是在厌氧环境下,微生物将秸秆等生物质中的有机质降解产生沼气的过程[1]。而沼气一般含50%~70% CH4,30~50% CO2,1~12 g·m-3的H2S和少量水等,其可燃爆成分主要是CH4[2]。在CH4/CO2/O2的混合气体中,CH4经过CO2惰化后,其最大氧安全体积分数为14.5%,即当O2体积分数超过14.5%时才可能发生爆炸;另一方面,常温常压下,CH4在空气中的爆炸极限为5%~15%,而CO2的存在可以缩小CH4的爆炸范围和降低其爆炸强度,且当混合气体中CO2含量超过17.26%时,CH4将失去爆炸性[3]。沼气可用于发电、作为民用燃料或车用燃料,相应H2S的质量浓度必须分别控制在300、20、15 mg·m-3以下[2, 4],而H2S的存在,不仅直接影响沼气的利用效率,且极易腐蚀设备而缩短其使用寿命,更危害人体健康,污染环境。因此,沼气在综合利用前必须进行脱硫处理。传统的脱硫方法包括化学吸附、化学氧化、碱吸收及高温热氧化等。与其相比,生物法脱硫具有反应条件温和、工艺简单、脱硫率高、无需化学催化剂、低耗能、回收有价值的硫、经济效益高等优势,日益引起了国内外学者的关注[5-6]。
DÍAZ等经过一系列研究发现,向生物反应器内通入微量O2或空气,纯氧作为氧化剂较空气组(99%)有更高的脱硫效率[7-8]。RAMOS等[9-10]在进行微氧脱硫小试实验时,将沼气停留时间控制在57~107 min,发现系统中H2S含量甚微;对微生物群落分析发现发酵液中至少存在3种硫氧化菌,约60% H2S被氧化成S单质沉积在发酵瓶底部。KRAYZELOVA等[11]对制糖和造纸工业等废水进行微氧脱硫实验,发现将空气直接通入到厌氧发酵罐中使沼气被N2和O2稀释,沉积在发酵罐底的硫单质腐蚀器具。为解决此问题,KRAYZELOVA等[12]采用带生物膜的全混合厌氧反应器进行微曝气的中试实验,发现甲烷的损失率仅为3.7%,适宜的通氧量为理论需氧量的2.5倍(即式(1)中O2与H2S化学计量比的5倍)。VALDES[13]将硅胶膜放入连续厌氧固定床反应器中进行纯氧氧化硫化物,结果硫元素去除率达96%,产物中除S单质外,硫酸盐和硫代硫酸盐分别占27.9%、25.5%,反应式如下[14]:
| $ {\text{2}}{{\text{H}}_{\text{2}}}{\text{S + }}{{\text{O}}_{\text{2}}} \to {\text{ 2}}{{\text{H}}_{\text{2}}}{\text{O + 2S}}, \Delta {G^Ɵ } = -209.4\;{\text{kJ} \times \text{mo}}{{\text{l}}^{{\text{ - 1}}}} $ | (1) |
| $ {{\text{H}}_{\text{2}}}{\text{S + 2}}{{\text{O}}_{\text{2}}}{\text{ }} \to {\text{SO}}_4^{2 - }{\text{ + 2}}{{\text{H}}^ + }, \Delta {G^Ɵ } = - 798.2\;{\text{kJ}} \times {\text{mo}}{{\text{l}}^{ - 1}} $ | (2) |
此前,已经建立了一套利用微氧法原位脱硫净化沼气的小试装置,并取得初步研究成果[2, 15],但该装置中O2通入未实现连续化,且脱硫效率有待提高,缺乏对工业应用的指导意义。然而,关于连续通氧对发酵过程及微生物群落变化在国内鲜有文献报道[16-17],因此,本文在前期工作的基础上,重新设计并建立了能实现O2连续通入沼气厌氧发酵体系的中试装置,以水稻秸秆为发酵底物,探索沼气连续微氧发酵过程中通氧量对H2S原位脱除及微生物群落特征的影响,为实际生产中微氧发酵原位脱硫提供理论指导。
2 材料与方法 2.1 实验材料本实验使用的水稻秸秆(使用前粉碎)取自江苏省宿迁市归仁镇敦伦村,总固体(TS)为(93.3±0.2)%,挥发性固体(VS)为(84.5±0.4)%。沼液取自杭州正兴牧业有限公司浙江大学奶业科学研究所实验牧场,TS为(3.0±0.2)%,VS为(1.8±0.2)%。
2.2 实验装置及说明实验装置如图 1所示,实验采用容积为30 L带搅拌的序批式发酵罐,一侧装有可拆卸的pH电极,并可从设备控制面板上直接读取沼液的pH。热水循环系统控制发酵温度(55±0.1) ℃),并由热电偶测定与显示。将963.0 g水稻秸秆、12 L沼液和8 L水依次装入发酵罐中,控制TS为(8.0±0.1)%,调节pH至中性,搅拌强度设置为100 r·min-1。待发酵罐密封后,向其内通入N2驱赶罐内残留空气,使之完全处于厌氧环境。来自钢瓶的O2首先连接转子流量计,用于初步控制和稳定O2的流量,经蠕动泵计量后由分气头均匀分流至发酵瓶中。其中蠕动泵流量由皂膜流量计预先校验。根据前期预实验测得的沼气产量及H2S含量,控制O2的通入量分别为75 mL·L-1·d-1 (相当于按式(1)计算量的1倍量)、150 mL·L-1·d-1 (2倍量)、225 mL·L-1·d-1 (3倍量),并设置不通O2的对照实验,每组各设3个平行。发酵周期为30天,通过顶空集气法收集沼气,并记录日产气量,累计产气量由沼气日产气量相加而得。
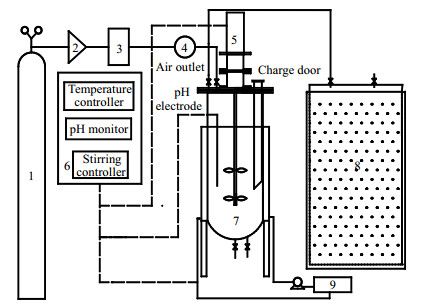
|
图 1 沼气发酵实验装置示意图 Fig.1 Schematic diagram of the experimental setup for biogas fermentation 1. O2 cylinder 2. rotor flow meter 3. peristaltic pump 4. split head 5. magnetic stirrer 6.operating device 7. anaerobic fermentation tank 8. gas gathering cabinet 9. hot water circulation tank |
采用美国公共卫生协会(APHA)水和废水检验的标准方法[18]测定秸秆和沼液的TS、VS;采用气相色谱(GC-6890N,Agilent)和热导检测器((TCD)测定沼气中CH4、CO2、O2的体积分数;采用气相色谱(GC-2014,岛津)和硫磷检测器(FPD)测定沼气中H2S;采用气相色谱(GC-6890N,Agilent)和火焰离子化检测器(FID)测定沼液中挥发性脂肪酸(VFAs)的浓度;采用重铬酸钾法(GB11914-89)测定沼液的化学需氧量(COD);采用高通量测序技术(Miseq)鉴别沼液中微生物群落。
3 结果与讨论 3.1 通氧量对沼气发酵的影响微氧条件下沼气发酵系统中累积产气量如图 2所示。由图可知,发酵启动后,快速进入水解酸化阶段,产气速率较大,并于第9 d产气趋于平缓。通氧量为75、150 mL·L-1·d-1的实验组较对照组的总产气量(605.65 L·L-1)略有增加,分别为636和634 L·L-1,通氧量增大至225 mL·L-1·d-1时,总产气量略有下降,为597 L·L-1,表明适量的通氧量对沼气总产气量影响不大。发酵平稳期沼气的总产气量如图 3所示,当通入微量O2后,发酵平稳期的总产气量(发酵第10至第20 d的日产气量总和)均略高于对照组。当通氧量为75 mL·L-1·d-1时,总产气量高出对照组约6%,当通氧量为150 mL·L-1·d-1时,总产气量较对照组高出约23%。有文献表明,微量O2的存在有利于提高发酵底物中的纤维素、半纤维素、木质素等难降解成分的水解速率,从而增加沼气的产气量[19]。然而,当通氧量达到225 mL·L-1·d-1时,沼气的总产气量呈现出略微降低趋势,但仍高出对照组约12%,表明适量的O2通入发酵系统不会影响厌氧发酵,反而能促进底物水解。
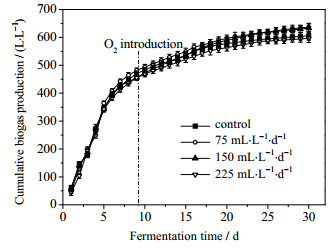
|
图 2 沼气累积产气量 Fig.2 Cumulative profiles of biogas production |
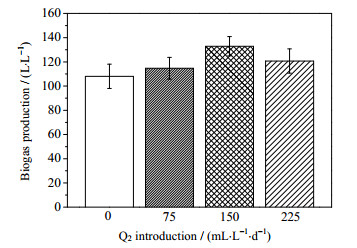
|
图 3 发酵平稳期沼气的总产气量 Fig.3 Total biogas production during the stable fermentation period |
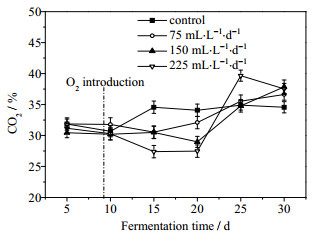
沼气中CH4及CO2体积分数的变化分别如图 4、图 5所示。由图 4可知,未通入O2时CH4的体积分数相对较低,但随着发酵的进行,CH4的体积分数逐渐升高最后稳定在64%左右。通入O2 (发酵第9 d)后,实验组中CH4体积分数略低于对照组,但随着发酵的进行,CH4的体积分数逐渐超过对照组,可能是刚通入O2对严格厌氧的产甲烷菌产生轻微的抑制,随着发酵进行这种影响逐渐消除。结合图 5可知,CO2的体积分数较CH4的体积分数有着相反的变化趋势。发酵进行到第20 d以后,实验组中CH4的体积分数明显低于对照组,而CO2体积分数有所上升,可能是由于O2的存在使底物快速降解而得不到及时补充,H2S的日产量下降,而各实验组通氧量维持不变,导致相对过量的O2残留在发酵体系中,从而使发酵体系中严格厌氧的产甲烷菌开始受到较明显的抑制,而兼性厌氧菌和好氧菌较活跃。尤其在发酵第25 d,通氧量为225 mL·L-1·d-1时,CH4的体积分数达到最低,相较对照组降低约9.26%,CO2体积分数达到最高,较对照组增加约13.6%。可能是因为发酵体系中累积的O2抑制了产甲烷菌的活性,同时,相对过量O2提高了兼性厌氧菌和好氧菌的活性,使得CO2体积分数有所上升。因此,在工程应用中需严格控制O2通入量,避免影响沼气发酵。
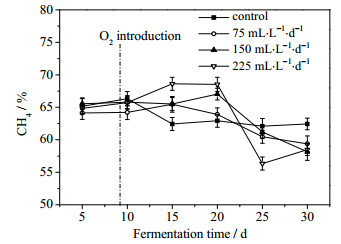
|
图 4 沼气中CH4体积分数的变化 Fig.4 Variation of methane contents in biogas |
|
图 5 沼气中CO2体积分数的变化 Fig.5 Variation of carbon dioxide contents in biogas |
发酵平稳期沼气各组分含量见表 1,通O2量为75 mL·L-1·d-1时,CH4体积分数稳定在64.5%左右,甲烷产量增加约7%。当通O2量达到150 mL·L-1·d-1时,CH4体积分数约为66.1%,甲烷产量较对照组增加约28%。当通O2量达到225 mL·L-1·d-1时,CH4体积分数约66.8%,达到最大,此时甲烷产量较通氧量为150 mL·L-1·d-1时略有下降,但仍然高出对照组约17%。相关研究表明,厌氧发酵体系中存在过量的H2S会影响产甲烷菌的活性,通入微量的O2后,O2主要作为H2S氧化的电子受体,不仅达到将其从厌氧发酵体系中脱除的目的,同时也降低了其对产甲烷菌活性的抑制作用,从而有促进了产甲烷菌对底物的分解,提高了CH4的体积分数[20],因而发酵平稳期甲烷体积分数均高于对照组。同时,可能由于气液传质不佳、通氧量一定,随着H2S浓度的减少,导致一部分O2不能被兼性厌氧菌和硫氧化细菌充分利用而残留在沼气中,致使发酵系统中O2的体积分数随着通氧量的增加而升高,从而稀释了甲烷的体积分数,因此出现CH4的产量相对通O2量为150 mL·L-1·d-1时略有下降的现象。实验组中CH4和CO2的体积分数均分别高于、低于对照组中相应的体积分数,表明此阶段O2通入,并未对严格厌氧的产甲烷菌产生抑制作用。
|
|
表 1 发酵平稳期沼气各组分含量 Table 1 Contents of biogas in stable fermentation period |
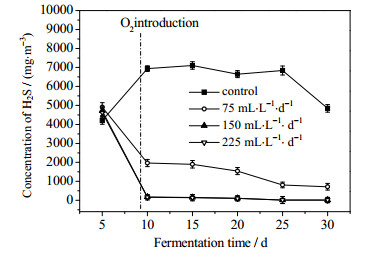
通氧条件下沼气中H2S浓度变化如图 6所示,发酵启动后,对照组中H2S浓度呈现出明显的上升趋势,随着发酵的持续进行,沼气中H2S浓度维持在相对稳定的状态,发酵后期其浓度明显下降。分析原因,可能是发酵前期,底物充足,产酸产氢过程中蛋白质水解转化为H2S,而随着发酵的进行,蛋白质水解减弱,逐渐进入产甲烷阶段,而发酵后期发酵底物不足,从而导致H2S浓度下降。在发酵第9天通入O2后,实验组中H2S浓度快速下降,维持在2 000 mg·m-3以下,且通氧量为150、225 mL·L-1·d-1时的H2S浓度远低于通氧量为75 mL·L-1·d-1时的浓度,表明适量的通氧量可将系统中H2S脱除而不影响发酵。
|
图 6 沼气中H2S浓度变化 Fig.6 Variation of hydrogen sulfide contents in biogas |
通氧条件下沼气发酵过程中H2S去除效果如表 2所示,由对照组数据可知沼气发酵在第10至第22 d中硫化氢的浓度波动不大,维持在6 500~7 000 mg·m-3,此阶段通氧量较易控制,H2S能够被充分氧化,从而达到更好脱硫目的。当通入氧量为75 mL·L-1·d-1时,发酵第20天H2S脱除效率仅为76.8%,说明通氧量未能到达氧化H2S实际需求量。随着通氧量增加,H2S脱除效率逐渐提高,最大达到98.5%,但通氧量从150增加到225 mL·L-1·d-1时H2S脱除效率增加不明显。连续通入O2与间歇通入O2的实验相比[2, 15],H2S的脱除效率有进一步提高,说明连续通O2的方式可促进O2与H2S的充分接触,从而提高脱硫效率。仅从脱硫角度看,通氧量为225 mL·L-1·d-1时效果更好,但实际应用中还需考虑氧气残留情况。
|
|
表 2 沼气发酵过程中H2S的去除 Table 2 H2S removal from biogas during fermentation processes |
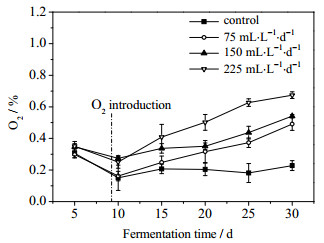
沼气中O2的体积分数变化如图 7所示,向发酵罐中通入O2后,H2S浓度快速降低,而实验组中的O2体积分数随着通氧量增加而升高,且均略高于对照组。当通氧量为75、150 mL·L-1·d-1时,沼气中O2体积分数低于相关标准(0.5%),而通氧量达225 mL·L-1·d-1时,沼气中O2体积分数明显超过0.5%,且此时H2S脱除效率较通氧量为150 mL·L-1·d-1时无明显提高。一方面可能是发酵过程中兼性厌氧微生物和硫氧化细菌利用O2的能力有限,同时异氧甲烷菌竞争O2,另一方面可能由于气液传质的限制作用[12],导致通入的O2不能完全用于脱除H2S而残留在沼气中。发酵进行到第20天后,实验组O2体积分数均明显高于对照组,可能是由于发酵底物已消耗较多,致使体系中的沼气日产气量快速降低,H2S日产量也快速减少,而通O2量维持不变,从而导致较多的O2残留在沼气中。
|
图 7 沼气中O2体积分数的变化 Fig.7 Variation of oxygen contents in biogas |
实验采用微氧法原位脱硫,沼气中O2体积分数一直维持在0.6%以下,CO2体积分数在24.48%~39.67%,因此不会有安全隐患。通氧量为150 mL·L-1·d-1时可取得较好的脱硫效果,同时将O2体积分数控制在0.5%以下,这为沼气原位脱硫的应用提供一定的指导,即在利用微氧法原位脱硫的过程中,应根据H2S的产量控制好通氧量。
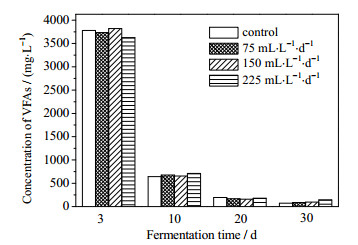
3.3 通氧量对沼气发酵液中VFAs、pH和COD的影响发酵液中的VFAs浓度变化见表 3,由表可知,发酵第3天系统中乙酸占极大优势,分析原因可能是在高温条件下产氢产乙酸菌快速将水解产生的各种有机酸(如丁酸、丙酸等短链挥发性脂肪酸)和乙醇等水溶性小分子有机物转化为乙酸、H2和CO2[21],故大量乙酸存在于发酵液中。通入O2后(即发酵第10 d),实验组中乙酸浓度均略高于对照组,原因可能是O2的通入使严格厌氧菌活性受到了轻微抑制,导致底物中乙酸浓度较高。实验组中乙酸、丙酸、异丁酸、正丁酸的浓度随着发酵的进行均逐渐降低,表明通入微量O2对VFAs的降解未造成明显的抑制。
|
|
表 3 发酵液中VFAs浓度变化 Table 3 Variation of VFAs concentration in biogas slurry (mg·L-1) |
发酵液中总VFAs浓度变化如图 8所示,随着通氧量的增加,实验组中总VFAs浓度并未呈线性增加,而各组总VFAs浓度均略高于对照组,可能是O2的通入使严格厌氧菌活性受到了轻微抑制,导致底物降解缓慢。随着发酵的进行,各组总VFAs浓度均逐渐降低。发酵结束时,通氧量为150和225 mL·L-1·d-1时发酵液中总VFAs浓度均略高于对照组,而当通氧量为75 mL·L-1·d-1的总VFAs浓度低于对照组。同时,整个实验组中VFAs的降解趋势并未受到明显的影响,表明适量的O2通入有利于发酵底物的降解。原因可能是通入O2后,沼气中H2S被大量脱除从而加强了产甲烷菌的活性,促使底物降解,使得VFAs浓度低于对照组;通氧量为150和225 mL·L-1·d-1时,发酵后期相对过量的O2对产甲烷菌产生轻微抑制而好氧菌及兼性厌氧菌较活性,导致VFAs未能及时降解而高于对照组。
|
图 8 发酵液中总VFAS浓度变化 Fig.8 Variation of total VFAs concentration in biogas slurry |
发酵液的pH随发酵时间的变化如表 4所示,发酵平稳期对照组及实验组发酵液的pH均呈现出上升的趋势,可能是因为发酵液中的VFAs不断降低。随着通氧量的增加,pH并未随之增加,始终维持在7.0~8.5。文献表明,适宜沼气厌氧发酵pH介于6.5~8.5,pH低于6或者高于8.5都将对沼气发酵产生影响[4]。因此,通氧量从75升至225 mL·L-1·d-1时并未对沼气发酵产生负面的影响。当通O2量达到225 mL·L-1·d-1时,发酵结束后沼液pH为发酵期内的最低值,可能是由于发酵后期相对过量O2通入使VFAs的降解受到抑制,导致发酵液中VFAs轻微积累。
|
|
表 4 发酵液的pH随时间的变化 Table 4 Variation of pH in biogas slurry during fermentation |
对发酵开始和结束时的沼液进行测定,其中COD及TS的去除情况见表 5,随着通氧量的增加,沼液中COD的去除率由36.3%增加到61.9%,TS的去除率51.3%增加到66.3%,表明微量的O2通入发酵罐中有利于底物中有机质的分解,与RODRÍGUEZ等的研究结果一致[20]。
|
|
表 5 沼液中COD、TS的去除 Table 5 Removal of COD and TS from biogas slurry |
|
|
表 6 古菌与细菌多样性指数分析 Table 6 Diversity index analysis of Archaea and bacteria |
|
|
表 7 发酵液中古菌与细菌在目水平上的组成 Table 7 Composition of Archaea and bacteria at order level |
沼气发酵系统中细菌、产甲烷菌(大多属于古菌)分别在水解酸化、甲烷化中起重要作用,有研究认为发酵条件不同,沼气发酵系统中微生物群落结构也不同[22]。样品采用PCR方法分别扩增古菌基因的V4~V5区、细菌16S rRNA的V3~V4区进行MiSeq测序,分析连续适量的通氧量对微生物群落的影响,为发酵应用提供理论指导。其中实验组通氧量为150 mL·L-1·d-1。
对古菌与细菌多样性指数分析,如表 6所示。样品的测序深度(Coverage)指数具有较高的值,均大于99%,变化趋势较为平缓,说明测序数据量足够大,足以反应绝大多数的微生物信息。对比样本的丰度(Chao)指数,结果显示,通氧量为150 mL·L-1·d-1时,实验组古菌丰度略低于对照组,而细菌的丰度高于对照组。说明适度通氧会降低古菌丰度,提高细菌丰度,可能会对发酵产生不利影响。从多样性(Shannon)指数可知,古菌和细菌的总单元(OTU)分别在1、3附近波动,说明发酵过程中古菌和细菌的多样性变化不大,总体较稳定,与RAMOS等的研究具有一致性[23]。
发酵液中古菌和细菌在目水平上物种组成如表 7所示。MiSeq测序分析结果表明,沼气发酵系统中,古菌主要由Thermoplasmatales、Methanomicrobiales、Methanosarcinales、Methanobacteriales,4个物种组成。细菌主要由Haloplasmatales、norank_c__Clostridia、Bacteroidales、Thermoanaerobacterales、Synergistales、Clostridiales、MBA03等7个物种组成。
古菌群落中,属于Methanobacteriales和Methanosarcinales目的微生物占据优势地位,发酵液中两者含量分别占30%、50%以上。与对照组相比,当通入氧气量150 mL·L-1·d-1时,Methanobacteriales的含量有所减少,由63.89%减少至55.81%,Methanosarcinales由30.75%增加到41.55%,而其他目的微生物变化不大。有文献表明,属于Methanobacteriales目的菌群通常属氢营养型产甲烷菌,利用H2将CO2还原成CH4,该目的一些菌群还可以利用甲酸酯、CO或仲醇作为电子供体还原CO2。属于Methanosarcinales目的菌群有广泛的产甲烷底物,大多可以通过H2还原CO2来生长,也可通过歧化甲基化合物或分解乙酸酯来生长[24]。说明通入适量的O2可改变古菌物种的组成,有利于增加产甲烷底物,从而有利于提高沼气和甲烷的产量。
发酵液中细菌主要分布在Clostridiales和MBA03目中,其中Clostridiales目的微生物含量占70%以上,处主导地位。文献表明,Clostridiales是一种严格厌氧的水解发酵细菌,最新研究将丁酸降解菌划分为该目下的属[25]。通入O2后,Clostridiales含量相比对照组略微下降,实验测得异丁酸的浓度高于对照组,说明通氧对Clostridiales目下的细菌产生一定的影响,从而导致异丁酸的降解受到轻微抑制。而发酵后期,实验组中正丁酸、异丁酸的浓度均略高于对照组,可能是由于后期相对过量的O2影响了属于该目下丁酸降解菌的活性,导致丁酸的降解受到影响。通过对比可以发现,发酵系统内通入O2后,实验组中细菌的群落明显多于对照组,且实验组中出现了新的物种Haloplasmatales,查阅相关文献可知Haloplasmatales是一种不寻常的来自深海缺氧盐湖的喜盐细菌[26]。结果表明,适量的通氧量可改变细菌的物种组成,有利于细菌多样性的增加。
4 结论(1) 连续通入微量O2后,发酵平稳期(第10至第20 d)沼气总产气量、甲烷产量及甲烷体积分数较对照组均有所增加,但与O2通入量不成正比。与对照组相比,通氧量为75 mL·L-1·d-1时,总产气量提高约6%;通氧量为150 mL·L-1·d-1 (即通氧量为理论需氧量的2倍)时,总产气量提高约23%,此时提高的甲烷产量在实验组中达最大,高出对照组约27%。;当通氧量达到225 mL·L-1·d-1时,沼气的总产气量呈现略微降低趋势,但仍高出对照组约12%;适量的O2通入对厌氧发酵不会产生不利影响,反而有利于沼气产量和甲烷产量的提高。
(2) 发酵平稳期硫化氢的浓度波动不大,维持在6 500~7 000 mg·m-3。随着通氧量的增加,H2S的去除率也逐渐提高,通氧量为150 mL·L-1·d-1时,H2S脱除效率为98.0%,沼气中O2体积分数可控制在0.5%以下;通氧量提高到225 mL·L-1·d-1时H2S脱除效率增加不明显,且沼气中O2体积分数高于0.5%。
(3) 通入O2后,实验组中VFAS的降解趋势并未受到明显的影响;随着通氧量的增加,发酵液的pH并未随之增加,但始终维持在7.0~8.5;沼液中COD及TS的降解率均随着通氧量的增加而升高,表明适量O2的通入有利于底物的降解。
(4) MiSeq测序表明,适量O2通入厌氧发酵系统后,古菌和细菌的群落多样性仅有轻微的变化,总体较稳定;从目水平上对微生物的物种组成分析,Methanobacteriales、Clostridiales目的微生物分别为古菌和细菌的优势物种,适量的O2可改变发酵系统中古菌和细菌的物种组成,有利于产甲烷底物和细菌种类的增加,从而提高甲烷产量。
| [1] |
田相龙, 王之婧, 刘晓勤, 等. 真空变压吸附提纯沼气中甲烷的过程模拟[J]. 高校化学工程学报, 2018, 32(1): 44-53. TIAN X L, WANG Z J, LIU X Q, et al. Simulation on vacuum pressure swing adsorption processes for CH4 separation from biogas[J]. Journal of Chemical Engineering of Chinese Universities, 2018, 32(1): 44-53. DOI:10.3969/j.issn.1003-9015.2018.01.007 |
| [2] |
WU M M, ZHANG Y M, YE Y Y, et al. In situ removal of hydrogen sulfide during biogas fermentation at microaerobic condition[J]. Applied Biochemistry Biotechnology, 2016, 180(5): 1-9. |
| [3] |
钱新明, 郑远攀, 张应安, 等. 含CO2天然气的可燃极限与燃爆压力[J]. 爆炸与冲击, 2010, 30(5): 523-528. QIAN X M, ZHENG Y P, ZHANG Y A, et al. Flammable limits and combustion pressure of natural gas containing carbon dioxide[J]. Explosion and Shock Waves, 2010, 30(5): 523-528. |
| [4] |
WEILAND P. Biogas production:Current state and perspectives[J]. Applied Microbiology & Biotechnology, 2010, 85(4): 849-860. |
| [5] |
张明珠, 苏良湖, 张龙江, 等. 生物气脱硫技术及其研究进展[J]. 环境卫生工程, 2016, 24(6): 80-85. ZHANG M Z, SU L H, ZHANG L J, et al. Desulfurization technologies of biogas and its progress[J]. Environmental Sanitation Engineering, 2016, 24(6): 80-85. DOI:10.3969/j.issn.1005-8206.2016.06.024 |
| [6] |
吴檬檬, 于干, 林春绵. 沼气脱硫技术研究进展[J]. 可再生能源, 2012, 30(10): 73-78. WU M M, YU G, LIN C M. Research progress on biogas desulfurization technologies[J]. Renewable Energy, 2012, 30(10): 73-78. |
| [7] |
DIAZ I, LOPES A C, PEREZ S I, et al. Performance evaluation of oxygen, air and nitrate for the microaerobic removal of hydrogen sulphide in biogas from sludge digestion[J]. Bioresource Technology, 2010, 101(20): 7724-7730. DOI:10.1016/j.biortech.2010.04.062 |
| [8] |
DIAZ I, PEREZ S I, FERRERO E M, et al. Effect of oxygen dosing point and mixing on the microaerobic removal of hydrogen sulphide in sludge digesters[J]. Bioresource Technology, 2011, 102(4): 3768-3775. DOI:10.1016/j.biortech.2010.12.016 |
| [9] |
RAMOS I, PENA M, FDZ-POLANCO M. Where does the removal of H2S from biogas occur in microaerobic reactors[J]. Bioresource Technology, 2014, 166(8): 151-157. |
| [10] |
RAMOS I, PEREZ R, FDZ-POLANCO M. Microaerobic desulphurisation unit:A new biological system for the removal of H2S from biogas[J]. Bioresource Technology, 2013, 142(8): 633-640. |
| [11] |
KRAYZELOVA L, BARTACEK J, KOLESAROVA N, et al. Microaeration for hydrogen sulfide removal in UASB reactor[J]. Bioresource Technology, 2014, 172(9): 297-302. |
| [12] |
LUCIE P K, JAN B, NYAWIRA T S, et al. Microaeration through biomembrane for biogas desulfurization:Lab-scale and pilot-scale experiences[J]. Environmental Science Water Research & Technology, 2018, 4(8): 1190-1200. |
| [13] |
VALDES F, CAMILOTI P R, RODRIGUEZ R P, et al. Sulfide-oxidizing bacteria establishment in an innovative microaerobic reactor with an internal silicone membrane for sulfur recovery from waste water[J]. Biodegradation, 2016, 27(2/3): 119-130. |
| [14] |
KRAYZELOVA L, BARTACEK J, DIAZ I, et al. Microaeration for hydrogen sulfide removal during anaerobic treatment:A review[J]. Reviews in Environmental Science & Bio/technology, 2015, 14(4): 703-725. |
| [15] |
林春绵, 章祎玛, 叶媛媛, 等. 沼气的微氧法原位脱硫试验[J]. 浙江工业大学学报, 2017, 45(1): 37-42. LIN C M, ZHANG Y M, YE Y Y, et al. Microaerobic in-suit removal of hydrogen sulphide in biogas producing[J]. Journal of Zhejiang University of Technology, 2017, 45(1): 37-42. DOI:10.3969/j.issn.1006-4303.2017.01.008 |
| [16] |
RAMOS I, PEREZ R, FDZ-POLANCO M. The headspace of microaerobic reactors:Sulphide-oxidising population and the impact of cleaning on the efficiencey of biogas desulphurization[J]. Bioresource Technology, 2014, 158(4): 63-73. |
| [17] |
CARRERA-CHAPELA F, DONOSO-BRAVO A, JEISON D, et al. Development, identification and validation of a mathematical model of anaerobic digestion of sewage sludge focusing on H2S formation and transfer[J]. Biochemical Engineering Journal, 2016, 112(3): 13-19. |
| [18] |
CLESCERL L S. Standard method for the examination of water and wastewater[M]. 20th Ed. Washington D C: Amer Public Health Assn, 1998.
|
| [19] |
RAMOS I, FDZ-POLANCO M. Microaerobic control of biogas sulphide content during sewage sludge digestion by using biogas production and hydrogen sulphide concentration[J]. Chemical Engineering Journal, 2014, 250(4): 303-311. |
| [20] |
RODRIGUEZ E, LOPES A, FDZ-POLANCO M M, et al. Molecular analysis of the biomass of a fluidized bed reactor treating synthetic vinasse at anaerobic and micro-aerobic conditions[J]. Applied Microbiology & Biotechnology, 2012, 93(5): 2181-2191. |
| [21] |
侯成虎.混合发酵提高纤维素类废弃物厌氧消化过程研究[D].合肥: 合肥工业大学, 2013. HOU C H. Research on the enhancement of anaerobic digestion of cellulosic wastes by co-fermentation[D]. Hefei: HeFei University of Technology, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10359-1013377844.htm |
| [22] |
芮俊鹏, 李吉进, 李家宝, 等. 猪粪原料沼气工程系统中的原核微生物群落结构[J]. 化工学报, 2014, 65(5): 1868-1875. RUI J P, LI J J, LI J B, et al. Prokaryotic community structures in biogas plants with swine manure[J]. CIESC Journal, 2014, 65(5): 1868-1875. DOI:10.3969/j.issn.0438-1157.2014.05.044 |
| [23] |
Ramos I, Pérez R, Reinoso M, et al. Microaerobic digestion of sewage sludge on an industrial-pilot scale:The efficiency of biogas desulphurisation under different configurations and the impact of O2 on the microbial communities[J]. Bioresource Technology, 2014, 164(7): 338-346. |
| [24] |
de BRUIJN F J. Molecular microbial ecology of the Rhizosphere:Volume 1&2[J]. Dordrecht Kluwer Acad, 2013(1995): 1321-1560. |
| [25] |
王晋.厌氧发酵产酸微生物种群生态及互营关系研究[D].无锡: 江南大学, 2013. WANG J. Research of microbial community ecology and the trophic link during acidogenic fermentation[D]. Wuxi: Jiangnan University, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10295-1013242763.htm |
| [26] |
ANTUNES A. The family haloplasmataceae[M]. Berlin: Springer, 2014.
|




