2. 四川省攀西战略矿产资源综合利用协同创新中心, 四川 成都 610059
2. Collaborative Innovation Center of Panxi Strategic Mineral Resources Multi-Purpose Utilization, Chengdu 610059, China
K2SO4适用于忌氯喜钾的经济作物,也是生产无氯氮、磷、钾三元复合肥的主要原料。目前,我国钾盐主要依赖进口,因此,钾盐矿被国家列为急缺矿种之一。除固体钾矿外,在我国西藏(扎布耶盐湖)、青海(察尔汗盐湖)、新疆(罗布泊盐湖)、四川(川东-川中-川西及川东北-川西南-川西北地下卤水)、湖北(江陵凹陷地下卤水)等地区蕴藏有丰富的液态钾矿资源[1]。但由于卤水中共存离子较多,离子间相互作用关系复杂,给卤水综合利用带来一定困难。在水盐体系中加入高聚物或有机溶剂,利用盐析作用,使一些无机盐纯化,有望制备获得高纯度晶体[2]。相图是复杂多离子相互作用(溶解、析出)规律的图形化,研究可用于探索化工生产过程,指导液体矿产资源的综合利用工艺制定。因此,开展盐-混合溶剂体系相平衡研究对于盐类的提纯开发利用具有重要的意义。针对硫酸盐-混合溶剂体系的研究,URRÉJOLA等[3]对三元体系K2SO4 - C2H5OH - H2O (278, 288, 298, 308, 318) K进行了相平衡研究,测定了体系的溶解度。GRABER等[4]研究了Li2SO4 - PEG4000 - H2O体系在5、25、45 ℃温度下混合溶剂中的液液相平衡。MARTINS等[5]绘制了Na2SO4 / MgSO4 - PEG400 - H2O体系的双水相相图,并采用非随机双液体模型(NRTL)进行了理论计算。JIMENEZ等[6]完成了K2SO4 - CH3OH/C2H5OH/CH3COCH3 - H2O 288、318 K相平衡研究。XIE等[7]对Na+, K+ // SO42- - (CH2OH)2 - H2O、Na+, K+ // Cl-, SO42- - (CH2OH)2 - H2O 328.15 K体系进行了相平衡研究。综上可知,三元体系K2SO4 - PEG1000 - H2O相平衡研究尚未见报道。因此,本文开展K2SO4 - PEG1000 - H2O三元体系(288, 298, 308) K稳定相平衡实验研究。针对聚合物-盐-水体系的理论计算,WU等[8]对Pitzer方程进行了修正,将该方程的应用由水盐体系拓展至聚合物-盐-水体系。应用修正后的Pitzer方程,本课题组已完成了三元体系KCl - PEG1000/4000 - H2O[9-10]多温理论计算。以此为基础,采用修正后的Pitzer方程对三元体系K2SO4 - PEG1000 - H2O (288, 298, 308) K进行了理论计算。
2 实验(材料与方法) 2.1 实验材料与仪器 2.1.1 实验材料K2SO4(纯度99.5 %,国药集团化学试剂有限公司)在105 ~110 ℃干燥2 h,冷却后置于干燥器中备用;聚乙二醇1000(成都科龙化工试剂厂,纯度99.0 %);实验室用水均为去离子水κ ≤ 1.5×10-4 S·m-1,使用前煮沸除去CO2。
2.1.2 实验仪器PRACTUM224-1CN电子分析天平(赛多利斯科学仪器(北京)有限公司,精度± 0.000 1 g);WYA型阿贝折射仪(上海仪电物理光学仪器公司,精度± 0.000 1);SHH250恒温箱(重庆英博实验仪器有限公司,精度± 0.1 K);HZS - HA型水浴振荡器(精度± 0.2 K);HH - 501数显超级恒温水浴锅(常州国华电器有限公司,精度± 0.2 K);JK-DMS-S数显磁力搅拌器(上海精密科学仪器有限公司)。
2.2 实验方法在平衡管中按照不同质量比配制一系列醇水混合溶液作为初始溶液,在初始液加入一定量的K2SO4,所配试液置于恒温箱中,采用磁力搅拌器搅拌,整个过程平衡管中需保持盐过量,恒温搅拌72 h后,停止搅拌,静置24 h,分取湿固渣和液相分析其化学组成,测定液相物化性质(密度、折光率)。平衡液相密度和折光率分别采用称量瓶法和阿贝折光仪测定。
2.3 分析方法平衡固相组成采用Schreinemakers湿渣法[11]。K+采用四苯硼钠-季铵盐返滴定法测定[12],根据实验测得K+含量计算得到K2SO4含量。CHELUGET等[13]发现在盐-聚合物-水双水相体系中,溶液的折光率与盐和聚合物的质量分数存在式(1)关系:
| $ {n_{\mathop{\rm D}\nolimits} } = {a_0} + {a_1}w({{\mathop{\rm K}\nolimits} _2}\rm S{\rm O_4}) + {a_2}w({\mathop{\rm PEG}\nolimits} 1000) $ | (1) |
式中:nD为溶液的折光率,a0为纯水的折光率,当温度为298 K时,a0=1.332 5;a1和a2为拟合系数,其值分别为:0.113 7,0.133 0;w(K2SO4)为溶液中K2SO4的质量分数,w(PEG1000)为溶液中PEG1000的质量分数。
3 实验结果与讨论 3.1 三元体系K2SO4 - PEG1000 - H2O (288, 298, 308) K实验相平衡K2SO4 - PEG1000 - H2O三元体系在温度(288, 298, 308) K时平衡液相的溶解度、湿固相组成及溶液物化性质(密度、折光率)测定结果列于表 1,实验相图如图 1~3所示。
|
|
表 1 三元体系K2SO4- PEG1000 - H2O (288, 298, 308) K溶解度、密度、折光率和盐析率数据 Table 1 Solubilities, densities ρ, refractive indices nD, and salting-out ratio R of the ternary system K2SO4(s) - PEG1000(p) - H2O at (288, 298, and 308) K |
|
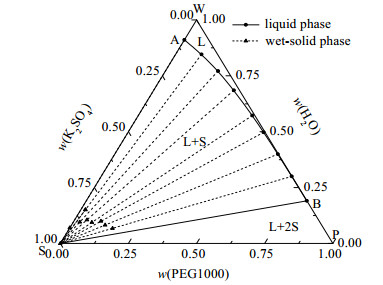
图 1 三元体系K2SO4 - PEG1000 - H2O 288 K相图 Fig.1 Phase diagram of the ternary system K2SO4 - PEG1000 - H2O at 288 K |
|
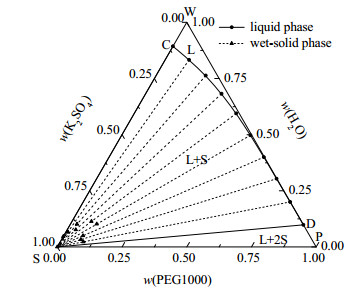
图 2 三元体系K2SO4 - PEG1000 - H2O 298 K相图 Fig.2 Phase diagram of the ternary system K2SO4 - PEG1000 - H2O at 298 K |
|
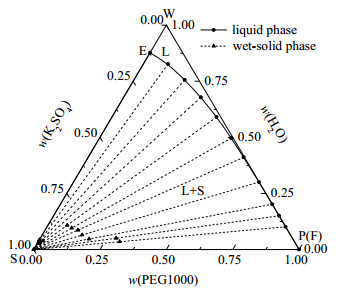
图 3 三元体系K2SO4 - PEG1000 - H2O 308 K相图 Fig.3 Phase diagram of the ternary system K2SO4 - PEG1000 - H2O at 308 K |
(1) 点A、C、E分别表示(288, 298, 308) K时K2SO4在纯水中的溶解度;点B、D、F分别表示(288, 298, 308) K时PEG1000在纯水中的饱和含量。点S、W、P分别是纯盐、纯水和纯PEG1000点。
(2) 单变量曲线AB、CD、EF分别代表在(288, 298, 308) K时K2SO4在PEG1000 - H2O混合溶剂中的饱和溶解度曲线。
(3) 当温度(288, 298, 308) K时,三元体系K2SO4 - PEG1000 - H2O只存在固液相平衡,无液液相平衡存在。当温度为288和298 K时,该体系平衡相图由不饱和液相区(L)、一固一液区(S + L)和两固一液区(2S + L)构成;当温度为308 K时,该体系平衡相图由不饱和液相区(L)和一固一液区(S + L)组成。其中:WABW、WCDW、WEFW为不饱和液相区;ABSA、CDSC、EFSE为一固一液区,对应K2SO4结晶区和饱和液相区;BSPB、DSPD为两固一液区,对应饱和液相和K2SO4、PEG1000析出相区。
随着溶液中PEG1000含量的增加,溶液中K2SO4不断析出,溶解度降低,说明PEG1000对K2SO4有一定的盐析作用。盐析率R可用于表示体系中PEG1000对K2SO4的盐析能力的强弱,其定义见式(2):
| $ R = \frac{{{w_0} - w}}{{{w_0}}} $ | (2) |
式中:w0和w分别代表K2SO4在纯水和PEG1000 - H2O混合溶剂中的溶解度。图 4为盐析率关系曲线,由图 4可知:温度对盐析率影响较小。当 w(PEG1000) > 0.70时,溶液中PEG1000含量对盐析率影响较小,当w(PEG1000) < 0.70时,盐析率随溶液中PEG1000增大而增大。

|
图 4 三元体系K2SO4 - PEG1000 - H2O (288, 298, 308) K盐析率曲线 Fig.4 Salting-out ratio R of the ternary system K2SO4 - PEG1000 - H2O at (288, 298, and 308) K |
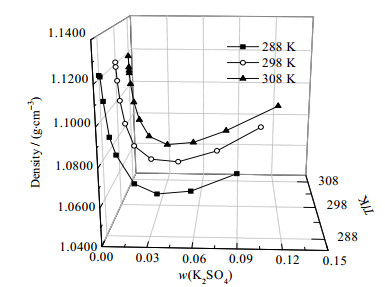
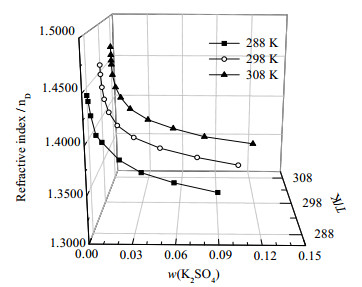
当温度相同时,溶液密度和折光率受溶液中K2SO4和PEG1000含量共同影响。图 5、6分别为K2SO4- PEG1000 - H2O (288, 298, 308) K时的密度-组成图和折光率-组成图。由图 5、6可知:在3个温度下,密度均随着溶液中K2SO4含量的增加而先减小后增大,折光率均随溶液中K2SO4含量的增加而减小。对于密度而言:在同一温度下,饱和PEG1000溶液的密度与饱和K2SO4溶液的密度相差较小,因此溶液中PEG1000含量和K2SO4对密度的影响作用接近。对于折光率而言:同温度下,饱和PEG1000溶液的折光率远大于饱和K2SO4溶液的折光率,同时由于PEG1000对K2SO4有一定盐析作用,因而溶液中PEG1000的含量是影响该体系折光率的主导因素,故而随着溶液中PEG1000含量减小的增加,对应的折光率减小。
|
图 5 三元体系K2SO4 - PEG1000 - H2O (288, 298, 308) K密度-组成图 Fig.5 Density - composition diagram of the ternary system K2SO4 - PEG1000 - H2O at (288, 298, and 308) K |
|
图 6 三元体系K2SO4 - PEG1000 - H2O (288, 298, 308) K折光率-组成图 Fig.6 Refractive index - composition diagram of the ternary system K2SO4 - PEG1000 - H2O at (288, 298, and 308) K |
对于聚合物-水混合溶剂体系,WU等[8]以Pitzer模型为基础,通过修正模型,将其成功应用于PEG1000/4000 - (NH4)2SO4 - H2O、PEG1000/8000 - Na2CO3 - H2O、PEG1000/8000 - Na2SO4 - H2O等混合溶剂体系液液平衡溶解度计算。课题组已采用该模型对KCl - PEG1000/4000 - H2O 288、298和308 K相平衡[9-10]进行了理论计算,计算结果与实验数据吻合较好。因此,本文亦采用文献[8]修正后的Pitzer活度系数模型[8]对三元体系K2SO4 - PEG1000 - H2O 288、298和308 K溶解度进行理论计算,详细计算过程见文献[9-10]。因K2SO4为1-2型电解质,故K2SO4溶度积常数Ksp的表达式为
| $ {K_{{\rm{sp}}}}{\rm{ = 4}}m_{{{\rm{K}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}}^3 \cdot \gamma _ \pm ^3 $ | (3) |
式中:m为质量摩尔浓度,γ±为平均活度系数。在温度为288、298、308 K下K2SO4的ln Ksp分别为-4.392 0、-4.052 2、-3.681 1,其中,当温度为288、298和308 K时Ksp均由本实验溶解度数据计算得出。K2SO4 - H2O体系单盐参数通过相应温度Pitzer参数[14]计算转化得到,PEG1000 - H2O的二元参数B11和C111来自于文献[8]。体系中组分间的混合参数β12(0)、β12(1)、C112和C122由相应温度下溶解度数据拟合得到。相关单盐参数和混合参数列于表 2中。计算所需的相关组分的物理参数列于表 3中,表中:M为相对分子质量,V为摩尔体积,ρ为密度,ri为聚合度,D为介电常数。
|
|
表 2 三元体系K2SO4 - PEG1000 - H2O (288, 298, 308) K二元参数和交互作用参数 Table 2 Binary and cross parameters of the ternary system K2SO4 - PEG1000 - H2O at (288, 298, and 308) K |
|
|
表 3 不同温度下各组分纯物质的物理性质 Table 3 Physical properties of pure chemicals at different temperatures |
根据式(3),改变PEG1000含量即可计算得到一系列K2SO4在混合溶剂PEG1000 - H2O中的溶解度数据。计算数据与实验数据偏差采用均方差σ计算,均方差计算公式为
| $ \sigma {\rm{ = }}\sqrt {\frac{{\sum {{{\left( {{w_\rm{\exp }} - {w_\rm{cal}}} \right)}^2}} }}{n}} $ | (4) |
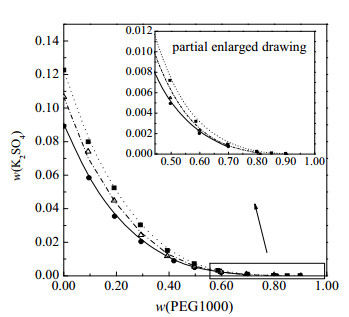
式中:σ表示均方差,wexp表示实验值,wcal表示计算值,n为组分总数。在温度为288、298、308 K下均方差分别为0.000 2、0.000 4、0.003 5。图 7为计算溶解度数据与实验溶解度数据图,由均方差和图 7可知:实验数据与计算数据吻合较好。
|
图 7 K2SO4 - PEG1000 - H2O三元体系(288, 298, 308) K理论和实验相图 Fig.7 Experimental and calculation phase diagrams of K2SO4 - PEG1000 - H2O at (288, 298, and 308) K: ●, △, ■ solubility of K2SO4 at 288,298 and 308 K obtained in this work; −, ---, ···· solubility of K2SO4 at 288,298 and 308 K from calculation |
(1) 采用等温溶解法测定了三元体系K2SO4 - PEG1000 - H2O在温度为(288, 298, 308) K时的溶解度和湿固相组成,绘制了相应的的相图。研究温度下,三元体系K2SO4 - PEG1000 - H2O无分层现象,只存在固液相平衡关系,其中288、298 K的平衡相图由不饱和液相区(L)、一固一液区(S + L)和两固一液区(2S + L)构成;308 K时无两固一液区(2S + L),其相图由不饱和液相区(L)和一固一液区(S + L)组成。
(2) PEG1000对K2SO4有盐析作用。温度对盐析率影响较小。当w(PEG1000) > 0.70时,溶液中PEG1000含量对盐析率影响较小;当w(PEG1000) < 0.70时,盐析率随溶液中PEG1000增大而增大。
(3) 采用修正后的Pitzer方程对K2SO4 - PEG1000 - H2O (288, 298, 308) K的溶解度进行了计算,计算值与实验值吻合较好。
| [1] |
郑绵平, 张震, 侯献华, 等. 中国钾资源远景与矿业发展战略[J]. 国土资源情报, 2015(10): 3-9. ZHENG M P, ZHANG Z, HOU X H, et al. The prospects and the mining development strategy of potassium resources in china[J]. Land and Resources Information, 2015(10): 3-9. DOI:10.3969/j.issn.1674-3709.2015.10.001 |
| [2] |
TABOADA M E, GRABER T A, ANDREWS B A, et al. Drowning-out crystallization of sodium sulphate using aqueous two-phase systems[J]. Journal of Chromatography B, 2000, 743(1): 101-105. |
| [3] |
URRÉJOLA S, SANCHEZ A, HERVELLO M F. Solubilities of sodium, potassium, and copper(Ⅲ) sulfates in ethanol-water solutions[J]. Journal of Chemical & Engineering Data, 2011, 56(5): 2687-2691. |
| [4] |
GRABER T A, GáLVEZ M E, GALLEGUILLOS H R, et al. Liquid-liquid equilibrium of the aqueous two-phase system water + PEG4000+ lithium sulfate at different temperatures:experimental determination and correlation[J]. Journal of Chemical & Engineering Data, 2004, 49(6): 1661-1664. |
| [5] |
MARTINS J P, COIMBRA J S D R, DE OLIVEIRA F C, et al. Liquid-liquid equilibrium of aqueous two-phase system composed of poly(ethylene glycol) 400 and sulfate salts[J]. Journal of Chemical & Engineering Data, 2010, 55(3): 1247-1251. |
| [6] |
JIMENEZ Y P, TABOADA M E, GALLEGUILLOS H R. Solid-liquid equilibrium of K2SO4 in solvent mixtures at different temperatures[J]. Fluid Phase Equilibria, 2009, 284: 114-117. DOI:10.1016/j.fluid.2009.06.017 |
| [7] |
XIE J, LIU X, PAN W, et al. Phase equilibria in the system Na+, K+//SO42--(CH2OH)2-H2O and Na+, K+//Cl-, SO42--(CH2OH)2-H2O at 328..15 K[J]. The Journal of Chemical Thermodynamics, 2017, 112: 155-165. DOI:10.1016/j.jct.2017.05.002 |
| [8] |
WU Y T, LIN D Q, ZHU Z Q, et al. Prediction of liquid-liquid equilibria of polymer-salt aqueous two-phase systms by modified Pitzer's virial equation[J]. Fluid Phase Equilibria, 1996, 124: 67-79. DOI:10.1016/S0378-3812(96)03066-X |
| [9] |
HUANG Q, WANG L, LI M L, et al. Measurements and simulation of the polyethylene glycol 1000-water-KCl ternary system at 288.2, 298.2, and 308.2 K[J]. Journal of Chemical Engineering of Japan, 2019, 52(4): 325-332. DOI:10.1252/jcej.18we284 |
| [10] |
于旭东, 黄琴, 王林, 等. KCl-PEG4000-H2O三元体系288, 298, 308 K相平衡测定及计算[J]. 化工学报, 2019, 70(3): 830-839. YU X D, HUAGN Q, WANG L, et al. Measurements and simulation for ternary system KCl-PEG4000-H2O at T =(288, 298, and 308) K[J]. CIESC Journal, 2019, 70(3): 830-839. |
| [11] |
FOSBOL P L, THOMSEN K, STENBY E H. Reverse schreinemakers method for experimental analysis of mixed-solvent electrolyte systems[J]. Journal of Solution Chemistry, 2009, 38(1): 1-14. DOI:10.1007/s10953-008-9353-4 |
| [12] |
冉广芬, 马海州, 孟瑞英, 等. 四苯硼钠-季铵盐容量法快速测钾[J]. 盐湖研究, 2009, 17(2): 39-42. RAN G F, MA H Z, MENG R Y, et al. Four benzene boron sodium-Rapid determination of potassium by quaternary ammonium salt volumetric method[J]. Journal of Salt Lake Research, 2009, 17(2): 39-42. |
| [13] |
CHELUGET E L, GELINAS S, VERA J H, et al. Liquid-liquid equilibrium of aqueous mixtures of poly(propylene glycol) with NaCl[J]. Journal of Chemical & Engineering Data, 1994, 39(1): 127-130. |
| [14] |
GREENBERG J P, MØLLER N. The prediction of mineral solubilities in natural waters:A chemical equilibrium model for the Na-K-Ca-Cl-SO4-H2O system to high concentration from 0 to 250℃[J]. Geochimica et Cosmochimica Acta, 1989, 53(10): 2503-2518. DOI:10.1016/0016-7037(89)90124-5 |




