呋咱环又称为1, 2, 5-噁二唑环,它是一个由两个N原子和一个O原子所构成的五元杂环,是非常有效的含能结构单元,氨基呋咱更是呋咱化学的研究热点。此类化合物因其特殊结构和生物活性被广泛用于含能材料[1-3]和医药领域,DEFILIPPI等[4]首先提出4-取代-3-氨基呋咱可作为潜在的组胺H2受体拮抗剂,后来人们发现氨基呋咱衍生物可作为多种激酶抑制剂[5-9],拓展了氨基呋咱类化合物在医药领域方面的应用。4-氨基呋咱-3-甲酰胺,是一种简单的氨基呋咱衍生物,同时也是一类重要的含能材料前驱体,可用于制备新型呋咱含能材料[10-11]。另外,最近研究指出[12],4-氨基呋咱-3-甲酰胺可用于合成5-脂肪氧合酶激活蛋白(FLAP)抑制剂,开辟了该化合物在医药领域的应用前景。
关于4-氨基呋咱-3-甲酰胺的合成,国内外报道的方法主要有以下3种:(1)以氰乙酸甲酯为原料[13-14],首先,在水溶液中经亚硝化、异构化成肟,得2-肟基氰乙酸甲酯;第2步,在碱液中与羟胺反应,回流,冷却至室温后,水溶液调pH = 1得4-氨基呋咱-3-甲酸;第3步,以硫酸为催化剂,与正丙醇反应,回流,得4-氨基呋咱-3-甲酸丙酯;最后,氨解得4-氨基呋咱-3-甲酰胺。(2)以丙二腈为原料[15-19],首先,一锅法制备4-氨基-3-偕胺肟基呋咱(DAOF);第3步,DAOF与原甲酸三酯反应,得3-氨基-4-(3-1, 2, 4-噁二唑)呋咱;第3步,氨解得4-氨基呋咱-3-甲酰胺;或DAOF与亚硝酸钠和盐酸反应,得4-氨基-N-羟基呋咱-3-亚胺代甲酰氯;然后在乙腈中添加三乙胺,得4, 4′-(3, 5-1, 4, 2, 6-二噁嗪)-3, 3′-二氨基呋咱;最后钯炭催化加氢得4-氨基呋咱-3-甲酰胺;(3)以乙酰乙酸乙酯为原料[20-22],首先,在混酸和乙酸酐作用下,得3, 4-二甲酸乙酯氧化呋咱;第2步,通过多步反应得4-氨基-3-甲酰叠氮基氧化呋咱;第3步,氨解得4-氨基氧化呋咱-3-甲酰胺;最后去氧化得4-氨基呋咱-3-甲酰胺。上述几种方法存在合成步骤较长、产品得率低等不足,需要进一步探索新的合成方法。
作者借鉴合成呋咱化合物的相关报道[23-25],设计并探索一条3步合成4-氨基呋咱-3-甲酰胺(1)的路线:以氰乙酰胺为起始原料[26],首先,在水溶液中亚硝化,得2-肟基氰乙酰胺(2);第2步,(2)与羟胺反应[27-29],得邻二肟中间体(3);第3步,(3)在1, 4-二氧六环中,以SOCl2为脱水剂[30],环化脱水制得4-氨基呋咱-3-甲酰胺(1)。此路线收率高,产品纯度好,合成条件温和,产品总收率达64.0%。中间体和产品的结构均通过1H-NMR表征。
具体反应路线如图 1所示。
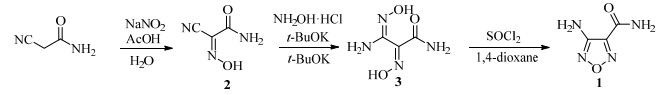
|
图 1 4-氨基呋咱-3-甲酰胺的改进合成路线 Fig.1 An improved synthetic route of 4-aminofurazan-3-carboxamide |
本实验所用试剂为氰乙酰胺(AR,Aladdin)、亚硝酸钠(AR,沪试)、冰醋酸(AR,沪试)、盐酸羟胺(GR,Aladdin)、异丙醇(AR,沪试)、叔丁醇钾(AR,沪试)、1, 4-二氧六环(AR,沪试)、氯化亚砜(AR,沪试)等。
2.2 分析仪器AVANCE DMX500型核磁共振仪(TMS为内标);WRS-1B数字熔点仪;Bruker Esquire-LC质谱分析仪(ESI-MS)。
2.3 典型实验 2.3.1 2-肟基氰乙酰胺(2)的合成250 mL三口瓶中加入100 mL水,10.0 g (0.119 mol)氰乙酰胺,9.85 g (0.143 mol)亚硝酸钠,冰水浴冷却至0 ℃,40 min内滴加11.21 g (0.187 mol)冰醋酸。滴毕,撤去冰浴,然后升温至60 ℃反应6 h。反应完毕降至室温,用w= 36%盐酸调pH= 2,用400 mL乙酸乙酯萃取(100 mL×4),合并有机层并用无水硫酸镁干燥,减压浓缩,烘干后得白色固体,12.66 g,收率94.1%。mp. 171.8~172.0 ℃;1H-NMR (500 MHz, DMSO) δ (mg·kg-1): 14.47 (s, 1H, -OH), 7.91, 7.83 (brs, 2H, -CONH2)。
2.3.2 邻二肟中间体(3)100 mL三口烧瓶中加入20 mL异丙醇,1.13 g (10 mmol)2-肟基氰乙酰胺(2)和1.13 g (10 mmol)叔丁醇钾,50 ℃反应1 h,得黄色浑浊液。然后加入0.83 g (12 mmol)盐酸羟胺,反应物颜色由黄色变为白色,继续反应6 h。反应完毕,抽滤,得含有邻二肟中间体(3)的粗品,烘干后为类白色固体。无需纯化,直接用于下一步。中间体可通过柱层析分离,用PE:EA=2:1进行洗脱,经1H-NMR确证了结构。1H-NMR (500 MHz, DMSO) δ(mg·kg-1) 12.72 (s, 1H, -OH); 9.80 (s, 1H, -OH); 7.52, 7.31 (brs, 2H, -CONH2); 5.86 (s, 2H, -NH2)。
2.3.3 4-氨基呋咱-3-甲酰胺(1)的合成100 mL三口瓶中加入20 mL 1, 4-二氧六环,然后加入上步中间体(3),滴加1.19 g (10 mmol) SOCl2,60 ℃反应2 h,TLC检测反应终点。反应完毕,冷却至室温,抽滤,并用少许1, 4-二氧六环洗涤滤饼2次,合并滤液,浓缩至干。然后加入20 mL水稀释,用乙酸乙酯萃取2次(30 mL×2),合并有机层并用无水硫酸镁干燥,浓缩得棕色4-氨基呋咱-3-甲酰胺(1)固体,0.87 g,两步反应收率68.0%。1H-NMR (500 MHz, DMSO) δ(mg·kg-1): 8.43, 8.06(brs, 2H, -CONH2); 6.34 (s, 2H, -NH2)。
3 实验结果与讨论影响化学反应收率的因素有很多,最主要的几个因素是溶剂、温度和反应时间、投料比、缚酸剂、加料顺序,通过实验研究,对4-氨基呋咱-3-甲酰胺(1)的合成进行优化。
3.1 2-肟基氰乙酰胺(2)的工艺优化 3.1.1 温度对收率的影响升高温度不仅可以加快反应速率,而且可以提高产品的收率,但过高的温度会引起副反应的发生,不利于实际生产。本实验中,由氰乙酰胺制备2-肟基氰乙酰胺(2)的过程属于活泼亚甲基的亚硝化、异构化成肟反应,温度对收率有较大的影响,结果如表 1所示:
|
|
表 1 温度对收率的影响 Table 1 Effects of temperature on reaction yields |
由表 1可知,当温度较低时,反应速率较缓慢,收率不高;升温能够加快反应速率并提高产物收率,但随着温度进一步提高,收率又有所下降;综合考虑收率和效率2个方面,反应温度控制在60 ℃较好;冰水浴滴加冰醋酸,然后升温至60 ℃反应6 h,收率最高。这是由于亚硝酸钠与冰醋酸反应生成的亚硝酸是一种不稳定的弱酸,低温条件下,亚硝酸不易分解,底物的亚硝化反应更彻底,升温更有利于亚硝基向肟基的转化。所以冰水浴条件下加入冰醋酸,然后升温至60 ℃反应,效果最好。
3.1.2 酸对收率的影响由表 2可知,使用浓盐酸进行反应,收率相较于冰醋酸低;使用浓硫酸进行反应,有较多副产品生成,反应选择性较差,产品分离较为困难,而使用弱酸性的冰醋酸进行反应,效果较好。有研究表明[34],肟形成的速率在特定pH值达到最大,具体pH值取决于底物,但通常约为4,所以使用弱酸性的冰醋酸进行反应,收率更高。
|
|
表 2 酸对收率的影响 Table 2 Effects of acid on reaction yields |
4-氨基呋咱-3-甲酰胺的合成分两步,首先2-肟基氰乙酰胺(2)与羟胺反应,得到的中间体(3)在溶液中析出,过滤、烘干后直接用于下一步,然后以SOCl2为脱水剂进行环化脱水反应,可顺利制得产品(1)。在此,着重对中间体(3)的合成进行优化,分别考察了溶剂、温度、反应时间、投料比等对收率的影响。
3.2.1 溶剂对收率的影响在实验中考察了不同溶剂对收率的影响,由表 3可知,以二氯甲烷(DCM)为溶剂进行反应,没有产品生成,这是由于(2)在二氯甲烷中溶解性不好,底物基本不参与反应;以异丙醇或者叔丁醇为溶剂进行反应,能得到接近的收率;所用溶剂为醇时,异丙醇效果最好,叔丁醇次之,故优选溶剂为异丙醇。这是由于部分产品(3)溶解在甲醇和乙醇中,未收集,导致(1)收率降低。
|
|
表 3 溶剂对收率的影响 Table 3 Effects of solvent on reaction yields |
在实验中考察了温度和反应时间对收率的影响,由表 4可知,升高温度,副产品增加,反应的选择性下降,收率降低;降低温度,则反应速率缓慢,无法得到产品,在50 ℃下反应能得到较好的实验结果。在50 ℃下反应,适当延长反应时间,收率先升高后下降,故反应时间6 h较为适宜。
|
|
表 4 温度和反应时间对收率的影响 Table 4 Effects of time and temperature on reaction yields |
在实验中考察了投料比对收率的影响,由表 5可知,当2-肟基氰乙酰胺(2)、叔丁醇钾和盐酸羟胺的投料比为1:1:1.2时,收率最高;增加叔丁醇钾的相对量,产率急剧下降,产品无法收集,叔丁醇钾的相对量对收率影响较大。这是由于叔丁醇钾的活性高于后文中钾盐(2′),过量的叔丁醇钾会优先与盐酸羟胺反应,得到游离的羟胺和氯化钾,前者不与(2′)反应,故基本没有产品(1)生成。同时增加叔丁醇钾和盐酸羟胺的相对量,收率没有明显的提高。
|
|
表 5 投料比对收率的影响 Table 5 Effects of substrate and reagent ratios on reaction yields |
结果表明:投料比对该收率影响较大,过量叔丁醇钾的加入,不利于反应的进行。综上所述,为了避免原料的浪费,选择投料比(摩尔比)为1:1:1.2较适宜。
3.2.4 缚酸剂对收率的影响在实验中考察了缚酸剂对收率的影响,结果如表 6所示。由表 6可知,当所用缚酸剂为乙酸钠、叔丁醇钠、叔丁醇钾时,能得到较好的实验结果,而以叔丁醇钾为缚酸剂收率最高。这是由于叔丁醇钾的碱性相比于其他缚酸剂更强,更容易与(2)反应,生成钾盐(2′),最终(1)的收率较高。
|
|
表 6 缚酸剂对收率的影响 Table 6 Effects of acid-binding agent on reaction yields |
中间体(3)不经提纯,直接用于下一步,加料顺序的不同,对(1)收率影响较大。在实验中考察了加料顺序对该反应的影响:将2-肟基氰乙酰胺(2)、叔丁醇钾和盐酸羟胺分别记为a、b、c,对加料顺序进行调整:
由表 7可知,先加入(2)和叔丁醇钾,后加入盐酸羟胺能得到较好的实验结果。更改加料顺序,收率下降较明显。在合成过程中可以观察到,反应物颜色由黄色逐渐变为白色,这是因为实际存在(2)成盐生成(2′)的历程[31],经熔点、1H-NMR和LC-MS(ESI)确证了结构,数据对比见表 8。
|
|
表 7 加料顺序对收率的影响 Table 7 Effects of substrate and reagent addition sequence on reaction yields |
|
|
表 8 (2)与(2′)的数据对比 Table 8 Data comparison of compounds (2) and (2′) |
由表 8可知,(2′)的氢谱:1H-NMR (500 MHz, DMSO) δ (mg·kg-1) 7.39, 6.87,肟羟基特征峰消失;LC-MS(ESI) Calcd for C3H2KN3O2 [M+K]+ (m/z), 189.94, found, 189.88。因此,该反应过程是先制得2-肟基氰乙酰胺的钾盐(2′);呈碱性的(2′)与盐酸羟胺反应,将羟胺游离,然后氰基与羟胺亲核加成,得邻二肟中间体(3);最后在1, 4-二氧六环中,(3)与SOCl2反应,环化脱水得到目标产品。所用溶剂为异丙醇时,效果较好,总收率较高。实验历程如图 2所示。

|
图 2 调整后的合成路线 Fig.2 Modified synthetic route of 4-aminofurazan-3-carboxamide |
这也进一步解释了KISLYI等[33]将2-肟基氰乙酰胺(2)与羟胺进行长时间反应,但无法得到4-氨基呋咱-3-甲酰胺(1)的原因。本研究方法的成功,最主要是因为生成了肟盐(2′)。同时,由于所用脱水剂为氯化亚砜,异丙醇与氯化亚砜反应会生成2-氯丙烷并释放二氧化硫和氯化氢。本实验的关键步骤在于,(3)需要烘干,若有异丙醇剩余,脱水反应无法得到(1)。此外,也尝试过将异丙醇替换为1, 4-二氧六环进行实验,但同样无法得到最终产品,故此两步反应仍选择分开进行。
4 结论以氰乙酰胺为起始原料,经与亚硝酸钠和冰醋酸反应成肟、与羟胺在醇溶液中加成、分子内环化脱水,最终制得4-氨基呋咱-3-甲酰胺(1)。此合成路线相较于现有的合成方法,收率高、原料廉价易得、反应温和、操作简便,具有较好的工业应用价值。
在反应过程中考察了反应温度、反应时间、加料顺序、投料比等对收率的影响,得到了最佳反应条件:制备2-肟基氰乙酰胺(2),冰水浴滴加冰醋酸,60 ℃反应6 h;制备中间体(3),以2-肟基氰乙酰胺(2)、叔丁醇钾和盐酸羟胺为试剂,异丙醇为溶剂,先加入(2)和叔丁醇钾,后加入盐酸羟胺,投料比(摩尔比)以1:1:1.2较好,50 ℃反应6 h;环化脱水反应,以1, 4-二氧六环为溶剂,与SOCl2在60 ℃下反应2 h,即可得目标产品,3步总收率64.0%。
| [1] |
TALAWAR M B, SIVABALAN R, SENTHILKUMAR N, et al. Synthesis, characterization and thermal studies on furazan- and tetrazine-based high energy materials[J]. Journal of Hazardous Materials, 2004, 113(1-3): 11-25. DOI:10.1016/j.jhazmat.2004.05.016 |
| [2] |
WEI H, HE C L, ZHANG J H, et al. Combination of 1, 2, 4-oxadiazole and 1, 2, 5-oxadiazole moieties for the generation of high-performance energetic materials[J]. Angewandte Chemie International Edition, 2015, 54(32): 9367-9371. DOI:10.1002/anie.201503532 |
| [3] |
ZHANG J H, SHREEVE J M. 3, 3'-dinitroamino-4, 4'-azoxyfurazan and its derivatives:an assembly of diverse N-O building blocks for high-performance energetic materials[J]. Journal of the American Chemical Society, 2014, 136(11): 4437-4445. DOI:10.1021/ja501176q |
| [4] |
DEFILIPPI A, SORBA G, CALVINO R, et al. Potential histamine H2-receptor antagonists:analogues of classical antagonists containing 4-substituted-3-aminofurazan moieties[J]. Archiv der Pharmazie, 1988, 321(2): 77-80. DOI:10.1002/(ISSN)1521-4184 |
| [5] |
ERDING H, DENNIS L. Rho kinase as potential therapeutic target for cardiovascular diseases:opportunities and challenges[J]. Expert Opinion on Therapeutic Targets, 2005, 9(4): 715-736. DOI:10.1517/14728222.9.4.715 |
| [6] |
OLESEN P H, SØRENSEN A R, URSO B, et al. Synthesis and in vitro characterization of 1-(4-aminofurazan-3-yl)-5- dialkylaminomethyl- 1H-[1, 2, 3]triazole-4-carboxylic acid derivatives. A new class of selective GSK-3 inhibitors[J]. Journal of Medicinal Chemistry, 2003, 46(15): 3333-3341. DOI:10.1021/jm021095d |
| [7] |
DOE C, BENTLEY R, BEHM D J, et al. Novel Rho kinase inhibitors with anti-inflammatory and vasodilatory activities[J]. Journal of Pharmacology and Experimental Therapeutics, 2007, 320(1): 89-98. |
| [8] |
Rouse M B, Seefeld M A, Leber J D, et al. Aminofurazans as potent inhibitors of AKT kinase[J]. Bioorganic and Medicinal Chemistry Letters, 2009, 19(5): 1508-1511. DOI:10.1016/j.bmcl.2009.01.002 |
| [9] |
BANDARAGE U, HARE B, PARSONS J, et al. 4-(benzimidazol-2-yl)-1, 2, 5-oxadiazol-3-ylamine derivatives:potent and selective p70S6 kinase inhibitors[J]. Bioorganic and Medicinal Chemistry Letters, 2009, 19(17): 5191-5194. DOI:10.1016/j.bmcl.2009.07.022 |
| [10] |
SHAPOSHNIKOV S D, KOROBOV N V, SERGIEVSKⅡ A V, et al. New heterocycles with a 3-aminofurazanyl substituent[J]. Russian Journal of Organic Chemistry, 2002, 38(9): 1351-1355. DOI:10.1023/A:1021668216426 |
| [11] |
WILLER R L, STOREY R F, DESCHAMPS J R, et al. Synthesis and crystal structure of 4, 4'-(methylenediimino)bis-1, 2, 5- oxadiazole-3-carboxylic acid and carboxamide[J]. Journal of Heterocyclic Chemistry, 2013, 50(4): 949-954. DOI:10.1002/jhet.v50.4 |
| [12] |
ASTRAZENECA A B, BRODDEFALK J O, EMTEN S H F, et al. Pyrazole derivatives useful as 5-lipoxygenase activating protein (FLAP) inhibitors: WO, 2016177703 A1[P]. 2016-11-10.
|
| [13] |
WILLER R L, STOREY R F, FRISCH M, et al. Crystal structures of the "two" 4-aminofurazan-3-carboxylic acids[J]. Journal of Heterocyclic Chemistry, 2012, 49(1): 227-231. |
| [14] |
WILLER R L, STOREY R F, JARRETT W L. Synthesis and crystal structure of octahydro-5H, 12H-4, 11-methano- 1H, 7H-bis[1, 2, 5]oxadiazolo[3, 4-d:3', 4'-j] [1, 7, 3, 9]dioxadiazacyclododecine[J]. Journal of Heterocyclic Chemistry, 2012, 49(3): 705-709. DOI:10.1002/jhet.926 |
| [15] |
ZHANG J H, MITCHELL L A, PARRISH D A, et al. Enforced layer-by-layer stacking of energetic salts towards high-performance insensitive energetic materials[J]. Journal of the American Chemical Society, 2015, 137(33): 10532-10535. DOI:10.1021/jacs.5b07852 |
| [16] |
ANDRIANOV V G, ROZHKOV E N, EREMEEV A V. Ring formation reactions of 4-aminofurazan-3-carboxyamidoximes[J]. Chemistry of Heterocyclic Compounds, 1994, 30(4): 470-474. DOI:10.1007/BF01169945 |
| [17] |
STEPANOV A I, SANNIKOV V S, DASHKO D V, et al. A new preparative method and some chemical properties of 4-R-furazan-3-carboxylic acid amidrazones[J]. Chemistry of Heterocyclic Compounds, 2015, 51(4): 350-360. DOI:10.1007/s10593-015-1707-4 |
| [18] |
PAGORIA P F, ZHANG M X, ZUCKERMAN N B, et al. Synthesis and characterization of multicyclic oxadiazoles and 1-hydroxytetrazoles as energetic materials[J]. Chemistry of Heterocyclic Compounds, 2017, 53(6-7): 760-778. DOI:10.1007/s10593-017-2122-9 |
| [19] |
ANDRIANOV V G, SEMENIKHINA V G, EREMEEV A V. 4-aminofurazan-3-hydroximic halides[J]. Chemistry of Heterocyclic Compounds, 1992, 28(5): 581-585. DOI:10.1007/BF00475263 |
| [20] |
CHENTSOVA A, USHAKOV D B, SEEBERGER P H, et al. Synthesis of α-nitro carbonyls via nitrations in flow[J]. The Journal of Organic Chemistry, 2016, 81(19): 9415-9421. DOI:10.1021/acs.joc.6b01634 |
| [21] |
KULIKOVI A S, OVCHINNIKOV I V, MOLOTOV S I, et al. Synthesis of furoxan derivatives based on 4-aminofuroxan-3-carboxylic acid azide[J]. Russian Chemical Bulletin, 2003, 52(8): 1822-1828. DOI:10.1023/A:1026073108494 |
| [22] |
KULIKOV A S, MAKHOVA N N, GODOVIKOVA T I, et al. Reduction of the furoxan ring to the furazan ring in some carbonyl-substituted furoxans[J]. Russian Chemical Bulletin, 1994, 43(4): 630-631. DOI:10.1007/BF00699838 |
| [23] |
COBURN M D. Picrylamino-substituted heterocycles. Ⅱ. Furazans[J]. Journal of Heterocyclic Chemistry, 1968, 5(1): 82-87. |
| [24] |
ANDRIANOV V G, EREMEEV A V. Synthesis and properties of 4-amino-3-cyanofurazan[J]. Chemistry of Heterocyclic Compounds, 1994, 30(5): 608-611. DOI:10.1007/BF01169844 |
| [25] |
NEEL A J, ZHAO R. Mild synthesis of substituted 1, 2, 5-oxadiazoles using 1, 1'-carbonyldiimidazole as a dehydrating agent[J]. Organic Letters, 2018, 20(7): 2024. DOI:10.1021/acs.orglett.8b00568 |
| [26] |
SKERLJ R T, BOURQUE E M J, GREENLEE W J, et al. Substituted imidazo[1, 2-b]pyridazines, substituted imidazo[1, 5-b] pyridazines, related compounds, and their use in the treatment of medical disorders: WO, 2017192930 A1[P]. 2017-11-09.
|
| [27] |
HAMZE A, HERNANDEZ J F, FULCRAND P, et al. Synthesis of various 3-substituted 1, 2, 4-oxadiazole-containing chiral β3- and α-amino acids from fmoc-protected aspartic acid[J]. The Journal of Organic Chemistry, 2003, 68(19): 7316-7321. DOI:10.1021/jo0345953 |
| [28] |
LEE W M. Stabilization of hydroxylamine containing solutions and method for their preparation: US, 2009112024 A1[P]. 2009-04-30.
|
| [29] |
DETISTOV O S, ORLOV V D, ZHURAVEL I O. Isomeric 3-isoxadiazolylcoumarins and their derivatives[J]. Journal of Heterocyclic Chemistry, 2012, 49(4): 883-892. DOI:10.1002/jhet.893 |
| [30] |
GELIN S, POLLET P. Tetronic acids and derivatives. Part V. synthesis of 5-hydroxy-1H-pyrazoles via 4-hydrazino-5H-furan-2-ones. Reaction of hydrazines on tetronic acids[J]. Journal of Heterocyclic Chemistry, 1979, 16(3): 505-508. DOI:10.1002/jhet.v16:3 |
| [31] |
DOMASEVITCH K V, GERASIMCHUK N N, MOKHIR A. Organoantimony(V) cyanoximates:synthesis, spectra and crystal structures[J]. Inorganic Chemistry, 2000, 39(6): 1227-1237. DOI:10.1021/ic9906048 |
| [32] |
ROSS J M, SMITH W C. Hydroxy-1, 2, 5-thiadiazoles. I. A novel route from potassium cyanide and sulfur dioxide[J]. Journal of the American Chemical Society, 1964, 86(14): 2861-2868. DOI:10.1021/ja01068a020 |
| [33] |
KISLYI V P, DANILOVA E B, ZAKHAROV E P, et al. Synthesis of 4-aminoisoxazole-3-carboxamides using base-promoted nitrosation of N-substituted cyanoacetamides[J]. Russian Chemical Bulletin, 2004, 53(3): 622-625. DOI:10.1023/B:RUCB.0000035646.13790.8a |
| [34] |
JENCKS W P. Studies on the mechanism of oxime and semicarbazone formation[J]. Journal of the American Chemical Society, 1959, 81(2): 475-481. DOI:10.1021/ja01511a053 |




