丙酮丁醇梭菌发酵制备的生物丁醇具有高能量密度、低挥发性、低吸水性以及低腐蚀的特性,广泛应用于工业和能源领域[1]。然而,生物丁醇制备过程中存在对细胞毒性大、生产强度低、原料成本高等难题,严重影响了产业化进程[2]。细胞固定化形成生物膜 (BF) 是改善或解决这些问题的有效方法之一。BF是Costerton等在1978年首先提出的,是一种生长在生物或非生物介质表面的微生物聚集群落,自然界中99%的细菌以BF的形式存在,与人类生活密切相关[3~5]。生物发酵中,细胞固定化形成BF可提高效率,降低成本,增加细胞耐受性[6~8]。
BF主要由细胞以及胞外基质 (EPS) 组成,具有三维立体结构[9]。EPS主要包含多糖、蛋白质、核酸和脂质等,大多数BF中EPS达到90%以上[10]。EPS内聚合物种类繁多,与BF的形成,水分维持,保护机制,营养、代谢物、信号传递等具有密切的关系[11~14],但难以提取与分析,因此被称为“生物膜中暗物质”[10]。前人工作尝试了高速离心、树脂分离和声波降解等常见的分离EPS的方法,此外,电子显微分析、荧光标记被用于结构和特征分析[10],但都较为复杂。简便可行的分析方法可为解析EPS组成和结构,并进一步研究生物膜在发酵中的功能提供基础。
载体是生物膜形成的要素之一,微生物细胞与固定化载体 (如纤维材料) 在二者的接触表面存在相互作用力,载体表面的特性 (如表面亲疏水性、粗糙度、电荷种类和电荷分布等) 影响细胞的粘附[15]。纤维材料的高比表面积,可为细胞提供大量的吸附位点;富含羟基的表面亲水性高,增加与丙酮丁醇梭菌、胞外基质间的作用力;纤维表面的粗糙度使形成的生物膜结合较为牢固,有助于成熟生物膜的结构和性能稳定[16, 17]。纤维床反应器中形成丙酮丁醇梭菌BF,连续发酵生产丁醇的研究已取得较好突破,如Hong等[20]以天然纤维固定丙酮丁醇梭菌,形成BF,连续发酵,丁醇产率达4.6 g⋅L-1×h-1,远高于游离发酵。然而BF结构和组成对发酵性能的影响机制尚无探索研究。
目前对BF的研究主要集中于致病菌,且主要探索某一特异性物质对BF形成和结构的影响。如铜绿假单胞菌中PSL多糖对BF形成的促进作用[19];信号分子[20]、D型氨基酸[21]促进BF降解;结构蛋白促使霍乱弧菌等致病菌粘附[4, 22]。但对于工业微生物的生物膜及其基本性质尚未有报道。本文以产丁醇的丙酮丁醇梭菌固定化在棉纤维载体上,形成的BF为研究对象,微量培养生物膜,结合电子显微分析手段,观察BF的结构;特异性酶处理降解简便的分析了BF组成,讨论了各组分在BF结构中的作用。结合酶、氢氧化钠处理提取EPS,进一步分析BF各组分的含量,了解丙酮丁醇梭菌BF的基本特性,为生物膜反应器应用于丁醇发酵提供一定基础。
2 材料与方法 2.1 实验材料96孔板,(6x6) cm2的棉纤维材料 (经去离子水清洗,烘干,灭菌),蛋白酶 (Proteinase K (CWBIO)),核酸酶 (DNase I (CWBIO)),猪胰脂肪酶 (Lipase (sigma)),纤维素酶 (Cellulase,(sigma))。
菌种:丙酮丁醇梭菌 (C. acetobutylicum,中国典型培养物保藏中心,保藏号:CGMCC 5234)。
2.2 发酵与培养种子培养基:酵母膏3 g·L-1,蛋白胨5 g·L-1,葡萄糖10 g·L-1,CH3COONH4 2 g·L-1,NaCl 2 g·L-1,MgSO4·7H2O 3 g·L-1,K2HPO4 1 g·L-1,KH2PO4 1 g·L-1,FeSO4·7H2O 0.1 g·L-1,121℃灭菌15 min。
种子培养:将-80℃保藏的菌种,接种到固体培养基上,厌氧箱中37℃,活化24 h,再转接两次,各培养12 h,然后将平板上菌泥接种于已灭菌并冷却至室温的液体种子培养基内 (100 mL左右),继续于恒温厌氧箱内培养12~14 h,得种子液。
发酵培养基:葡萄糖60 g·L-1,K2HPO4 0.5 g·L-1,KH2PO4 0.5 g·L-1,CH3COONH4 2.2 g·L-1,MgSO4·7H2O 0.2 g·L-1,MnSO4·H2O 0.01 g·L-1,NaCl 0.01 g·L-1,FeSO4·7H2O 0.01 g·L-1,对氨基苯甲酸1 mg·L-1;硫胺1 mg·L-1;生物素0.01 mg·L-1。
发酵培养:将上述种子液以10%的接种量接种于装有已灭过菌并冷却至室温的发酵培养基的丝口试剂瓶中,37℃,厌氧培养。
2.3 BF培养 2.3.1 微量BF培养吸取0.2 mL丙酮丁醇梭菌发酵液于96孔板中和2.5 mL离心管中,静置于37℃下,厌氧培养3 d,缓慢吸去液体,并用0.1 mol⋅L-1 PBS缓冲液 (pH=6.0) 轻柔地清洗形成的薄膜,待用[8]。
2.3.2 载体吸附培养法取10 mL丙酮丁醇梭菌的种子液接种于100 mL含有棉纤维载体的发酵培养基中,37℃厌氧培养1周,每48 h更换发酵培养基。
2.4 BF胞外基质提取及初步测试棉纤维载体上形成的BF,用盖玻片刮下,去离子水清洗2次,待用,提取EPS。将BF置于离心管中,加入Proteinase K或Cellulase水溶液,冰浴搅拌3 h后,12000 r⋅min-1、4℃、离心10 min,收集上清液 (EPS溶液),再分别以0.9% NaCl、0.1 mol⋅L-1 NaOH溶液按上述方法分别提取1次、2次。提取得到的EPS,烘干处理后,进行X-射线衍射 (XRD,; Bruker D8, Cu-Kα radiation) 和傅立叶转换红外光谱分析 (FT-IR,PerkinElmer,Spectrum BX II)。
2.5 细胞含量检测 2.5.1 游离细胞浓度测定取不同发酵时间的丙酮丁醇梭菌发酵液6 mL,8000 r⋅min-1,4℃,离心5 min,收集菌体,冻干后称重;取上述测定干重的菌液,用血球计数板按常规操作方法在显微镜下计数, 每个样本计数3次,求出与细胞干重相对应的细胞数目的平均值,标记为a/CFU⋅mg-1。
2.5.2 固定化细胞浓度测定电子显微镜下对一定表面积内BF中的细胞计数,测定细胞直径,估算单位体积内细胞数,标记为b/CFU⋅mL-1。
2.5.3 BF密度测定量取一定量的BF,然后冷冻干燥处理后称量,计算得到单位体积BF干重,标记为c/mg⋅mL-1。
2.5.4 细胞占BF干重比例| $\%\text{ cells}=\frac{b}{a/c}\times 100\%$ |
苯酚-硫酸法检测多糖浓度,2 mL样品 (适当稀释使浓度低于0.1 g⋅L-1) 加入0.05 mL,80%的苯酚溶液后,迅速加入5 mL浓硫酸,静置10 min后,混合均匀,25~30℃水浴10~20 min,490 nm波长下测定OD490值,根据绘出的标准曲线计算EPS中多糖浓度[23]。
2.7 蛋白含量检测考马斯亮蓝法检测蛋白浓度,0.1 mL样品 (适当稀释使浓度低于1 g⋅L-1) 加入5 mL考马斯亮蓝溶液,混匀后静置5 min,595 nm波长下测定OD595值,根据绘出的标准曲线计算EPS中蛋白浓度。
2.8 核酸及脂类含量检测失重法测量核酸及脂类浓度,于2.5 mL培养的微量BF中分别加入10 μL DNase I,1 mL脂肪酶溶液,室温下酶解4 h,去离子水清洗2遍,8000 r⋅min-1,离心10 min,收集沉淀,冻干后称重 (A1)。以不加入酶处理的BF为空白对照组,冻干后计算BF干重 (A0),差值法计算核酸及脂类含量。
核酸或脂类占BF干重的比例:(A0-A1)/A0
2.9 电子显微镜观察 2.9.1 扫描电子显微镜 (SEM)BF样品,浸没在2.5%的戊二醛溶液中,4℃,固定4 h以上,接着去离子水清洗3次,1%的四氧化锇溶液,再固定1 h,去离子水清洗3次,乙醇梯度脱水,自然干燥,喷金,观察。
2.9.2 透射电子显微镜 (TEM)BF样品,浸没在2.5%的戊二醛溶液中,4℃,固定4 h以上,接着去离子水清洗3次,1%的四氧化锇溶液,再固定1 h,去离子水清洗3次,加入去离子水制成溶液,滴在碳支持膜上,再经1%的乙酸铀染色90 s,去离子水清洗,红外灯下干燥,TEM观察[24, 25]。
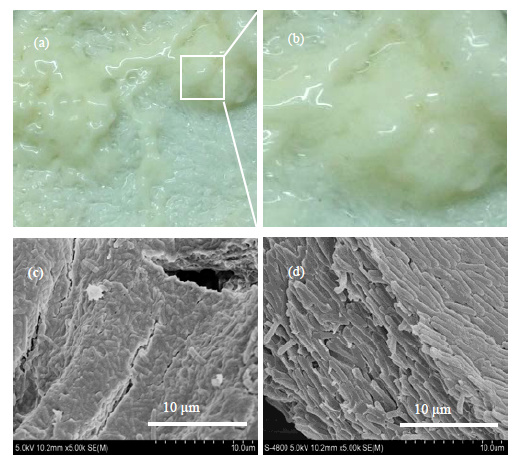
3 结果与讨论 3.1 C. acetobutylicum CGMCC 5234的BF形态结构微生物附着到固体表面,会不断聚集形成成熟的BF结构,BF的形成与环境、载体、菌体相关,形成的BF的表型,厚薄程度等均影响着微生物的代谢性能以及耐受性。以棉纤维织品作为载体,进行固定化丙酮丁酮梭菌发酵制备丁醇。发酵过程中丙酮丁醇梭菌生物膜形成过程为:细胞由发酵液中运动吸附到载体表面上,随着细胞增殖的进行,大量细胞稳定黏附到载体上,产生胞外基质并形成微菌落;直至细胞大量聚集、堆积,并被丰富的胞外基质包裹形成稳定的成熟生物膜[26]。连续批次发酵进行4批次后,棉纤维上形成的BF形态如图 1所示,宏观上 (图 1(a)、(b)) BF为白色黏液状团聚体,粘附在棉纤维表面;SEM微观表征BF,发现细胞聚集成群,形成膜状整体 (图 1(c)),且胞堆积形成致密多层结构 (图 1(d))。
|
图 1 摇瓶培养的丙酮丁醇梭菌BF宏观及微观形态 Fig.1 Digital images (a, b) and SEM micrographs (c, d) of the biofilm of C. acetobutylicum |
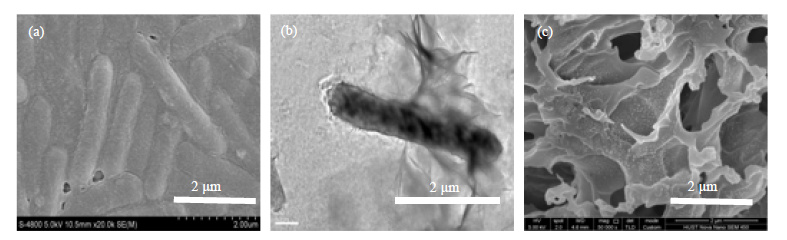
BF的微观结构对系统性能发挥也有着有显著影响,如BF中各种信号分子、营养物和代谢废弃物等的传递通道促进细胞间交流、物质传递[10, 20];EPS组成中的蛋白、多糖等促使细胞间相互连接、相互作用进而增加菌体密度并包裹细胞增加成熟生物膜稳定及耐受性[19, 22]。微观角度进一步研究BF形态,如图 2所示,发现细胞周围被一些胞外物质包裹,从而使细胞间相互连接、聚集 (图 2(a)、(b));BF经0.1 mol⋅L-1 NaOH溶液处理,去除细胞后观察,如图 2(c),EPS为一个三维网状结构,存在大量的微米级孔结构,与图 2(a)对比,可以推测,这些孔是由于菌体的裂解而形成的。
|
图 2 BF微观形态 Fig.2 Microstructure of the biofilm (a) SEM micrograph (b) TEM micrograph (c) SEM micrograph of the sample treated with 0.1 mol⋅L-1 NaOH |
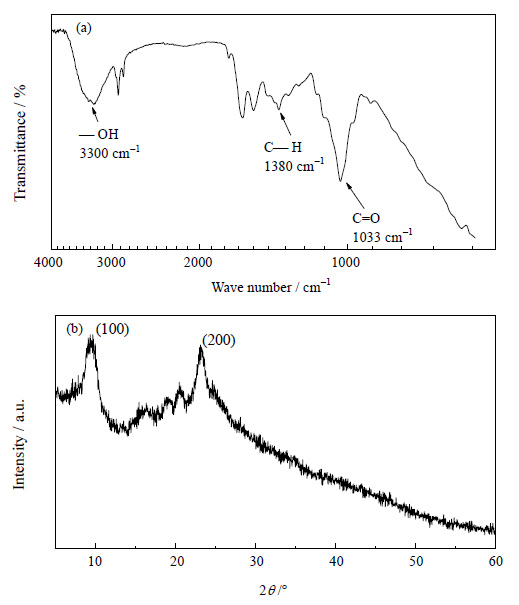
FT-IR、XRD是能够定性分析出多糖存在的常规手段。对收集的三维网状结构物质进行FT-IR分析,如图 3(a)所示,3300 cm-1左右为-OH伸缩振动峰,1380 cm-1左右为C-H振动峰,1033 cm-1左右为C=O振动峰,代表了多糖中碳链,羟基、醛基基团的存在,与文献报道的胞外多糖表征结果相近[10]。XRD (图 3(b)) 表征发现,在2θ约为10°、24°左右出峰,依次对应纤维素 (100)、(200) 晶面,由此可推断出该网状结构主要含有纤维素类胞外多糖。多糖是EPS中重要组成部分,与细胞粘附、抗性和BF形成有着紧密联系。综上所述,分析BF形态结构与组成发现,丙酮丁醇梭菌BF是以多糖为主要支撑结构,细胞由胞外基质相互连接,堆积,被胞外基质覆盖,形成的三维立体,粘液状物质。
|
图 3 BF经0.1 mol⋅L-1 NaOH溶液处理后红外 (a) 及XRD (b) 分析 Fig.3 FT-IR (a) and XRD (b) results of the biofilm treated with 0.1 mol⋅L-1 NaOH |
BF的胞外基质主要由细胞分泌物、裂解物,以及代谢、营养传递物组成,包含大量生物大分子及相应的无机盐等物质,胞外基质与BF的形成、稳定,信息传递,代谢催化密切相关[9, 10]。96孔板微量培养丙酮丁醇梭菌BF,分别经Proteinase K、DNase I、猪胰脂肪酶、纤维素酶处理后宏观及微观形态如图 4所示,同空白对照组 (加入等量的去离子水) 相比,宏观上 (数码相机下),薄膜都有一定程度上的降解,其中经Proteinase K及纤维素酶处理后,薄膜几乎完全降解,形成较为透亮的溶液。经DNase I,猪胰脂肪酶处理后,膜状整体的BF结构被破坏,形成较为浑浊的溶液。微观上 (SEM),经Proteinase K处理后,膜结构上出现许多孔状结构;纤维素酶处理后膜结构被破坏,细菌聚集较为松散,无明显膜状结构;DNase I处理后膜的整体结构上出现裂纹;脂肪酶处理后,膜结构无明显变化。

|
图 4 经不同酶处理后的BF宏观及微观形态 Fig.4 Macroscopic (subscript 1) and microscopic (subscript 2) images of the biofilm treated with different enzymes (a) control (b) proteinase K (c) DNase I (d) lipase (e) cellulase |
结合形态变化及相关文献[10, 19, 22]可推断出,丙酮丁醇梭菌胞外基质中含有蛋白、多糖、核酸和脂肪类物质,各组分在BF结构中起着不同的作用。多糖在膜结构中起着重要的结构支撑作用,蛋白镶嵌其中。胞外基质各组成成分在BF的形成过程中均扮演重要角色,其中蛋白,多糖参与BF形成中细胞的初始附着,维持BF结构的稳定[11, 12, 19],核酸及脂类在BF中比例较少,参与细胞的附着,更多的是维持细胞间信号分子、代谢物的传递[13, 14]。
3.3 丙酮丁醇梭菌BF组成含量分析 3.3.1 细胞含量分析微生物细胞是形成BF的基础,BF内细胞被胞外基质包裹,难以计量,有效地分析BF内细胞含量,是评估BF活性的重要方法[27]。游离细胞的干重与细胞数目间存在较好的线性关系,选取不同时期的丙酮丁醇梭菌,采用血球计数法计量溶液细胞数目,并用冻干后称重,得到细胞数目与干重如表 1所示,线性相关性为:y=0.14391x+0.0178,R2=0.989(x:108 CFU⋅mL-1,y:mg⋅mL-1),因此游离细胞浓度约 (6.70±0.15) x108 CFU⋅mg-1。
| 表 1 不同生长周期的丙酮丁醇梭菌细胞数与细胞干重之间相关性 Table 1 Relationship between cell number and dry weight of C. acetobutylicum at different growth phases |
以SEM图对BF中细胞进行计数,选取20 k倍下四幅图,如图 5所示,得到的固定化细胞为0.71~1.59 CFU×μm-2,细胞直径为0.41~0.61 μm,则BF中总细胞数约为:1.74~2.60 CFU×μm-3,结合游离细胞浓度,则BF中细胞浓度为:2.60~3.89 mg⋅mL-1。BF干重为~115 mg⋅mL-1,因此丙酮丁醇梭菌细胞约为BF干重的2.26%~3.38%。

|
图 5 20 k倍下SEM观察BF中细胞数目 Fig.5 SEM micrographs of cells in BF for cell number cou nting (×20 k) |
多糖是胞外基质的主要部分,是BF形成必不可少的部分,参与BF的粘附、形成过程,维持成熟BF的结构稳定。蛋白也是BF基质的重要组成,种类繁多,包括酶,外源凝集素和结构蛋白等,维持细胞间相互连接。多糖及蛋白的含量、种类影响BF的形成以及稳定[10]。
由于丙酮丁醇梭菌BF中细胞含量低,为了EPS提取的较为充分,本文采用酶法与碱处理结合法,忽略细胞裂解后释放的物质。BF的三维结构较为稳固,由图 4可看出,经纤维素酶处理后生物膜宏观上裂解,微观上细胞松散,无明显结构;经蛋白酶处理后宏观上生物膜降解,微观上含有许多孔结构,这表明多糖、蛋白在结构中起重要的作用。为使提取的胞外基质更为完全,因此在测定蛋白含量时,加入纤维素酶处理EPS;相应的测量多糖含量时,加入蛋白酶处理EPS,破坏生物膜结构,使胞外基质更好地释放。
分别经24 mL蛋白酶、0.9% NaCL、2次0.1 mol⋅L-1 NaOH溶液提取EPS后,多糖含量如表 2所示,多糖约占BF干重的 (36.09±1.00)%。分别经8 mL纤维素酶 (6.71 mg⋅mL-1)、0.9% NaCL、2次0.1 mol⋅L-1 NaOH溶液提取后,蛋白含量如表 2所示,蛋白约占BF干重的 (23.86±1.58)%。
| 表 2 EPS中多糖,蛋白含量 Table 2 Polysaccharide and protein contents in EPS |
胞外DNA是细胞自身裂解或分泌产生,量较少,但也是胞外基质以及BF的有效组分,参与细胞粘附、遗传信息的传递等过程。脂类也在基质中被发现,脂多糖对粘附的发生至关重要,脂类同时也使胞外基质具有疏水性质,增强了粘附[10, 13, 14]。于2 mL离心管中培养的微量BF用于差值法测定核酸及脂类含量如表 3所示,空白对照组冻干后失去的质量为水;经DNase I处理后,加水离心去除上清液后再冻干,失去的质量为水和核酸。同理,经脂肪酶处理后,冻干前后失去的质量为水和脂类。因此BF中核酸含量为 (4.05±2.00)%,脂类含量为:(10.85±2.00)%。
| 表 3 EPS中核酸、脂类含量 Table 3 Nucleic acid and lipid contents in EPS |
一些学者对EPS各组分含量进行了研究,Cenyhan等[28]研究石油化工易污染设备的细菌生物膜发现,多糖含量24%~56%,蛋白含量为10%~28%;Kiemle等[29]研究带藻生物膜发现多糖占52%~76%,蛋白含量为2%~10%;Jahn等[30]采用离子交换树脂法提取恶臭假单胞杆菌生物膜的EPS,其中蛋白含量占6%~12%,多糖含量为12%~44%,核酸、脂类达13%~28%。不同微生物的BF各组分含量不同,但蛋白、多糖为主要组分,这对于生物膜的粘附、结构稳定起着重要作用。对于丙酮丁醇梭菌BF组分含量的分析较为符合文献报道,多糖、蛋白占主要成分。
4 结论固定化发酵过程中,发酵液中的纤维表面会粘附丙酮丁醇梭菌,形成BF。结合电子显微分析等研究发现,发酵液中的丙酮丁醇梭菌在纤维表面发生细胞粘附、相互聚集和堆积,随着细胞增殖的进行,最终获得被胞外基质所包裹的三维网状结构,宏观上表现为粘液状聚集体。进行组成剖析研究,发现BF由细胞和胞外基质组成,并且胞外基质含有胞外多糖、蛋白、核酸和脂类等成分,其中多糖类物质在BF结构中起重要的结构支撑作用。对各组分的含量结合物理化学法等分析测定,发现细胞、多糖、蛋白、核酸和脂类含量分别为:2.26%~3.38%、(36.09±1.00)%、(23.86±1.58)%、(4.05±2.00)%和 (10.85±2.00)%。为进一步了解BF,将其应用于丁醇连续发酵提供了一定的理论基础。
| [1] | Xue C, Zhao X Q, Liu C G, et al. Prospective and development of butanol as an advanced biofuel[J]. Biotechnology Advances , 2013, 31(8): 1575-1584. DOI:10.1016/j.biotechadv.2013.08.004. |
| [2] | LI Zhi-gang(李志钢), WU Hao(吴昊), JIANG Min(姜岷), et al. The immobilization of Clostridium acetobutylicum by adsorbing on the inorganic carrier material and its application(Clostridium acetobutylicum细胞的无机载体吸附固定化及其应用研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2012, 26(5): 846-852. |
| [3] | Garnett J A, Matthews S. Interactions in bacterial biofilm development:A structural perspective[J]. Current Protein and Peptide Science , 2012, 13(8): 739-755. DOI:10.2174/138920312804871166. |
| [4] | Berk V, Fong J C, Dempsey G T, et al. Molecular architecture and assembly principles of vibrio cholerae biofilms[J]. Science , 2012, 337(6091): 236-239. DOI:10.1126/science.1222981. |
| [5] | HAO Xiao-di(郝晓地), LAN Li(兰荔), ZHANG Lu-ping(张璐平). The influence of biofilms on daily production and life(生物膜对日常生产、生活的影响与作用)[J]. Earth and Environment(地球与环境) , 2008, 36(3): 251-255. |
| [6] | LIU Dong (柳东). Metabolic engineering of Clostridium acetobutylicum and process development for efficient biobutanol production(丙酮丁醇梭菌代谢调控及高效发酵工艺研究) [D]. Nanjing (南京): Nanjing Technology University (南京工业大学), 2013 |
| [7] | Thompson K M, Abraham N, Jefferson K K. Staphylococcus aureusextracellular adherence protein contributes to biofilm formation in the presence of serum[J]. FEMS Microbiology Letters , 2010, 305(2): 143-147. DOI:10.1111/fml.2010.305.issue-2. |
| [8] | ZHU Si-xia(祝思霞). The research process of basic characteristic of bacterial biofilm(细菌生物膜的基本特性研究进展)[J]. Science & Technology Vision(科技视界) , 2014(30): 330-331. |
| [9] | Alpkvist E, Picioreanu C, van Loosdrecht M C, et al. Three-dimensional biofilm model with individual cells and continuum EPS matrix[J]. Biotechnology and Bioengineering , 2006, 94(5): 961-79. DOI:10.1002/(ISSN)1097-0290. |
| [10] | Flemming H C, Wingender J. The biofilm matrix[J]. Nature Reviews Microbiology , 2010, 8(9): 623-33. |
| [11] | Tielen P, Rosenau F, Wilhelm S, et al. Extracellular enzymes affect biofilm formation of mucoid Pseudomonas aeruginosa[J]. Microbiology , 2010, 156(Pt 7): 2239-2252. |
| [12] | Tielker D, Hacker S, Loris R, et al. Pseudomonas aeruginosa lectin LecB is located in the outer membrane and is involved in biofilm formation[J]. Microbiology , 2005, 151(Pt 5): 1313-1323. |
| [13] | Whitchurch C B, Nielsen T T, Ragas P C, et al. Extracellular DNA required for bacterial formation[J]. Science , 2002, 295(5559): 1487-1487. DOI:10.1126/science.295.5559.1487. |
| [14] | Sand W, Gehrke T. Extracellular polymeric substances mediate bioleaching/biocorrosion via interfacial processes involving iron (Ⅲ) ions and acidophilic bacteria[J]. Research in Microbiology , 2006, 157(1): 49-56. DOI:10.1016/j.resmic.2005.07.012. |
| [15] | Laocharoen S, Plangklang P, Reungsang A. Selection of support materials for immobilization of Burkholderia cepacia PCL3 in treatment of carbofuran-contaminated water[J]. Environmental Technology , 2013, 34(18): 2587-2597. DOI:10.1080/09593330.2013.781226. |
| [16] | JIANG Lin (江凌). Study on butyric acid production from cheap biomass by clostridium tyrobutyricum immobilized in a fibrous bed biofeacter (纤维床固定化酪丁酸梭菌发酵廉价生物质生产丁酸的研究) [D]. Guangzhou (广州): South China University of Technology (华南理工大学), 2010. |
| [17] | ZHOU Tao (周涛). The study on efficient production of butanol by immobilizing clostridium acetobutylicum on fibrous material CTF (纤维材料CTF 固定化丙酮丁醇梭菌高效发酵产丁醇的研究) [D]. Nanjing (南京): Nanjing Technology University (南京工业大学), 2013. |
| [18] | Huang W C, Ramey D E, Yang S T. Continuous production of butanol by Clostridium acetobutylicum immobilized in a fibrous bed bioreactor[J]. Applied Biochemistry & Biotechnology , 2004, 115(1-3): 887-898. |
| [19] | Ma L, Wang L, Wang D, et al. The roles of biofilm matrix polysaccharide Psl in mucoid Pseudomonas aeruginosa biofilms[J]. FEMS Immunology & Medical Microbiology , 2012, 65(2): 377-380. |
| [20] | Hong H, Hegde M, Kim J, et al. Synthetic quorum-sensing circuit to control consortial biofilm formation and dispersal in a microfluidic device[J]. Nature Communications , 2012, 3(613): 1-8. |
| [21] | Kolodkin-Gal I, Romero D, Cao S, et al. D-amino acids trigger biofilm disassembly[J]. Science , 2010, 328(5978): 627-629. DOI:10.1126/science.1188628. |
| [22] | Lasa I, Penades J R. Bap:a family of surface proteins involved in biofilm formation[J]. Research in Microbiology , 2006, 157(2): 99-107. DOI:10.1016/j.resmic.2005.11.003. |
| [23] | Dubois M, Gilles K A, Hamilton J K. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry , 1956, 28(3): 350-357. DOI:10.1021/ac60111a017. |
| [24] | Anderson M J, Parks P J, Peterson M L. A mucosal model to study microbial biofilm development and anti-biofilm therapeutics[J]. Journal Microbiological Methods , 2013, 92(2): 201-208. DOI:10.1016/j.mimet.2012.12.003. |
| [25] | Semenyuk E G, Laning M L, Foley J, et al. Spore formation and toxin production in clostridium difficile biofilms[J]. PLoS One , 2014, 9(1): e87757. DOI:10.1371/journal.pone.0087757. |
| [26] | Zhuang W, Yang J, Wu J L, et al. Extracellular polymer substances and the heterogeneity of clostridium acetobutylicum biofilm induced tolerance to acetic acid and butanol[J]. RSC Advances , 2016, 6(40): 33695-33704. DOI:10.1039/C5RA24923F. |
| [27] | Lazarova V, Menem J. Biofilm characterization and activity analysis in water and wastewater treatment[J]. Water Research , 1995, 29(10): 2227-2245. DOI:10.1016/0043-1354(95)00054-O. |
| [28] | Ceyhan N, Ozdemir G. Extracellular polysaccharides produced by cooling water tower biofilm bacteria and their possible degradation[J]. Biofouling , 2008, 24(2): 129-135. DOI:10.1080/08927010801911316. |
| [29] | Kiemle S N, Domozych D S, Gretz M R. The extracellular polymeric substances of desmids (conjugatophyceae, streptophyta):chemistry, structural analyses and implications in wetland biofilms[J]. Phycologia , 2007, 46(6): 617-627. DOI:10.2216/06-97.1. |
| [30] | Jahn A, Griebe T, Nielsen P H. Composition of pseudomonas putidabiofilms:accumulation of protein in the biofilm matrix[J]. Biofouling , 1999, 14(1): 49-57. DOI:10.1080/08927019909378396. |




