2. 南京工业大学 材料化学工程国家重点实验室,江苏 南京 210009
2. State Key Laboratory of Materials-Oriented Chemical Engineering, Nanjing Tech University, Nanjing 210009, China
乙酸乙酯是一种快干性绿色有机溶剂,其在各种脂肪酸酯中应用最为广泛[1-2],乙酸乙酯生产过程中会排放一定量的高浓度有机废水,其中大多数是混合性废水,主要成分为乙酸乙酯和乙醇,这些废水不仅排放量大,而且无法直接循环利用,必须经过有效处理才可以安全排放[3-5]。国内外学者对于酯化废水的处理研究较多[6-10]。其中,通过将有机废水汽化成有机废气后进行催化氧化处理的方法受到了一定关注[11]。目前,关于VOCs催化氧化动力学的模型较多,大致可以分为经验幂级数模型和基于表面反应控制机理的动力学模型等[12]。其中经验幂级数模型可以体现温度、浓度对反应的影响,虽不能描述VOCs催化氧化反应的反应机理,但由于其具有结构简单,参数少,可以精确预测和计算反应进程等优点被广泛采用[13-15]。
工业生产过程中实际排放的有机废弃物成分均较复杂,当多组分有机废弃物经历催化氧化反应时,不同组分都有各自的氧化反应速率,必须要分别研究各个组分的氧化反应动力学,需要准确测定氧化反应前后各组分的浓度变化,最终得到的动力学方程则较为复杂,利用这种动力学方程进行运算时则较为困难。而对于污染物的催化氧化治理,其关键的着眼点在于治理前后废气(水)中总耗氧量的大小,因此,能否用反应前后总耗氧量的变化代替各组分的浓度变化,这是本文提出的创新思维,即以有机物耗氧速率作为动力学方程的变量,建立一种具有普适性的催化氧化反应动力学方程,在使用动力学方程时不需要精确测定原废气(水)中各组分的浓度,而仅需要测定原废气(水)中有机杂质总的耗氧速率,达到简化方程及简化计算的目的。
本文在自制的铈铜复合氧化物催化剂上,通过将有机废水汽化成有机废气后,进入固定床反应器中进行催化氧化反应,将废水中的有机物净化处理,考察了不同工艺条件下废水的净化效果以得到乙酸乙酯废水催化氧化最佳工艺条件。并在消除催化剂外扩散影响前提下,建立了以耗氧速率为变量的乙酸乙酯和乙醇混合体系催化氧化宏观反应动力学模型并拟合出模型参数。
2 实验部分 2.1 主要试剂乙酸乙酯,分析纯,阿拉丁化学试剂有限公司;乙醇,分析纯,阿拉丁化学试剂有限公司;氧气,纯度99.9 %,南京特种气体有限公司;氮气,纯度99.9 %,南京特种气体有限公司;复合金属氧化物化剂(活性成分为铈铜复合氧化物),课题组自制。
2.2 实验装置和流程本实验主要使用固定床反应综合实验装置,该装置由质量流量控制器、电加热炉、制冷系统、气液分离器构成,用于乙酸乙酯废水催化氧化反应工艺及动力学实验数据的测定,装置流程如图 1所示。
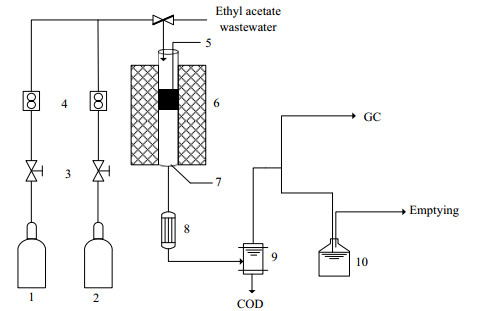
|
图 1 实验装置示意图 Fig.1 Schematic diagram of the experimental setup 1. O2 cylinder 2. N2 cylinder 3. valve 4. gas flowmeter 5. thermocouple 6. heating furnace 7. reactor 8. condenser 9. gas-liquid separator |
反应在常压下进行,N2和O2经过质量流量计与高压恒流泵泵出的乙酸乙酯废水通过三通混合进入固定床反应器,废水中的有机物与氧气充分混合,经过预热器将废水气化后,在催化剂作用下进行反应,固定床催化氧化反应器出口处的气体经过冷凝系统冷却对液体收集处理,不凝气体排空,并在气体和液体取样口处收集样品进行分析。
2.3 分析方法挥发性有机物(VOCs)采用SP-6890型气相色谱(山东鲁能瑞虹化工仪器有限公司)分析,选用氢火焰离子检测器;色谱柱为石英毛细管,规格0.25 mm×30 m×0.33 μm,固定相为XE-60。色谱条件:柱温60 ℃,检测室温度130 ℃,汽化室温度130 ℃,载气压力0.1 MPa,空气压力0.09 MPa,H2压力0.105 MPa,色谱数据处理系统为浙江大学开发的N2000色谱工作站。
图 2a为乙酸乙酯废水催化氧化后尾气的色谱分析图,图中出现4个峰,采用叠加峰法定性分析固定床反应器出口尾气中的成分。具体操作为在洗气瓶中装有甲醇、乙醇和乙酸乙酯3种液态纯物质,然后分别将反应尾气通入洗气瓶,并夹带瓶中液相纯物质上方的饱和蒸汽进入气相色谱分析,依次可得到3个气相色谱分析图,如图 2c、d和e所示,甲烷气体与尾气混合后进入气相色谱的分析结果如图 2b所示。由图 2可以看出,通过叠加峰法,尾气夹带纯物质进入色谱后,有一个峰信号明显增强,可判定该峰所对应的成分即为该物质,同时发现尾气出峰数量仍为4个,因此,可以判定尾气中的有机物成分依次为甲烷、甲醇、乙醇和乙酸乙酯。
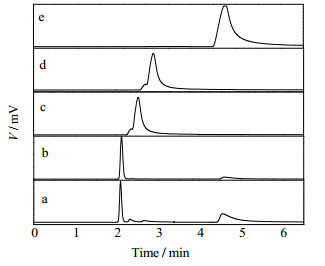
|
图 2 尾气气相色谱定性分析谱图 Fig.2 Gas chromatographic qualitative spectra of reaction products |
实验采用外标法进行分析,选取尾气中的4种成分甲烷、甲醇、乙醇和乙酸乙酯作为外标物质。得到不同气相进样浓度与所得峰面积之间的关系,线性拟合出标准曲线,按此标准可以换算得到测量气体的浓度。
冷凝液化学需氧量(COD)分析采用6B-200型COD速测仪(江苏盛奥华环保科技有限公司),采用重铬酸钾氧化消解光度法作为分析手段。具体的方法为在样品中添加已知量的重铬酸钾溶液,然后加入一定量的浓硫酸溶液,经165 ℃温度下消解后,重铬酸钾被还原为Cr3+,在特定波长下可得出Cr3+所含含量,以此求出样品的COD值[16]。
其中,乙酸乙酯废水的COD值为CODEA(mgO2·m-3),反应后冷凝液的COD值为CODout(mgO2·m-3),乙酸乙酯废水气化后的气相中有机物的耗氧量为CEA(mgO2·m-3),反应后的冷凝液对应的气相中有机物的耗氧量为COUT(mgO2·m-3),反应后尾气中有机物的耗氧量为CVOC(mgO2·m-3),乙酸乙酯废水的进料体积流率为VEA(m3·h-1),进入反应器总的气相体积流率为V总(m3·h-1),CEA用(1),COUT用(2)进行计算,乙酸乙酯废水中有机杂质转化率X计算式为式(3)。
| $ \[{{C}_{\text{EA}}}=\frac{{{V}_{\text{EA}}}\text{CO}{{\text{D}}_{\text{EA}}}}{{{V}_{总}}}\ \ \ \ \text{m}{{\text{g}}_{{{\text{o}}_{\text{2}}}}}\cdot {{\text{m}}^{\text{-3}}}\] $ | (1) |
| $ \[{{C}_{\text{out}}}=\frac{{{V}_{\text{out}}}\text{CO}{{\text{D}}_{\text{out}}}}{{{V}_{zzz}}}\ \ \ \ \ \ \text{m}{{\text{g}}_{{{\text{o}}_{\text{2}}}}}\cdot {{\text{m}}^{-3}}\] $ | (2) |
| $ X = \frac{{{C_{{\rm{EA}}}} - {C_{{\rm{OUT}}}} - {C_{{\rm{VOC}}}}}}{{{C_{{\rm{EA}}}}}} \times 100\% $ | (3) |
影响乙酸乙酯催化氧化反应工艺的因素主要有气体空速、反应温度和氧气浓度,本文考察了上述3个因素对乙酸乙酯废水催化氧化效果的影响,结果如图 3及4所示。选取原料为w = 1%乙酸乙酯和ω = 0.5%乙醇的混合溶液为处理对象,混合液汽化后与空气混合,混合气中氧气浓度为φ = 6%,在常压条件下进行反应,考察了不同反应温度下,催化剂空速(GHSV)和温度对乙酸乙酯废水催化氧化效果的影响,总气体体积空速在5 000~17 000 h-1,结果如图 3所示,其中图 3的纵坐标为乙酸乙酯废水中有机杂质的转化率。
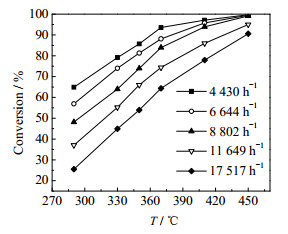
|
Fig.3 Effects of space velocity on the treatment of ethyl acetate wastewater at different temperatures |
从图 3中可以看出,随着体积空速的增加,相同温度下的乙酸乙酯废水中有机杂质转化率不断地降低,乙酸乙酯废水净化效果越来越差,这是由于随着空速增加,废水汽化后的废气中污染物在催化剂床层中的停留时间变短,导致废水净化效果变差。而在较低空速下,由于污染物在催化剂床层中停留时间较长,废水净化效果较好,但较低空速会导致催化剂用量增加,以及单位时间内废水处理量降低,最终会使企业设备成本上升。
为了考察氧气浓度对乙酸乙酯废水净化效果的影响,选取原料为ω =1%乙酸乙酯和ω = 0.5%乙醇的混合溶液,汽化后在空速为8 802 h-1,常压下,不同温度下进行反应,结果如图 4所示,其中纵坐标为乙酸乙酯废水中有机杂质的转化率。从图 4中可以看出,随着温度从350提高到450 ℃,在氧气浓度由φ = 2%提高到φ = 6%时,乙酸乙酯废水中有机杂质的转化率增加显著;而当氧气浓度大于φ = 6%时,氧气浓度对乙酸乙酯废水中有机杂质的转化率影响已不明显。从图 4中可以看出,在体积空速为8 802 h-1时,随着温度提高,乙酸乙酯废水净化效果越来越好,但过高反应温度对催化剂长周期稳定运行是不利的。因此在实际操作中以出口气体中VOCs浓度达到国家排放标准的最高空速和最合适温度作为最优选择。当反应温度为450 ℃,氧气浓度为φ = 6%时,固定床反应器出口冷凝液中COD为48 mgO2·L-1,已达到雨排水标准(《地表水环境质量标准GB3838- 2002》),出口气相各组分VOCs也符合(《大气污染物综合排放标准GB16297- 1996》),因此选择体积空速为8 802 h-1,温度450 ℃,氧气浓度为φ = 6%作为最优的工艺参数。
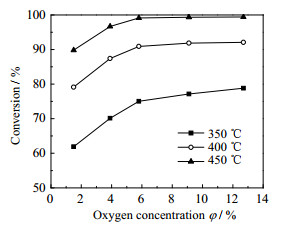
|
图 4 氧气含量对乙酸乙酯废水净化效果的影响 Fig.4 Effects of oxygen content on the treatment of ethyl acetate wastewater |
由于本实验研究包括内扩散影响在内的宏观反应动力学[17],因此只需消除催化剂外扩散影响即可。对于非均相反应,可以通过设定适当的质量空时条件来消除外扩散的影响。分别选取催化剂1.0 g和0.8 g,在反应温度为410 ℃,进料中乙酸乙酯和乙醇含量为w = 1.5% (其中w = 1%乙酸乙酯和w = 0.5%乙醇)的条件下进行反应。
图 5为催化剂质量空时(即催化剂质量W与乙酸乙酯废水进料耗氧速率F之比)对乙酸乙酯废水中有机杂质的转化率的影响之间的关系,其中,W单位是g,F的单位是gO2·h-1,由图可见W/F在小于9.1 g/ gO2·h-1时,0.8 g催化剂与1 g催化剂的转化率随质量空时的变化曲线几乎重合,这表明当W/F在小于9.1 g/ gO2·h-1 (即体积空速大于4 220 h-1)时,外扩散的影响已消除。

|
图 5 催化剂质量空时对乙酸乙酯废水中有机杂质的转化率的影响 Fig.5 Effects of mass space time on conversion of organic impurities in ethyl acetate wastewater |
乙酸乙酯废水催化氧化反应过程中,由于水蒸汽大大过量,故水蒸汽分压的变化对反应的影响可以忽略不计。本文建立了以耗氧量为变量的宏观反应动力学模型,如式(4)所示。式(4)中,F为乙酸乙酯废水气化后对应的气相有机物的耗氧速率,gO2·h-1;W为催化剂质量,g;CEA为废水气化后的对应于气相中有机物的耗氧量,mgO2·m-3;PCE是有机物耗氧量对应的氧气分压,MPa;X为乙酸乙酯废水中有机杂质耗氧量的转化率;n为有机物总理论需氧量对应的氧气过量倍数。
| $ r=-\frac{\text{d}X}{\text{d}\left( {W}/{F}\; \right)}=k{{\left[ {{C}_{\text{EA}}}\left( 1-X \right) \right]}^{\alpha }}P_{{{\text{O}}_{2}}}^{\beta }=k{{\left[ {{C}_{\text{EA}}}\left( 1-X \right) \right]}^{\alpha }}{{\left[ {{P}_{\text{CE}}}\left( n-X \right) \right]}^{\beta }}~\ \ \ \ \ \text{g}\cdot \text{g}_{{{\text{o}}_{\text{2}}}}^{\text{-1}}\cdot \text{h} $ | (4) |
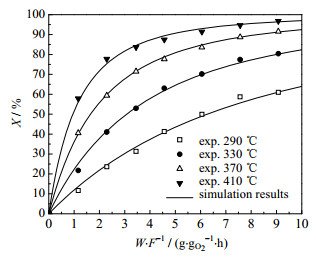
在反应温度为290~410 ℃,氧气浓度为φ = 4%下,测定了乙酸乙酯废水催化氧化宏观反应动力学数据,根据上述的宏观动力学模型,采用龙格-库塔法解微分方程,并以最小二乘法为优化方法进行估值[18],通过实验数据拟合得到反应动力学模型参数,其中,根据阿伦尼乌斯方程k= k0exp (-Ea /RT)求出该反应的活化能。表 1为拟合后得到的动力学模型参数的拟合结果。图 6为乙酸乙酯废水催化氧化的动力学模型的拟合效果图。
|
|
表 1 动力学模型参数拟合结果 Table 1 Results of fitted model parameters |
|
图 6 动力学模型拟合效果 Fig.6 Fitting results of the kinetic model |
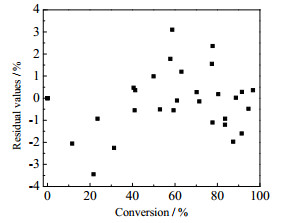
将动力学模型拟合计算的结果与实验的测量值进行比较,从图 7中可以看出,动力学模型计算的结果与实验测量值能较好地吻合,由图 8可以看出模型的计算值与实际测量值的偏差在± 4%以内,从统计学的角度说明此模型能准确地描述乙酸乙酯废水中有机杂质的催化氧化动力学行为。

|
图 7 计算值与实验值比较 Fig.7 Comparison of calculated and experimental results |
|
图 8 计算值与实验值的残差分布 Fig.8 Residual distribution of calculated and experimental results |
为了进一步说明该模型的准确性,利用复相关系数,F统计检验估值模型的显著性和可信度,复相关系数的计算式如公式(5),F统计量计算式如式(6),其中,N为参数量,M为实验数据量,计算结果见表 2。由表 2可以看出复相关系数R2=0.994>0.9,F统计量F(23, 4)= 16 528.1>10F0.01(23, 4),F统计量远远大于10F0.01(置信域=99.0 %),因此该模型是显著可信的[19]。
|
|
表 2 统计检验表 Table 2 Analysis of error statistics |
| $ {\rho ^2} = 1 - \sum\limits_{j = 1}^M {{{\left( {{X_{{\rm{exp}}, j}} - {X_{{\rm{cal}}, j}}} \right)}^2}/\sum\limits_{j = 1}^M {X_{{\rm{exp}}, j}^2} } $ | (5) |
| $ F = \frac{{\left[ {\sum\limits_{j = 1}^M {X_{{\rm{exp}}, j}^2} - \sum\limits_{j = 1}^M {{{\left( {{X_{{\rm{exp}}, j}} - {X_{{\rm{cal}}, j}}} \right)}^2}} } \right]/N}}{{\sum\limits_{j = 1}^M {{{\left( {{X_{{\rm{exp}}, j}} - {X_{{\rm{cal}}, j}}} \right)}^2}/\left( {M - N - 1} \right)} }} $ | (6) |
(1) 考察了不同温度,不同空速和不同氧气浓度对乙酸乙酯废水净化效果的影响及规律,结果表明,最佳的工艺条件为:反应温度450 ℃,氧气含量φ = 6%,总体积空速8 802 h-1。
(2) 在自制的铈铜复合氧化物催化剂上,在消除催化剂外扩散的条件下,研究了乙酸乙酯废水催化氧化宏观反应动力学,建立以耗氧速率为变量的宏观反应动力学模型,拟合得出该催化剂上乙酸乙酯废水催化氧化反应的活化能为50.17 kJ·mol-1。
| [1] |
李玉芳, 伍小明. 乙酸乙酯生产技术及市场分析[J]. 乙醛醋酸化工, 2010, 28(7): 15-19. LI Y F, WU X M. Production technology and market analysis of ethyl acetate[J]. Acetaldehyde Acetic Acid Chemical Industry, 2010, 28(7): 15-19. |
| [2] |
MA Y, CHEN M, SONG C, et al. Catalytic Oxidation of Toluene, Acetone and Ethyl Acetate on a New Pt-Pd/Stainless Steel Wire Mesh Catalyst[J]. Acta Physico Chimica Sinica, 2008, 24(7): 1132-1136. DOI:10.1016/S1872-1508(08)60047-9 |
| [3] |
王赟.醋酸乙酯废水处理系统开发及若干关键技术研究[D].上海: 华东理工大学, 2011. WANG Y. Development of the wastewater treatment system for post acetic ether manufacturing process and on the key technical problems within[D]. Shanghai: East China University of Science and Technology, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10251-1011174991.htm |
| [4] |
张立省, 张超, 何晓芳.一种乙酸乙酯生产中回收废水循环利用的方法[P]. CN: 101100329A, 2008-01-09.ZHANG L S, ZHANG C, HE X F. Method for recycling waste water recovered in ethyl acetate production[P]. CN: 101100329A, 2008-01-09.. |
| [5] |
GENEVA. Encyclopedia of occupational health and safety[J]. International Labour Office, 1983, 11(5): 782-785. |
| [6] |
杨攀峰.高浓度丙烯酸及其酯类废水生物处理技术开发与工业化应用[D].北京: 北京化工大学, 2015. YANG P F. Technological development and application on bio-treatment of high-concentration acrylic acid wastewater[D]. Beijing: Beijing University of Chemical Technology, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10010-1016322965.htm |
| [7] |
何琳, 杨新春. 汽提-双效汽化-焚烧法处理丙烯酸及酯装置废水[J]. 石化技术与应用, 2017, 35(4): 314-316. HE L, YANG X C. Wastewater of acrylic acid and acrylic ester unit treated by steam stripping-double effect evaporation-incineration method[J]. Petrochemical Technology & Application, 2017, 35(4): 314-316. DOI:10.3969/j.issn.1009-0045.2017.04.016 |
| [8] |
JI D R, CHANG C C, WU Y L, et al. Treatment of methyl methacrylate from semiconductor wastewater by catalytic wet oxidation[J]. Journal of the Taiwan Institute of Chemical Engineers, 2010, 41(2): 209-215. DOI:10.1016/j.jtice.2009.06.003 |
| [9] |
EL-DESSOUKY H, ETTOUNEY H, AL-FULAIJ H, et al. Multistage flash desalination combined with thermal vapor compression[J]. Chemical Engineering and Processing, 2000, 39(4): 343-356. DOI:10.1016/S0255-2701(99)00098-7 |
| [10] |
MABROUK A A, NAFEY A S, FATH H E S. Thermoeconomic analysis of some existing desalination processes[J]. Desalination, 2007, 205(1-3): 354-373. DOI:10.1016/j.desal.2006.02.059 |
| [11] |
魏日出, 陈洪林, 张小明. 汽化浓缩-催化氧化耦合法处理草甘膦生产废水[J]. 工业催化, 2012, 20(10): 68-71. WEI R C, CHEN H L, ZHANG X M. Treatment of glyphosate waste stream by the distillation-catalytic oxidation coupling process[J]. Industrial Catalysis, 2012, 20(10): 68-71. DOI:10.3969/j.issn.1008-1143.2012.10.015 |
| [12] |
KAMAL M S, RAZZAK S A, HOSSAIN M M. Catalytic oxidation of volatile organic compounds (VOCs)-A review[J]. Atmospheric Environment, 2016, 140: 117-134. DOI:10.1016/j.atmosenv.2016.05.031 |
| [13] |
HE C B, PAN K L, CHANG M B. Catalytic oxidation of trichloroethylene from gas streams by perovskite-type catalysts[J]. Environmental Science & Pollution Research, 2018, 25(2): 1-11. |
| [14] |
MEYER C I, BORGNA A, MONZ N A, et al. Kinetic study of trichloroethylene combustion on exchanged zeolites catalysts[J]. Journal of Hazardous Materials, 2011, 190(1-3): 903-908. DOI:10.1016/j.jhazmat.2011.04.007 |
| [15] |
YANG Y, YU G, DENG S, et al. Catalytic oxidation of hexachlorobenzene in simulated gas on V2O5-WO3/TiO2 catalyst[J]. Chemical Engineering Journal, 2012, 192: 284-291. DOI:10.1016/j.cej.2012.03.069 |
| [16] |
OHRA-AHO T, LINNEKOSKI J. Catalytic pyrolysis of lignin by using analytical pyrolysis-GC-MS[J]. Journal of Analytical & Applied Pyrolysis, 2015, 113: 186-192. |
| [17] |
李默君.低浓度甲烷催化燃烧泡沫碳化硅整体式催化剂制备及本征动力学研究[D].北京: 北京化工大学, 2013. LI M J. Investigation of preparation and inteinsic kinetics of silicon carbide monolithic catalysts for the catalytic conbustion of lean methane[D]. Beijing: Beijing University of Chemical Technology, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10010-1013266466.htm |
| [18] |
黄华江. 实用化工计算机模拟:MATLAB在化学工程中的应用[M]. 北京: 化学工业出版社, 2004. HUANG H J. Practical chemical computer simulation:Application of MATLAB in chemical engineering[M]. Beijing: Chemical Industry Press, 2004. |
| [19] |
袁志发, 宋世德. 多元统计分析[M]. 北京: 科学出版社, 2009. YUAN Z F, SONG S D. Multivariate statistical analysis[M]. Beijing: Science Press, 2009. |




