2. 浙江省化工高效制造技术重点实验室,浙江大学化学工程与生物工程学院,浙江 杭州 310027
2. Zhejiang Provincial Key Laboratory of Advanced Chemical Engineering Manufacture Technology, College of Chemical and Biological Engineering, Zhejiang University, Hangzhou 310027, China
含氮化合物广泛存在于自然界的许多天然产物中[1],是有机合成的重要组成部分。因其独特的生物活性,广泛应用于药物结构中,如抗癌类和精神类药物、抗生素、治疗心血管疾病的药物。除医药[2]外,含氮化合物还用于农药[3]和含氮杂环碳烯化学[4]等研究领域。因此,如何简易、高效地构筑C-N键是化学工业的研究热点。
构筑C-N键的方法有多种,比如:重排反应、缩合反应、还原胺化和偶联反应等。其中,过渡金属催化的偶联反应[5],因原料来源简单、反应条件较温和、收率高等优点受到了广泛关注。相较于Pb、Ni等金属,Cu因价格低廉、毒性较低[6],将其用于C-N偶联反应是绿色化学工业化的一个挑战性课题[7]。最早的铜催化偶联反应要追溯到1901年发现的Ullman反应,仅限于合成联芳烃。1903年,铜催化的C-N偶联的Ullmann反应首次被报道,之后就广泛用于C-N键的构筑。传统的Ullmann反应条件比较苛刻,往往需要较高的温度(高达200℃)、强碱以及过量的铜源,并且反应的收率和选择性低。自Ma等[8]研究发现铜催化芳基卤化物与氨基酸反应可以制备N-芳基氨基酸,从而铜催化的偶联反应得到了突破。其后姚江潮等[9]又发现CuI可以催化芳基卤化物与α-氨基酸的偶联反应,在较低的温度下生成了N-芳基氨基酸,并且收率颇高。因此证明了氨基酸在此类Ullmann反应中具有加速反应的促进作用,从此拉开了配体促进铜催化Ullmann反应的序幕。配体的引入之所以能够大大改善传统Ullman反应的效率,主要是因为一方面提高了Cu催化剂在溶液中的溶解度,另一面是提高了Cu催化的活性。因此,Cu作为廉价低毒的金属催化剂用于Ullman反应的催化潜力被进一步发掘。引入配体的Ullmann反应仅需要催化量的Cu催化剂,条件趋于温和,反应速度和收率都有了大幅度的提高。近二十多年来,化学工业围绕配体的设计、筛选和制备做了大量的工作[10]。Cu是第一周期过渡金属,和Pd相比更“硬”,所以Cu与N、O的鳌合能力要更强。因此,本文根据配体的类型如N-N类、N-O类和O-O类配体等,介绍铜催化Ullmann C-N偶联反应。
2 N-N类配体的催化体系N-N双齿配体是最早应用于Ullmann型C-N偶联反应的配体,它既可以通过由sp3杂化氮原子上的孤对电子与铜配位完成催化,也可以通过吡啶类sp2杂化氮原子上的孤对电子与铜进行鳌合,其主要有二胺类[11]、席夫碱[12]等氮杂类[13]N-N双齿配体。二胺类配体无疑在铜催化C-N偶联反应上展现出了出色的催化效果。但是在一些比较特殊的反应中,二胺的催化效果一般,需要高温和较大的负载量。于是,一些新颖且高效的氮杂类N-N配体应运而生,在低温甚至室温下催化了偶联反应。但是同样也存在一些问题,通常需要价格较高的溶剂和碱。图 1示出了主要的N-N双齿型配体。
|
图 1 N-N类配体的主要类型 Fig.1 Typical N-N ligands |
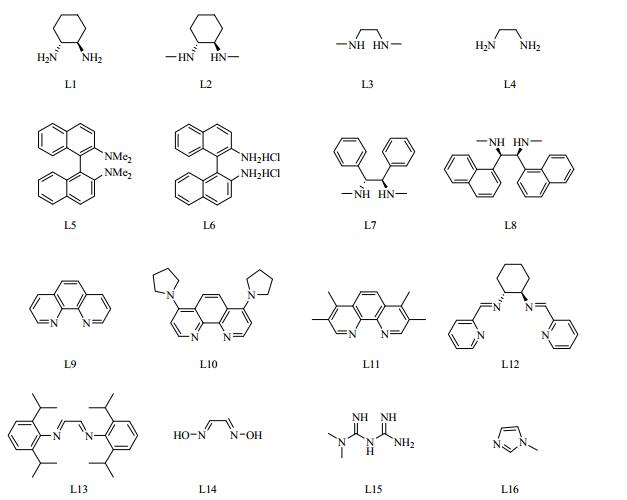
二胺类配体多以乙二胺和环己二胺为骨架。Klapars等[14]首次报道了以二胺为配体,采用弱碱和非极性溶剂的铜催化C-N偶联反应。发现外消旋的反-1, 2-环己二胺能够有效的催化酰胺与卤代芳烃的偶联反应。随后,又在铜催化芳基卤化物和吲哚的偶联反应中, 分别以商业可得的N, N’-二甲基环己二胺(L2)和1, 2-环己二胺(L1)为配体,发现L2比未修饰的L1的催化效果更佳[15] (式1)。李艳忠等[16]也报道过L2作配体能有效促进铜催化二烯基碘化物和酰胺的偶联反应。在100℃下回流,合成了二取代或三取代的N-酰基吡咯,收率为32%~92%。
|
(1) |
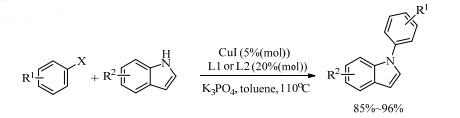
受L2配体的启发,N, N’-二甲基乙二胺(L3)作配体的反应也被陆续报道。Hosseinzadeh等[17]同样以L3为配体,采用KF和Al2O3来代替常见的碱,使反应条件更加温和。仅在60~75℃下就实现了CuI催化苯基脲和芳基碘化物的C-N偶联反应,且收率良好(70%~88%)。研究发现,芳基碘化物的电子效应对反应没有显著的影响。另外,芳基溴化物在此催化体系下,不能和苯脲进行C-N偶联反应(式2)。同样在CuI/ L3的催化体系下,Phillips等[18]尝试用CsF来代替常用的强碱,在室温下CsF足以促进酰胺与芳基卤化物的偶联反应。2016年,Jeon等[19]在不加碱的条件下,以DMSO为溶剂,氨水为亲核试剂,仅以10%(mol)的CuI和15%(mol)的L3高效催化了芳基碘化物、溴化物的偶联反应,收率高达99%,但是反应温度则较高(130℃)。
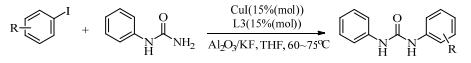
|
(2) |
Rao等[20]考察了1, 1'-联二萘胺(BINAM)和其衍生物,发现N, N, N’, N’-四甲基BINAM(L5)是CuI催化芳基碘化物和吲哚的N-芳基化反应最高效的配体。选择低沸点溶剂乙腈作为反应介质,仅在82℃下即可得到N-芳基化吲哚,且没有生成C-芳基化产物,具有高度的选择性。Shen等[21]又将1, 1'-二萘基-2, 2'-二胺二盐酸盐(L6)应用到C-N偶联反应中。各种芳基/杂芳基碘化物或溴化物与亚氨腙都能进行偶联反应,以优异的产率合成了相应的N-芳基咪唑。
近年来,手性配体促进不对称C-N偶联反应也吸引了科研工作者们的注意。He等[22]以手性1, 2-二苯基乙烷-1, 2-二胺(L7)为配体,基于不对称去对称化策略,在室温下实现了铜催化的不对称Ullmann C-N偶联反应(式(3))。该反应以高收率和高光学选择性,生成了含有叔碳和季碳中心的喹啉酮衍生物(最高88% ee)。Liu等[23]又以芳基碘化物和亚磺酰胺为底物,发现手性配体N, N-二甲基-1, 2-二-萘基-1, 2-二乙二胺(L8)的催化效果远远大于1, 2-二苯基乙烷-1, 2-二胺。通过动力学拆分的方法,以高产率和适中的对映选择性获得相应的手性N-芳基磺酰胺(式(4))。
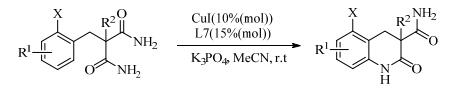
|
(3) |
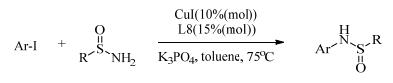
|
(4) |
Cu/二胺的催化剂体系已经得到了深入研究,不仅催化剂和配体已经多元化,反应机理也相对成熟。Guo小组研究在CuI/二胺催化的芳基酰胺化反应的机理时[24],发现酰胺化CuⅠ是反应混合物中对芳基卤化物进行氧化加成最活泼的中间体,氧化加成是铜催化的芳基酰胺化中的限速步骤。不同于Pd0转化为PdⅡ,CuⅠ氧化加成产生五配位的CuⅢ络合物,因此对空间位阻更敏感。计算表明:DMEDA是铜催化的芳基酰胺化的优异配体,而TMEDA几乎没有催化活性。同时Buchwald小组的实验工作也验证了该机理过程[14] (图 2)。
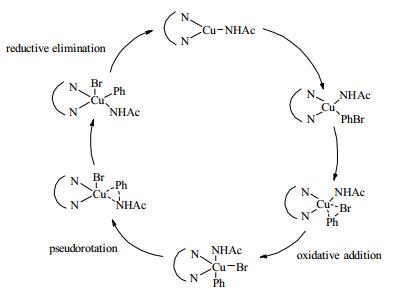
|
图 2 CuI /二胺催化的偶联反应的机理 Fig.2 The mechanism of the coupling reaction catalyzed by CuI/diamine |
除二胺配体外,菲咯啉[25]及其衍生物为代表的氮杂类配体也被广泛应用于偶联反应中。1999年1, 10-邻菲咯啉(L9)作为配体,被Buchwald等[26]首次应用到铜催化咪唑类化合物的C-N成键偶联反应中。之后,Evindar等[27]在CuI/L9的催化体系下,通过芳基卤化物和胍的分子内C-N偶联反应合成了苯并咪唑类化合物,收率高达98%。这是第一次在芳基胍基化反应中使用铜盐。胍的环化优先从NH-芳基开始而不是NH-烷基。重要的是,具有NH-苄基和NH-R甲基苄基的底物在铜催化下能完全区域选择性的环化,而钯催化该反应则是非选择性的(式(5))。
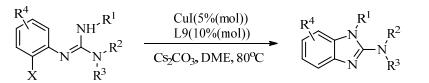
|
(5) |
随着研究的深入,1, 10-邻菲咯啉的衍生物相继被挖掘出来。Trond Ulven等[28]发现4, 7-二吡咯烷基-1, 10-菲咯啉(L10)也是铜催化N-芳基化反应的有效配体。相转移催化剂PEG-400的加入,使得腺嘌呤和茶碱与芳基卤化物首次在水中实现了偶联反应。铜的负载量可以降低到0.1%(mol),同时保持铜-配体比(1:2)而不影响收率。Kelly等[29]报道了3, 4, 7, 8-四甲基-1, 10-菲咯啉(L11)在铜催化溴代碘代烷烃与恶唑烷酮的Ullmann偶联反应中的催化效果,促进反应的同时也使溴-碘交换途径最小化。
席夫碱作配体也被大量应用到铜催化的C-N偶联反应中。Cristau等[30]发现Chxn-Py-Al(L12)能在低温下有效地促进铜催化含氮化合物的N-芳基化反应。吡咯、吲哚、1, 2, 4-三唑、酰胺和氨基甲酸酯的N-芳基化反应在此催化体系下反应良好,收率为81%~92%。随后,他们小组对Cu和L12的催化机理进行了研究[31]。首先,在乙腈中铜(Ⅰ)盐和四齿配体结合形成了不溶的二聚体复合物。在该单体内,铜中心处于+Ⅰ氧化水平,并被配体制成更富电子的单体(式(6))。
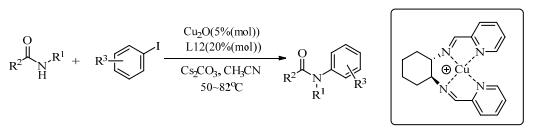
|
(6) |
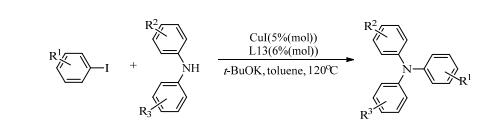
Liu等[32]对比了一系列二氮杂二烯DABs,发现1, 4-双(2, 6-二异丙基)-1, 4-二氮杂-1, 3-丁二烯(L13)是合成三芳基胺的铜催化反应中的有效配体。催化剂的用量相对较少,5%(mol) CuI和6%(mol) DAB,就能有效地催化二芳基胺与芳基碘化物的N-芳基化反应(式(7))。DABs可由乙二醛与伯胺缩合而得,因N=C-C=N骨架的灵活性、强σ给予和π接受属性而具有易于修饰、多样性的特点,被当作配体广泛应用到偶联反应中。Li等[33]报道了结合(1E, 2E)-草醛二肟(L14),CuCl或CuBr催化含氮杂环和脂族胺的N-芳基化反应。以水为溶剂,四丁基溴化铵为相转移催化剂,以62%~96%的收率生成相应的N-芳基化产物。
|
(7) |
Veisi等[34]发现二甲双胍(L15)与CuI结合也可高效催化N-芳基化反应。L15作为治疗糖尿病的首选药物,第一次在铜催化的偶联反应中展现了出色的催化效果。Chen等[35]同样将CuI/L15作为催化剂,用于合成1-芳基吲哚衍生物的C-N偶联反应。廉价且无毒的二甲双胍作配体,高效且对环境十分友好,具有一定的研究前景。
Zhao等[36]报道了低廉配体1-甲基-咪唑(L16)在铜催化咔唑和2-溴吡啶衍生物的反应中的催化活性。以K2CO3为碱时,需要10%(mol)的CuCl和25%(mol)的配体,24 h才能反应完全;而选用叔丁醇锂(t-BuOLi)作碱,增强了催化剂的活性和选择性,只需在1%(mol)的CuCl和2%(mol)的配体催化下反应4 h,以79%~99%的收率合成了各种N-杂芳基咔唑衍生物(式(8))。
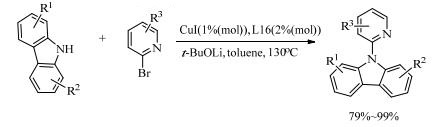
|
(8) |
N-O双齿配体是Ullman反应目前应用及研究最广泛的配体,其中以氨基酸为典型代表。肟型N-O配体、吡啶类N-O配体、结构特异的含离子的N-氧化物等依然在Ullmann反应中体现了良好的催化效果。研究人员也一直致力于绿色配体的研发,于是葡萄糖配体应运而生并展现了出色的催化效果。图 3示出了主要的N-O双齿型配体。
|
图 3 N-O类配体的主要类型 Fig.3 Typical N-O ligands |
目前科研工作者们已经报道了多种以氨基酸及其衍生物[37]为主的N-O型配体,这些配体对铜催化的C-N偶联反应具有良好的促进效果。1998年Ma等[9]在研究铜催化α-氨基酸、β-氨基酸与溴苯的N-芳基化反应时,发现氨基酸在反应中不仅是亲核试剂,其自身还对反应有一定的促进作用。2003年,Ma等[38]将氨基酸应用到铜催化芳基卤化物与含氮杂环的偶联反应中,N-甲基甘氨酸(L17)和L-脯氨酸(L18)作配体,以良好的收率得到相应的N-芳基胺或N, N-二芳基胺产物。就结构相同的氨基酸而言,N-取代的氨基酸比N, N-二取代氨基酸的催化活性更高。
2005年Ma等[39]以L18为配体,研究了CuI催化芳基卤化物与氨基化合物或含氮杂环的C-N偶联反应。此催化条件下,吲哚、吡咯、咔唑、咪唑或吡唑等氮杂环都能与芳基碘化物进行偶联反应,收率高达97%。芳基氯化物也能在70℃下与伯胺进行分子内偶联生成二氢吲哚。该催化体系[40]同样适用于吡咯-2-羧酸酯和2-卤乙酰苯胺的偶联反应。带有官能团酮基、酯基、甲氧基、溴和氯的稠合杂环都体现了良好的底物适应性。CuI/4-羟基-1-脯氨酸(L20)的催化体系也被Ma等[41]开发出来,用于催化邻苯甲酰胺与甲酰胺的偶联反应,为合成喹唑啉酮提供了比较简易且有效的方法(式(9))。
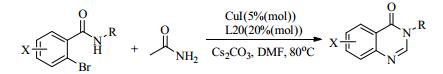
|
(9) |
Deng等[42]一直在研究氨基酸在铜催化C-N偶联反应中的催化效果及其作用机理。L17和N, N-二甲基甘氨酸(L18)对磺酰胺和芳基卤化物的偶联反应,都有良好的促进作用。大多数的溴代和碘代芳环化合物的偶联反应,收率都能达到90%以上。随后Guo等[43]以苯胺和溴苯为底物,探索出了一种廉价且高效的催化剂体系即CuI作催化剂,2-哌啶酸(L21)作配体,可用于各种胺、酰胺、吲哚和咪唑等含氮化合物的N-芳基化反应,最高收率可达93%。2004年Deng等[44]以碘苯和杂环胺为底物,CuI为催化剂,考察了一系列的氨基酸类配体。发现甘氨酸作配体时,偶联反应的收率最高。甘氨酸在反应中不仅能稳定CuⅢ中间体,还能促进ArI对CuⅠ进行氧化加成。值得注意的是,中间体b的酰胺部分中的氮是阴离子,比中性的氨基酸中的氨基活性更强。从而证明了参与偶联反应的是酰胺而不是氨基酸配体中的氨基部分(图 4)。

|
图 4 CuI /Gly催化的偶联反应机理 Fig.4 Mechanism of coupling reaction catalyzed by CuI/Gly |
Altman等[45]也曾报道过氨基酸类的配体在铜催化偶联反应中的应用。吡咯-2-羧酸(L22)作配体可高效催化芳基碘化物、溴化物与苯胺的铜催化N-芳基化反应。反应条件不仅温和,而且底物拓展性好。各种吸电子或供电子取代的碘苯、溴苯的偶联反应,都能以良好的收率得到相应的二芳基胺产物。
3.2 其他N-O配体除了氨基酸类能应用到铜催化C-N偶联反应中,许多新型配体如肟型N-O配体、吡啶类N-O配体等在反应中依然有良好的催化效果。Cristau等[46]在研究杂芳基溴化物或碘化物与吡唑的C-N偶联反应时,发现了一类新型且廉价的螯合肟型配体,能在温和的条件下促进偶联反应,收率高达96%(式10)。随后,Wang等[47]采用6, 7-二氢喹啉-8(5H)-酮肟(L23)作配体,以CuI为催化剂,在水中有效催化了芳基卤化物和咪唑的C-N偶联反应。该催化体系仅需要(0.1~5)%(mol)的CuI和(0.2~10)%(mol)的配体,即可催化芳基碘化物、溴化物和缺电子氯化物与咪唑的N-芳基化反应,有效生成相应的N-芳基化产物。
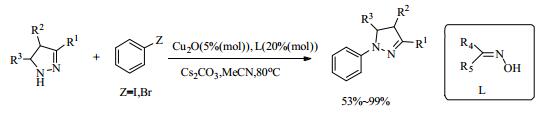
|
(10) |
吡啶类的N-O配体同样能有效地催化铜催化偶联反应。2005年,Liu小组[48]报道了8-羟基喹啉(L24)作为配体,结合催化剂CuI在水相中催化了咪唑类化合物与卤代芳烃的N-芳基化偶联反应。其中氯代芳烃同样能在此催化体系下反应。该体系具有良好的官能团兼容性,收率高达93%。2017年,Sharma等[49]发现L24在CuCl催化2-芳基组胺和芳基碘化物的偶联反应中,也展现了优越的催化活性。在140℃的微波条件下仅需反应60 min,就合成了空间和电子多样化的1, 2-二芳基化组氨酸。各种官能化的2-芳基组胺能以75%~85%的收率进行N-芳基化反应,生成官能化的组氨酸(式(11))。
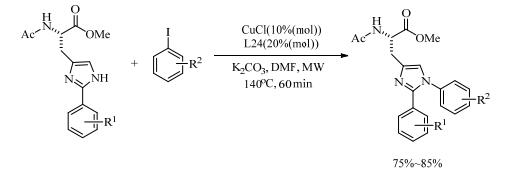
|
(11) |
结构特异的含离子的N-氧化物也同样能高效促进C-N偶联反应。Yang等[50]合成出一个新的配体:8-羟基喹啉N-氧化物(L25)。它在CuBr催化芳基卤化物的偶联反应中起到一定的促进作用。芳基碘化物和溴化物都能与伯胺或N-杂环化合物发生偶联反应,并且收率良好。虽然芳基氯化物的反应活性比较低,但是只要提高反应温度,延长反应时间,依然能得到较好的收率。2015年N-(1-氧代-吡啶-2-基甲基)草氨酸(L26)被Wang等鉴定为吡咯和芳基卤化物在水中铜催化C-N偶联的新型有效配体。咪唑、吲哚和吡唑对芳族胺和酚可以选进行择性的N-芳基化,并且收率颇高,最高可达99%。此方法避免使用有毒有机溶剂、昂贵的碱以及比较苛刻的反应条件。此外,具有低催化剂负载量的该催化体系在有机溶剂中也同样有效。同时可以用于促进唑类与水敏感材料的N-芳基化反应[51]。
D-氨基葡萄糖盐酸盐(L27)被Cheng等[52]成功地运用到C-N成键的偶联反应中,它能有效地促进催化芳基和杂芳基卤化物与咪唑的N-芳基化反应,收率高达95%。这种由糖作配体的反应在绿色化学、环保和经济效益上有很大的优势。2015年Wen等报道了L27也能有效的促进铜催化芳基碘化物和溴化物与含氮化合物的C-N偶联反应[53]。CuI作催化剂,DMSO/H2O(1:1)为溶剂,咪唑、苯并咪唑、吲哚和吡咯烷能与芳基卤化物发生偶联反应。由于配体L27具有很高的水溶性,后续步骤中的催化剂更容易除去。随后Ge等[54]对Cu与L27促进Ullmann型C-N偶联反应,进行了组合实验/理论研究。通过DFT计算,证实了配体L27的催化作用。将配体进行微调,发现C-3,C-4和C-6位上的羟基对催化过程具有显着影响。
Huang等[55]合成了聚苯乙烯负载的吡咯-2-碳酰肼(L28),并与CuI组合构成一个可循环利用的、环保的多相催化体系,在水中实现了C-N偶联反应。其中,各种官能化的芳基卤化物都能有效地与苯胺、苄胺、脂族胺和咪唑进行偶联反应,收率高达93%。该方法的初步应用,就是合成咪唑并[1, 2-a]喹喔啉,避免使用空气敏感的NaH和有机溶剂DMA,使操作更实用(式(12))。
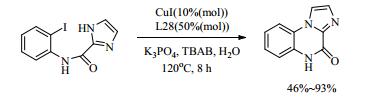
|
(12) |
二醇以及二酮类配体是O-O型配体的主要形式,在铜催化Ullmann C-N偶联反应中有着出色的催化效果。其中,二酮类的配体还展现出了良好的选择性,因此研究人员对二酮类配体的研究逐渐上升到机理层面的探索,对其促进铜催化偶联反应的机理研究也做了许多工作。图 5示出了主要的O-O双齿型配体。
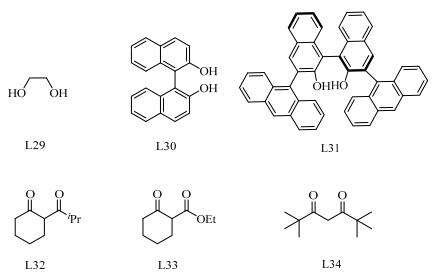
|
图 5 O-O类配体的主要类型 Fig.5 Typical O-O ligands |
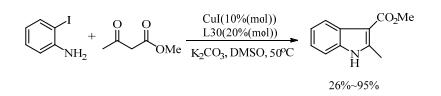
Kwong等[56]首次报道了O-O双齿型的配体。在芳基碘化物的铜催化反应中,他们筛选了一系列的二醇类的配体,发现结构简单且价格低廉的乙二醇(L29)的催化效果最好,收率达95%。在此基础上,许多化学家开始着力研究邻二酚类配体在铜催化偶联反应中的应用。Jiang等[57]采用1, 1-联二萘酚(L30)作为配体,以CuBr为催化剂,在室温下实现了脂肪族氨基化合物与芳基卤化物的偶联反应。带不同官能团的底物在该催化体系中都体现了良好的适应性,收率最高可达91%。Tanimori等[58]又将L30应用到2-碘苯胺和各种β-酮酯的铜催化的C-N偶联反应中,一步合成2, 3-二取代的吲哚,收率高达95%。由于多取代的吲哚衍生物是用于合成生物活性吲哚生物碱和药物候选物的重要原料,则该方法具有重要意义(式(13))。
|
(13) |
Zhaou等[59]研究了1, 1-联二萘酚衍生物(L31)与CuI的催化体系,以1, 3-双(2-碘芳基)丙-2-胺为底物,通过不对称去对称化的方法,在室温下第一次实现了铜催化的不对称C-N成键的Ulmman偶联反应。催化剂CuI和配体的加入导致了对映体选择性,以96%的收率和高选择性生成了二氢引哚产物。这种方法也同样能以高收率和高选择性地合成1, 2, 3, 4-四氧喹啉化合物(式(14))。
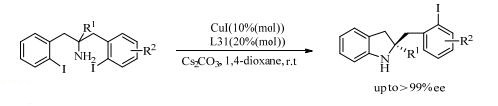
|
(14) |
受Buck等[60]用二叔戊酰基甲烷促进苯酚的Ullmann偶联反应的启发,Shafir等[61]尝试了一系列的二酮配体,其中2-异丁酰基环己酮(L32)配体在催化杂环N-H的芳基化反应中活性最高。在配体L32的促进下,芳基碘化物与脂族胺的铜催化偶联反应在室温下仅需反应1 h,就能以高达98%的收率生成相应N-芳基化产物,但是反应底物的局限性比较大。近期,Sharma等[62]也研究了配体L32在铜催化N-芳基化反应中的催化效果。在室温下,以CuI作为催化剂,二酮作为配体,实现了两性离子氨基酸、氨基酸酯和肽与芳基碘化物的偶联反应。在80℃下,相对便宜的芳基溴化物同样能在该催化体系下与氨基酸进行耦合,收率为78%~84% (式(15))。Sharma等[63]还在水相中研究了L32促进氨基酸和芳基溴化物的铜催化N-杂芳基化反应。在90℃下只需要低负载量的催化剂,微波辐射底物50 min,即可生成相应的产物。该方法符合绿色化学的理念,同时各种芳基卤化物都能以高产率挑战N-杂芳基化反应,而且不影响产物的对映体比率。
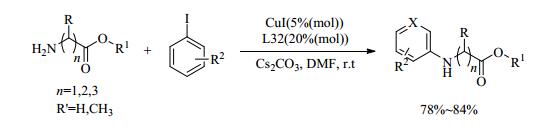
|
(15) |
Bao小组合成出一系列的β-二酮化合物,筛选后发现2-甲酸乙酯基环己酮(L33)作为配体可以用于铜催化下多种(N/O/S)亲核试剂与芳基卤化物的交叉偶联反应。反应可以在温和条件下进行,以N-芳基酰胺、N-芳基咪唑、芳香醚、芳硫醚在内的多种产物都以非常高的产率成功合成出来[64]。Feng等[65]将L33运用到CuCl催化胺与芳基碘化物的N-芳基化反应中,独特的是采用可溶性的四甲基氢氧化铵代替传统的无机碱,同样具有较强的底物适用性。
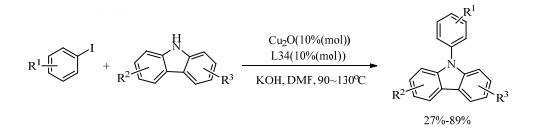
Chen等[66]研究了咔唑与芳基碘化物的铜催化C-N成键的偶联反应。他们筛选了一些市面上所售的如β-二酮和二胺这样的配体。发现由廉价的铜盐、简单的β-二酮(L34)和无机碱组成的催化体系能有效地催化咔唑的N-芳基化反应。带有各种官能团的芳基碘化物都能和咔唑生成N-芳基咔唑,并且空间位阻效应在此催化体系下非常明显(式(16))。
|
(16) |
Jones等[67]通过单电子转移和碘原子转移机制,解释了β-二酮(L32)和菲咯啉衍生物(L11)促进CuI催化氨基醇与碘苯的Ullmann型反应的选择性。研究表明,在芳基卤化物活化的步骤中实现选择性,而不是在形成亲核试剂的步骤中。芳基化可以通过单电子转移(SET)或碘原子转移(IAT)进行,这取决于配体和亲核试剂的给电子能力。富电子的β-二酮配体促进亲核试剂的SET反应。CuI(甲基酰氨基)络合物的反应中,SET的速率比在CuI(甲醇盐)络合物的反应中快,从而导致选择性N-芳基化反应。该机理解释有助于开发更强大的Cu催化剂,来解决Pd催化剂合成中的选择性问题(式(17))。
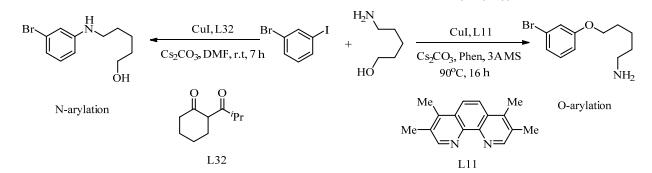
|
(17) |
Yu等发现氧化加成/还原消除机制也可以解释铜催化Ullmann型反应的选择性[68]。他们认为,选择性不是源自芳基卤化物活化的步骤,而是来自亲核配位和氧化加成的步骤。计算表明带负电荷的β-二酮配体与CuI的络合物是呈电中性的。因此在氨基醇不存在的情况下,易于将ArI氧化加入到β-二酮螯合的CuI络合物中。呈中性的氨基醇的配位只能在CuⅢ阶段发生,并且N配位优于O配位,从而选择性的生成了N-芳基化产物。Lefevre等[69]也研究了CuI催化芳基卤化物和环己胺的C-N偶联反应的机理。通过计算证实了卤素原子(部分正电荷) PhI和PhBr与((ket)Cu-NHCy)A形成卤素键。在PhCl的反应中,由于缺少卤素键的形成,仅发生经典的氧化加成反应。通过DFT计算反映出C-N偶联反应中芳基卤化物的总体反应性:ArI > ArBr > > ArCl (图 6)。2015年,Cheng等[70]通过IR对CuI歧化的配体效应进行了研究。发现CuI和β-二酮烯醇化物,β-酮酯烯醇酯和β-酮酰胺烯醇化物形成的CuI配合物分别与CuⅡ和Cu0物质不成比例,歧化速率也不同。这将有助于设计配体和了解铜催化偶联反应的机理。
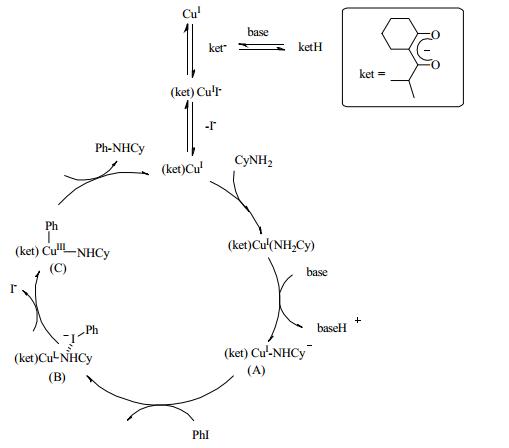
|
图 6 CuI /ket催化的偶联反应的机理 Fig.6 Mechanism of coupling reaction catalyzed by CuI/ket |
近十几年来,铜催化Ullmann C-N偶联反应因其反应条件温和、铜源廉价、收率高和底物应用性强等特点,一直是化学工业研究的热点。目前,研究人员对铜催化偶联反应的机理认识还不是非常充分,对于很多反应较少涉及对反应机理的深入研究,主要原因是铜本身的特点和其复杂性所决定的。铜是第一周期过渡金属,含有多种氧化态,如Cu0、CuⅠ、CuⅡ和CuⅢ。这些不同氧化的铜离子可以和配体鳌合形成种类较多的配合物,形成的配合物稳定性既和配体、铜的离子形态有关,又和溶剂的性质有很大的关联。因此,在研究反应机理过程中,受到的干扰因素较多,近年来也成为理论化学家研究的热点之一。对于目前研究较多的N-N类、N-O类、O-O类等配体来说,这些配体可以有效地促进含氮化合物与芳基卤化物的偶联反应,并且收率颇高。但是目前仍然存在一些问题:反应的溶剂多采用强极性的有机溶剂,如DMSO、DMF等;底物的适用性虽然得到了极大的拓展,但主要应用在芳基碘化物和芳基溴化物中,而活性较低的芳基氯化物在大部分反应体系中不能与亲核试剂进行偶联反应;偶联产物的纯化分离还不够简便等。研究人员针对这些问题,仍需要不断地摸索并改进催化体系,如:高效绿色可降解的配体开发、水相反应体系的研究或者负载型催化剂的制备等。因此,研究出更加高效、适用性广以及环境友好型的配体,不仅顺应绿色化学的主流,更是以后研究铜催化Ullman C-N反应的方向标。
| [1] | Properzi R, Marcantoni E. Construction of heterocyclic structures by trivalent cerium salts promoted bond forming reactions[J]. Chemical Society Reviews , 2014, 43(3): 779-791. DOI:10.1039/C3CS60220F. |
| [2] | Sano H, Noguchi T, Tanatani A, et al. Design and synthesis of subtype-selective cyclooxygenase (COX) inhibitors derived from thalidomide[J]. Bioorganic and Medicinal Chemistry , 2005, 13(9): 3079-3091. DOI:10.1016/j.bmc.2005.03.002. |
| [3] | CHEN Shuang-wei(陈双伟), YANG Jian-guo(杨建国), JIN Qing-ping(金庆平), et al. Improved synthesis of milrinone(米力农的合成工艺改进)[J]. Chinese Journal of Medicinal Chemistry(中国药物化学杂志) , 2009, 19(4): 261-262. |
| [4] | Enders D, Niemeier O, Henseler A. Organocatalysis by N-heterocyclic carbenes[J]. Chemical Reviews , 2007, 107(12): 5606-5655. DOI:10.1021/cr068372z. |
| [5] | Evano G, Blanchard N, Toumi M. Copper-mediated coupling reactions and their applications in natural products and designed biomolecules synthesis[J]. Chemical Reviews , 2008, 108(8): 3054-3131. DOI:10.1021/cr8002505. |
| [6] | LIU Ding-hua(刘定华), XU Ming(徐明), CHEN Zhen-song(陈振松), et al. Study on reaction performance of copper salt in oxidative carbonylation of ethanol(铜盐催化乙醇氧化羰基化反应性能的研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2013, 27(3): 425-430. |
| [7] | Sambiagio C, Marsden S P, Blacker A J, et al. Copper catalysed Ullmann type chemistry: from mechanistic aspects to modern development[J]. Chemical Society Reviews , 2014, 43(10): 3525-3550. DOI:10.1039/C3CS60289C. |
| [8] | Ma D W, Yao J C. Synthesis of chiral N-aryl-α-amino acids by Pd-Cu catalyzed couplings of chiral α-amino acids with aryl halides[J]. Tetrahedron:Asymmetry , 1996, 7(11): 3075-3078. DOI:10.1016/0957-4166(96)00401-6. |
| [9] | Ma D W, Zhang Y D, Yao J C, et al. Accelerating effect induced by the structure of α-amino acid in the copper-catalyzed coupling reaction of aryl halides with α-amino acids. Synthesis of benzolactam-V8[J]. Journal of the American Chemical Society , 1998, 120(48): 12459-12467. DOI:10.1021/ja981662f. |
| [10] | Zhang Y, Yang X, Yao Q Z, et al. CuI/DMPAO-catalyzed N-arylation of acyclic secondary amines[J]. Organic Letters , 2012, 14(12): 3056-3059. DOI:10.1021/ol301135c. |
| [11] | Martín R, Larsen C H, Cuenca A, et al. Cu-catalyzed tandem C-N bond formation for the synthesis of pyrroles and heteroarylpyrroles[J]. Organic Letters , 2007, 9(17): 3379-3382. DOI:10.1021/ol7014225. |
| [12] | Rovira M, Soler M, Güell I, et al. Orthogonal discrimination among functional groups in Ullmann-type C-O and C-N couplings[J]. Journal of Organic Chemistry , 2016, 81(17): 7315-7325. DOI:10.1021/acs.joc.6b01035. |
| [13] | Zhang C, Zhan Z J, Lei M, et al. Ullmann-type C-N coupling reaction catalyzed by CuI/metformin[J]. Tetrahedron , 2014, 70(46): 8817-8821. DOI:10.1016/j.tet.2014.10.014. |
| [14] | Klapars A, Antilla J C, Huang X H, et al. A general and efficient copper catalyst for the amidation of aryl halides and the N-arylation of nitrogen heterocycles[J]. Journal of the American Chemical Society , 2001, 123(31): 7727-7729. DOI:10.1021/ja016226z. |
| [15] | Antilla J C, Klapars A, Buchwald S L. The copper-catalyzed N-arylation of indoles[J]. Journal of the American Chemical Society , 2002, 124(39): 11684-11688. DOI:10.1021/ja027433h. |
| [16] | Yuan X Y, Xu X B, Zhou X B, et al. Copper-catalyzed double N-alkenylation of amides: an efficient synthesis of di-or trisubstituted N-acylpyrroles[J]. Journal of Organic Chemistry , 2007, 72(4): 1510-1513. DOI:10.1021/jo062194s. |
| [17] | Hosseinzadeh R, Sarrafi Y, Mohadjerani M, et al. Copper-catalyzed arylation of phenylurea using KF/Al2O3[J]. Tetrahedron Letters , 2008, 49(5): 840-843. DOI:10.1016/j.tetlet.2007.11.180. |
| [18] | Phillips D P, Zhu X F, Lau T L, et al. Copper-catalyzed C-N coupling of amides and nitrogen-containing heterocycles in the presence of cesium fluoride[J]. Tetrahedron Letters , 2009, 50(52): 7293-7296. DOI:10.1016/j.tetlet.2009.10.041. |
| [19] | Jung H S, Yun T, Cho Y, et al. Simple and convenient copper-catalyzed amination of aryl halides to primary arylamines using NH4OH[J]. Tetrahedron , 2016, 72(40): 5988-5993. DOI:10.1016/j.tet.2016.07.021. |
| [20] | Rao R K, Naidu A B, Jaseer E A, et al. An efficient, mild, and selective Ullmann-type N-arylation of indoles catalyzed by copper(Ⅰ) complex[J]. Tetrahedron , 2009, 65(23): 4619-4624. DOI:10.1016/j.tet.2009.03.061. |
| [21] | Shen G D, Zhao L Y, Bao W L. 1, 1'-binaphthyl-2, 2'-diamine dihydrochloride: an efficient ligand for the N-arylation of imidazole with aryl/heteroaryl halides catalyzed by CuI[J]. Chemical Research In Chinese Universities , 2016, 32(6): 947-951. DOI:10.1007/s40242-016-6263-7. |
| [22] | He N, Huo Y P, Liu J G, et al. Copper-catalyzed enantioselective intramolecular aryl C-N coupling: synthesis of enantioenriched 2-oxo-1, 2, 3, 4-tetrahydroquinoline-3-carboxamides via an asymmetric desymmetrization strategy[J]. Organic Letters , 2015, 17(2): 374-377. DOI:10.1021/ol5035386. |
| [23] | Liu Y Y, Wang Z S, Guo B, et al. Asymmetric synthesis of N-aryl sulfinamides: copper(Ⅰ)-catalyzed coupling of sulfinamides with aryl iodides via kinetic resolution[J]. Tetrahedron Letters , 2016, 57(22): 2379-2381. DOI:10.1016/j.tetlet.2016.04.049. |
| [24] | Zhang S L, Liu L, Fu Y, et al. Theoretical study on copper(Ⅰ)-catalyzed cross-coupling between aryl halides and amides[J]. Organometallics , 2007, 26(18): 4546-4554. DOI:10.1021/om700573h. |
| [25] | Knight J G, Alnoman R B, Waddell P G. Synthesis of 3-amino BODIPY dyes via copper-catalyzed vicarious nucleophilic substitution of 2-halogeno derivatives[J]. Organic & Biomolecular Chemistry , 2015, 13(12): 3819-3829. |
| [26] | Kiyomori A, Marcoux J F, Buchwald S L. An efficient copper-catalyzed coupling of aryl halides with imidazoles[J]. Tetrahedron Letters , 1999, 40(14): 2657-2660. DOI:10.1016/S0040-4039(99)00291-9. |
| [27] | Evindar G, Batey R A. Copper-and palladium-catalyzed intramolecular aryl guanidinylation: an efficient method for the synthesis of 2-aminobenzimidazoles[J]. Organic Letters , 2003, 5(2): 133-136. DOI:10.1021/ol027061h. |
| [28] | Engel-Andreasen J, Shimpukade B, Ulven T. Selective copper catalysed aromatic N-arylation in water[J]. Green Chemistry , 2013, 15(2): 336-340. DOI:10.1039/C2GC36589H. |
| [29] | Kelly S M, Han C, Tung L, et al. Chemoselective copper-catalyzed Ullmann-type coupling of oxazolidinones with bromoiodoarenes[J]. Organic Letters , 2017, 19(11): 3021-3024. DOI:10.1021/acs.orglett.7b01304. |
| [30] | Cristau H J, Cellier P P, Spindler J F, et al. Highly efficient and mild copper-catalyzed N-and C-arylations with aryl bromides and iodides[J]. Chemistry A European Journal , 2004, 10(22): 5607-5622. DOI:10.1002/(ISSN)1521-3765. |
| [31] | Ouali A, Taillefer M, Spindler J F, et al. Precatalysts involved in copper-catalyzed arylations of nucleophiles[J]. Organometallics , 2007, 26(1): 65-74. DOI:10.1021/om060706n. |
| [32] | Liu Y H, Chen C, and Yang L M. Diazabutadiene: a simple and efficient ligand for copper-catalyzed N-arylation of aromatic amines[J]. Tetrahedron Letters , 2006, 47(52): 9275-9278. DOI:10.1016/j.tetlet.2006.10.103. |
| [33] | Li X F, Yang D S, Jiang Y Y, et al. Efficient copper-catalyzed N-arylations of nitrogen-containing heterocycles and aliphatic amines in water[J]. Green Chemistry , 2010, 12(6): 1097-1105. DOI:10.1039/c002172e. |
| [34] | Ghorbani-Vaghei R, Hemmati S, Veisi H. An in situ generated CuI/metformin complex as a novel and efficient catalyst for C-N and C-O cross-coupling reactions[J]. Tetrahedron Letters , 2013, 54(52): 7095-7099. DOI:10.1016/j.tetlet.2013.10.039. |
| [35] | Chen H, Lei M, Hu L H. Synthesis of 1-aryl indoles via coupling reaction of indoles and aryl halides catalyzed by CuI/metformin[J]. Cheminform , 2014, 70(35): 5626-5631. |
| [36] | Zhao X D, She Y B, Fang K, et al. CuCl-catalyzed Ullmann-type C-N cross-coupling reaction of carbazoles and 2-bromopyridine derivatives[J]. Journal of Organic Chemistry , 2017, 82(2): 1024-1033. DOI:10.1021/acs.joc.6b02595. |
| [37] | Kong L K, Zhou Y Y, Huang H, et al. Copper-catalyzed synthesis of substituted quinolines via C-N coupling/condensation from ortho-acylanilines and alkenyl iodides[J]. Journal of Organic Chemistry , 2015, 80(2): 1275-1278. DOI:10.1021/jo502630t. |
| [38] | Ma D W, Cai Q, Zhang H. Mild method for Ullmann coupling reaction of amines and aryl halides[J]. Organic Letters , 2003, 5(14): 2453-2455. DOI:10.1021/ol0346584. |
| [39] | Zhang H, Cai Q, Ma D W. Amino acid promoted CuI-catalyzed C-N bond formation between aryl halides and amines or N-containing heterocycles[J]. Journal of Organic Chemistry , 2005, 70(13): 5164-5173. DOI:10.1021/jo0504464. |
| [40] | Yuan Q L, Ma D W. A one-pot coupling/hydrolysis/condensation process to pyrrolo[1, 2-a]quinoxaline[J]. Journal of Organic Chemistry , 2008, 73(13): 5159-5162. DOI:10.1021/jo8008098. |
| [41] | Xu L T, Jiang Y W, Ma D W. Synthesis of 3-substituted and 2, 3-disubstituted quinazolinones via Cu-catalyzed aryl amidation[J]. Organic Letters , 2012, 14(4): 1150-1153. DOI:10.1021/ol300084v. |
| [42] | Deng W, Liu L, Zhang C, et al. Copper-catalyzed cross-coupling of sulfonamides with aryl iodides and bromides facilitated by amino acid ligands[J]. Tetrahedron Letters , 2005, 46(43): 7295-7298. DOI:10.1016/j.tetlet.2005.08.149. |
| [43] | Guo X, Rao H H, Fu H, et al. An inexpensive and efficient copper catalyst for N-Arylation of amines, amides and nitrogen-containing heterocycles[J]. Advanced Synthesis & Catalysis , 2006, 348(15): 2197-2202. |
| [44] | Deng W, Wang Y F, Zou W, et al. Amino acid mediated goldberg reactions between amides and aryl iodides[J]. Tetrahedron Letters , 2004, 45(11): 2311-2315. DOI:10.1016/j.tetlet.2004.01.119. |
| [45] | Altman R A, Anderson K W, Buchwald S L. Pyrrole-2-carboxylic acid as a ligand for the Cu-catalyzed reactions of primary anilines with aryl halides[J]. Journal of the American Chemical Society , 2008, 73(13): 5167-5169. |
| [46] | Cristau H J, Cellier P P, Spindler J F, et al. Mild conditions for copper-catalysed N-arylation of pyrazoles[J]. European Journal of Organic Chemistry , 2004(4): 695-709. |
| [47] | Wang D P, Zhang F X, Kuang D Z, et al. A highly efficient Cu-catalyst system for N-arylation of azoles in water[J]. Green Chemistry , 2012, 14(5): 1268-1271. DOI:10.1039/c2gc35077g. |
| [48] | Liu L B, Frohn M, Xi N, et al. A soluble base for the copper-catalyzed imidazole N-arylations with aryl halides[J]. Journal of Organic Chemistry , 2005, 70(24): 10135-10138. DOI:10.1021/jo051640t. |
| [49] | Sharma K K, Mandloi M, Jain R. Regioselective access to 1, 2-diarylhistidines through the copper-catalyzed N-aarylation of 2-arylhistidines[J]. European Journal of Organic Chemistry , 2017(5): 984-988. |
| [50] | Yang K, Qiu Y T, Li Z, et al. Ligands for copper-catalyzed C-N bond forming reactions with 1%(mol) CuBr as catalyst[J]. Journal of Organic Chemistry , 2011, 76(9): 3151-3159. DOI:10.1021/jo1026035. |
| [51] | Wang Y B, Zhang Y, Yang B B, et al. N-(1-oxy-2-picolyl)oxalamic acids as a new type of O, O-ligands for the Cu-catalyzed N-arylation of azoles with aryl halides in water or organic solvent[J]. Organic & Biomolecular Chemistry , 2015, 13(13): 4101-4114. |
| [52] | Cheng D P, Gan F F, Qian W X, et al. D-glucosamine-a natural ligand for the N-arylation of imidazoles with aryl and heteroaryl bromides catalyzed by CuI[J]. Green Chemistry , 2008, 10(2): 171-173. DOI:10.1039/B713658G. |
| [53] | Wen M, Shen C, Wang L F, et al. An efficient D-glucosamine-based copper catalyst for C-X couplings and its application in the synthesis of nilotinib intermediate[J]. RSC Advances , 2015, 5(2): 1522-1528. DOI:10.1039/C4RA11183D. |
| [54] | Ge X, Chen X Z, Qian C, et al. Combined experimental/theoretical study of D-glucosamine promoted Ullmann-type C–N coupling catalyzed by copper(Ⅰ): does amino really count?[J]. RSC Advances , 2016, 6(35): 29638-29645. DOI:10.1039/C6RA03015G. |
| [55] | Huang L Y, Yu R N, Zhu X H, et al. A recyclable Cu-catalyzed C-N coupling reaction in water and its application to synthesis of imidazo[1, 2-a]quinoxaline[J]. Tetrahedron , 2013, 69(42): 8974-8977. DOI:10.1016/j.tet.2013.07.036. |
| [56] | Kwong F Y, Klapars A, Buchwald S L. Copper-catalyzed coupling of alkylamines and aryl iodides: an efficient system even in an air atmosphere[J]. Organic Letters , 2002, 4(4): 581-584. DOI:10.1021/ol0171867. |
| [57] | Jiang D S, Fu H, Jiang Y Y, et al. CuBr/rac-BINOL-catalyzed N-arylations of aliphatic amines at room temperature[J]. Journal of Organic Chemistry , 2007, 72(2): 672-674. DOI:10.1021/jo062060e. |
| [58] | Tanimori S, Ura H, Kirihata M. Copper-catalyzed synthesis of 2, 3-disubstituted indoles[J]. European Journal of Organic Chemistry , 2007(24): 3977-3980. |
| [59] | Zhou F T, Guo J J, Liu J G, et al. Copper-catalyzed desymmetric intramolecular Ullmann C-N coupling: an enantioselective preparation of indolines[J]. Journal of the American Chemical Society , 2012, 134(35): 14326-14329. DOI:10.1021/ja306631z. |
| [60] | Buck E, Song Z J, Tschaen D, et al. Ullmann diaryl ether synthesis: rate acceleration by 2, 2, 6, 6-tetramethylheptane-3, 5-dione[J]. Organic Letters , 2002, 4(9): 1623-1626. DOI:10.1021/ol025839t. |
| [61] | Shafir A, Buchwald S L. Highly selective room-temperature copper-catalyzed C-N coupling reactions[J]. American Chemical Society , 2006, 128(27): 8742-8743. DOI:10.1021/ja063063b. |
| [62] | Sharma K K, Sharma S, Kudwal A, et al. Room temperature N-arylation of amino acids and peptides using copper(Ⅰ) and β-diketone[J]. Organic & Biomolecular Chemistry , 2015, 13(16): 4637-4641. |
| [63] | Sharma K K, Mandloi M, Rai N, et al. Copper-catalyzed N-(hetero)arylation of amino acids in water[J]. RSC Advances , 2016, 6(99): 96762-96767. DOI:10.1039/C6RA23364C. |
| [64] | Lv X, Bao W L. A beta-keto ester as a novel, efficient, and versatile ligand for copper(Ⅰ)-catalyzed C-N, C-O, and C-S coupling reactions[J]. Journal of Organic Chemistry , 2007, 72(10): 3863-3867. DOI:10.1021/jo070443m. |
| [65] | Feng Y S, Man Q S, Pan P, et al. CuCl-catalyzed formation of C-N bond with a soluble base[J]. Tetrahedran Letters , 2009, 50(21): 2585-2588. DOI:10.1016/j.tetlet.2009.03.094. |
| [66] | Chen F, Liu N, Ji E, et al. Copper/β-diketone-catalysed N-arylation of carbazoles[J]. RSC Advances , 2015, 5(64): 51512-51523. DOI:10.1039/C5RA07690K. |
| [67] | Jones G O, Liu P, Houk K N, et al. Computational explorations of mechanisms and ligand-directed selectivities of copper-catalyzed Ullmann-type reactions[J]. Journal of the American Chemical Society , 2010, 132(17): 6205-6213. DOI:10.1021/ja100739h. |
| [68] | Yu H Z, Jiang Y Y, Fu Y, et al. Alternative mechanistic explanation for ligand-dependent selectivities in copper-catalyzed N-and O-arylation reactions[J]. Journal of the American Chemical Society , 2010, 132(51): 18078-18091. DOI:10.1021/ja104264v. |
| [69] | Lefevre G, Franc G, Tlili A, et al. Contribution to the mechanism of copper-catalyzed C-N and C-O bond formation[J]. Organometallics , 2012, 31(22): 7694-7707. DOI:10.1021/om300636f. |
| [70] | Cheng B, Yi H, He C, et al. Revealing the ligand effect on copper(Ⅰ) disproportionation via operando IR spectra[J]. Organometallics , 2015, 34(1): 206-211. DOI:10.1021/om501053k. |




