由温室效应带来的全球气候变化问题已经引起广泛关注。政府间气候变化专门委员会(IPCC)在第五次评估报告《气候变化2013:自然科学基础》[1]中指出,气候变暖毋庸置疑,由此导致的极端天气增多,正不断给人类带来灾害,而人类活动是20世纪中期以来全球气候变暖的主要原因。我国作为发展中的大国,煤炭在能源结构中占据主要地位,截至2017年,由火力发电厂产生的二氧化碳排放量占我国人为排放总量的38%[2],因此,针对电厂烟道气的二氧化碳控制与减排具有重要意义。目前,对于电厂烟道气中的二氧化碳捕集方法主要有燃烧前捕集、富氧燃烧和燃烧后捕集[3],其中,燃烧后捕集[4]中的化学吸收法因具有易于操作实施、选择性高、吸收速率快等优点,成为了目前最为成熟和广泛应用的碳减排技术,适用于排放总量大、成分复杂等场合。工业上,化学吸收法中常用的吸收剂为呈碱性的有机胺水溶液,例如,一乙醇胺(MEA)和N-甲基二乙醇胺(MDEA)已广泛应用于天然气和电厂烟气脱碳领域[5]。有机胺水溶液在吸收过程中可与呈酸性的二氧化碳发生化学反应,反应产物再通过加热分解,从而实现吸收剂的循环利用。但有机胺水溶液存在易氧化降解、再生能耗高等固有缺陷,从而增加了脱碳成本[6-7]。近年来,新型的二氧化碳吸收剂的开发发现,离子液体(ionic liquid, IL)具有不易挥发、性质稳定、结构可控等特性,而氨基酸功能化离子液体则兼具有机胺的优良吸收性能和离子液体上述突出物化性质,被认为具有成为新型二氧化碳吸收剂的潜质,已作为新型绿色材料应用于诸多领域。但其吸收前后黏度增大及较高生产成本的特点不利于工业化发展。Saravanamurugan等[8]发现,离子液体在加入一定量水之后,虽然CO2的吸收容量会受到影响,但CO2的吸收速率会显著增加,Ventura等[9]也发现水的存在大大降低了吸收剂的黏度。因此,将离子液体溶于水中对二氧化碳进行吸收成为了研究热点。
对于有机胺水溶液吸收二氧化碳机理,普遍被接受的是“两性离子”(zwittertion)反应机理,即氨基先与CO2作用生成两性离子中间体,随后两性离子去质子化生成氨基甲酸酯。Lv等[10]基于已有理论,利用碳谱核磁(13CNMR)探究了MEA水溶液在吸收CO2过程中体系化学结构的变化,阐明了氨基先与CO2作用生成氨基甲酸酯,随着CO2吸收负荷的增大,氨基甲酸酯发生水解生成了碳酸氢根,该过程中未明显捕捉到两性离子的存在,此机理也能够解释MEA水溶液的CO2吸收容量大于“两性离子”机理中的理论负荷(每摩尔MEA吸收CO2 0.5 mol)的原因。在上述研究基础上,该课题组又进一步探明了四甲基铵甘氨酸([N1111][Gly])[11]水溶液的CO2吸收与解吸机理,发现与MEA水溶液的类似。此外,基于密度泛函理论(DFT)的分子模拟计算也逐渐应用到了CO2吸收反应中,Hwang等[12]在Gaussian09中模拟了MEA水溶液吸收CO2的整个过程,对机理做出了详细解释。Luo等[13]的研究表明,阴离子上N原子的电负性越大,相应的CO2吸收容量越高。
对于本文合成的四甲基铵赖氨酸([N1111][Lys])离子液体,通过增加阴离子上氨基个数,提高了CO2的吸收容量和吸收速率,具有良好的CO2吸收性能,但目前对其反应机理及动力学探究不够深入。因此,本文详细研究了该离子液体水溶液吸收CO2的反应机理,利用DFT计算进行初步解释,并探明了传质反应动力学机理,为氨基酸功能化离子液体吸收二氧化碳的应用提供了理论基础。
2 实验材料和方法 2.1 试剂与仪器实验中所用的主要试剂如下:四甲基氢氧化铵([N1111][OH],AR,质量分数为25%的水溶液,阿拉丁试剂(上海)有限公司)、赖氨酸(lysine,98%,阿拉丁试剂(上海)有限公司),上述试剂的分子结构见表 1。实验中所用的主要气体为CO2与N2混合气(CO2的体积分数为15%,杭州今工特种气体有限公司)。
|
|
表 1 合成原料及产物结构表 Table 1 Molecular structures of reactants and products |
实验中所用的主要仪器如下:质量流量计(D07-19B,北京七星电子股份有限公司),电子天平(BSA224S,赛多利斯科学仪器有限公司),旋转蒸发仪(RE-2000A,杭州瑞佳精密科学仪器有限公司),黏度计(NDJ-8S,邦西仪器科技有限公司),密度计(DMA 5000M,安东帕商贸有限公司)。
2.2 二氧化碳的吸收负荷测定如图 1所示,吸收在定制的鼓泡玻璃吸收瓶4中进行,其尺寸为ϕ 26mm×150 mm,设置水浴至指定温度。吸收前先向装有预饱和水的吸收瓶中以200 mL·min-1的流量持续通入CO2与N2混合气(CO2的体积分数为15%),利用皂膜流量计测定气体流量至稳定。将25 mL的离子液体水溶液(1mol·L-1)倒入吸收瓶中恒温15 min后,再将流量稳定的混合气通入吸收液,吸收至吸收瓶进口气体流量与出口气体流量相同时为止。
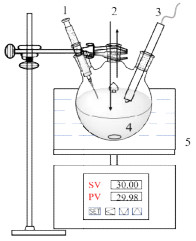
|
图 1 反应机理探究装置图 Fig.1 Experimental setup for the investigation of reaction mechanism 1. sampling port 2. gas inlet and outlet 3. pH meter 4. three-necked flask 5. magnetic stirrer |
本文利用稀硫酸滴定法测定CO2吸收负荷。准确量取1 mL待测液滴入玻璃容器中,迅速加入1 mL质量分数为20 %的稀硫酸,通过解吸出的气体体积计算待测液的CO2吸收负荷。
2.3 反应机理探究在恒温搅拌的条件下(见图 1),以200 mL·min-1的流量持续通入CO2与N2混合气(CO2的体积分数为15%)。酸性气体的通入使得碱性溶液的pH值逐渐下降,而CO2吸收负荷逐渐上升。根据pH值的变化间隔取点,用酸解吸法测定样品中的CO2负荷,并以氘代替水作溶剂,对样品进行13CNMR表征,根据峰的归属与偏移探究体系中化学结构的变化,以此来探明吸收剂与CO2的作用机理。
2.4 反应速率测定图 2为双搅拌釜气液传质评价装置。由质量流量计控制的气体从钢瓶中放出后在气体混合室3中充分混合通入双搅拌釜反应室5,在气液界面处与吸收剂接触。釜体为带有上下双搅拌叶和保温层的有机玻璃反应器,其中吸收剂体积为250 mL,气、液相搅拌速度分别为250和100 r·min-1,气液接触界面面积约为28.27 cm2。在充分搅拌条件下可近似认为气相的浓度是均一的,故可通过测定吸收前后的气体流量来计算CO2的吸收速率。记吸收前、后的气体流量分别为Qin和Qout,m3·min-1,则CO2吸收速率为
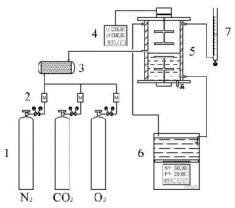
|
图 2 双搅拌釜气液传质评价装置图 Fig.2 Experimental setup of the double-stirred reactor for CO2 absorption 1. gas cylinder 2. mass flow controller 3. gas mixer 4. speed controller 5. double-stirred reactor 6.circulating water bath 7. soap film flowmeter |
| $r = \frac{{p\left( {{Q_{{\rm{in}}}} - {Q_{{\rm{out}}}}} \right)}}{{RT}}$ | (1) |
式中:r为吸收速率,mol·min-1;p为压强,Pa;R为气体常数,J·mol-1·K-1;T为温度,K。
2.5 物性测定与估算本文测定的物性包括不同温度、不同CO2负荷下的离子液体水溶液的黏度与密度,估算的参数有溶解度、扩散系数等。
CO2在离子液体水溶液中的溶解度系数
| $\log \left(\frac{H_{\mathrm{CO}_{2}, \mathrm{~W}}}{H_{\mathrm{CO}_{2}}}\right)=\sum\left(h_{i}+h_{\mathrm{G}}\right) C_{i}$ | (2) |
式中:Ci为离子在溶液中的浓度,mol·L-1;
| $H_{{\mathrm{CO}_{2}, \mathrm{~W}}}=2.82 \times 10^{6} \mathrm{e}^{-\frac{2044}{T}}$ | (3) |
式(2)中的hi和hG分别为离子、气体的溶解度下降系数,L·mol-1,其中,本文中所用的N1111+ 阳离子的溶解度下降系数可用结构相似的NH4+ 代替。CO2的溶解度下降系数hG, CO2则可用下式计算[16]。
| $h_{\mathrm{G}, \mathrm{CO}_{2}}=\left[-0.0172-0.338 \times 10^{-3} \times(T-298.15)\right]$ | (4) |
CO2在离子液体水溶液中的扩散系数可根据下式进行估算[15]:
| $D_{\mathrm{CO}_{2}}=D_{\mathrm{W}}\left(\frac{\mu_{\mathrm{W}}}{\mu}\right)$ | (5) |
式中:
| $D_{\mathrm{W}}=2.35 \times 10^{-6} \mathrm{e}^{-\frac{2119}{T}}$ | (6) |
根据本课题组的前期研究[18]可知,[C2OHmim][Lys]水溶液与CO2反应的初始阶段,即CO2吸收负荷较低时,属于快速反应;而CO2吸收负荷较高时(每摩尔离子液体吸收CO2大于0.95 mol),反应则介于快速拟一级反应与中速反应之间。类似地,本文也假定[N1111][Lys]水溶液与CO2的反应为快速拟一级反应,对应的吸收速率方程为
| $r_{\mathrm{CO}_{2}}=k_{2} C_{\mathrm{IL}} C_{\mathrm{CO}_{2}}=k_{\mathrm{OV}} C_{\mathrm{CO}_{2}} $ | (7) |
式中:k2为二级反应速率常数,m3·mol-1·s-1;kOV为总反应速率常数,s-1;CIL和
根据传质理论[19],有化学反应的CO2总传质速率为
| $N=\frac{p_{\mathrm{CO}_{2}}-p_{\mathrm{CO}_{2}, \mathrm{~L}}^{*}}{\frac{1}{k_{\mathrm{G}}}+\frac{H_{\mathrm{CO}_{2}}}{E k_{\mathrm{L}}}}$ | (8) |
式中:N为总传质速率,mol·m-3·s-1;
根据本课题组前期研究[21],
| $N=\frac{E k_{\mathrm{L}} p_{\mathrm{CO}_{2}}}{H_{\mathrm{CO}_{2}}}$ | (9) |
八田数Ha为液膜内化学反应速率与物理吸收速率之比,表达式如下:
| $H a=\frac{\sqrt{k_{\mathrm{OV}} D_{\mathrm{CO}_{2}}}}{k_{\mathrm{L}}}$ | (10) |
当Ha > 3时,E=Ha,此时,化学反应的动力学区域属于快速拟一级反应[22]。
根据标绘测得的液相传质系数、吸收剂的动力学实验测得的吸收速率和传质速率,可计算得到吸收剂的二级反应速率常数k2、总反应速率常数kOV、增强因子E等一系列动力学参数。
2.7 分子模拟理论计算本文利用Gaussian16[23]软件在DFT理论B3LYP/6-311++G(d, p)基组下进行分子结构的优化、相关参数的计算及寻找反应过渡态。
3 实验结果与讨论 3.1 [N1111][Lys]水溶液的吸收表现表 2为不同温度下、1.0 mol·L-1时[N1111][Lys]离子液体水溶液、[N1111][Gly]离子液体水溶液和MEA水溶液的CO2吸收容量。由表可见,在相同温度下,[N1111][Gly] (含有单个氨基基团)的CO2吸收容量稍大于同浓度的MEA,说明单氨基功能化离子液体的CO2吸收性能虽然优于MEA,但优势并不明显。而含有双氨基的[N1111][Lys]水溶液的CO2吸收容量则明显高于含有单氨基的[N1111][Gly],前者近似为后者的2倍,这说明氨基数量增加能够显著提高离子液体水溶液的CO2吸收容量。由表还可见,随着温度升高,三者的CO2吸收容量都逐渐降低,从30 ℃到60 ℃,[N1111][Lys]水溶液的CO2吸收容量降低了17.0%,[N1111][Gly]的则降低了11.1%,MEA的降低了15.5%。
|
|
表 2 离子液体和MEA水溶液在不同温度下的CO2吸收容量 Table 2 CO2 adsorption capacity of aqueous solutions of [N1111][Lys], [N1111][Gly] and MEA at different temperatures |
图 3为双搅拌釜中不同温度下测定的[N1111][Lys]水溶液对CO2吸收速率随CO2吸收负荷变化趋势。由图可见,低CO2吸收负荷时,CO2吸收速率受温度以及CO2吸收负荷的影响相对较大;当CO2吸收负荷大于0.8 mol·mol-1时,影响几乎可以忽略不计。
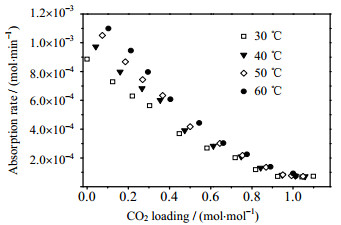
|
图 3 不同温度下[N1111][Lys]水溶液对CO2吸收速率与CO2吸收负荷关系图 Fig.3 CO2 absorption rates of the aqueous solutions of [N1111][Lys] as a function of CO2 loading at different temperatures |
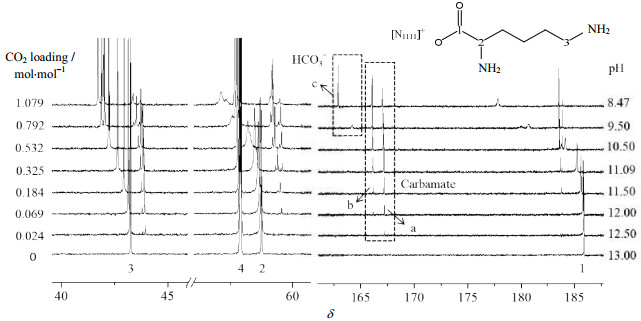
图 4为[N1111][Lys]水溶液的pH值及CO2吸收负荷随吸收时间的变化趋势。由图可见,随着酸性气体CO2的通入,体系的pH值逐渐下降至趋于稳定,而CO2吸收负荷则逐渐增大。在该过程中连续取样进行13CNMR表征,其谱图变化如图 5所示。结合[N1111][Lys]结构和谱图出峰分析可知,新鲜吸收剂液中,赖氨酸阴离子上羧酸根的1号碳峰化学位移δ为185.91,而与两个氨基直接相连的2号和3号碳峰δ分别为58.76和43.36。通入CO2后,反应初始,δ=167.23处出现了属于氨基甲酸酯的碳峰(见图 5中的a),此时3号碳峰也同步出现了峰的偏移以及产物峰的分裂,而2号碳峰的出峰保持不变,说明与3号碳峰相连的氨基最先与CO2发生反应。反应进行到pH=12.00时,δ=166.18处出现了新的氨基甲酸酯碳峰(见图 5中的b),同时2号碳峰也开始偏移并分裂出小的产物峰,说明此时与2号碳峰相连的氨基也参与到CO2的吸收反应中,两个氨基与CO2共同发生作用。当吸收进行到pH为9.50时,属于碳酸氢根的峰(见图 5中的c)出现了,此后氨基甲酸酯碳峰a的强度逐渐降低,且3号碳峰持续偏移,而氨基甲酸酯碳峰b的强度仍在小幅增大,且2号碳峰在该阶段没有明显偏移。这表明,与3号碳峰相连的氨基与CO2作用生成的氨基甲酸酯在吸收后期发生水解生成了碳酸氢根,而与2号碳峰相连的氨基与CO2作用生成的氨基甲酸酯则未参与水解反应,最终碳酸氢根与两个氨基甲酸酯在溶液中共存,且4号碳峰对应的阳离子碳的出峰一直保持不变(见图 5)。因此,[N1111][Lys]水溶液化学吸收CO2的机理可以概括为:阳离子不参与吸收反应,赖氨酸阴离子上远离羰基的氨基优先与CO2反应,而靠近羰基的氨基随后参与反应,生成氨基甲酸酯,并且在反应最后阶段,前者生成的氨基甲酸酯部分水解生成碳酸氢根,最终两种氨基甲酸酯与碳酸氢根共存。
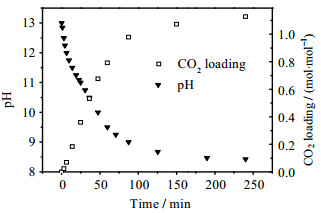
|
图 4 吸收过程中[N1111][Lys]水溶液的CO2吸收性能图 Fig.4 CO2 absorption performance of [N1111][Lys] aqueous solution during absorption processes |
|
图 5 [N1111][Lys]水溶液吸收CO2过程中体系的13CNMR变化谱图 Fig.5 Variation of 13CNMR spectra of [N1111][Lys] with different pH |
如前文所述,在有机胺水溶液吸收CO2过程中,研究者们普遍认为反应可以用“两性离子”机理进行解释,即氨基先与CO2作用生成两性离子中间体,随后两性离子去质子化生成氨基甲酸酯,对应的反应方程式如下[11]:
| $ {\text{CO}}_{\text{2}}\text{+}{\text{RNH}}_{\text{2}}\text{↔RN}{\text{H}}_{\text{2}}^{\text{+}}\text{CO}{\text{O}}^{\text{-}} $ |
| $ \text{RN}{\text{H}}_{\text{2}}^{\text{+}}\text{CO}{\text{O}}^{\text{-}}\text{+}{\text{RNH}}_{\text{2}}\text{↔}\text{RNHCO}{\text{O}}^{\text{-}}\text{+RN}{\text{H}}_{\text{3}}^{\text{+}} $ |
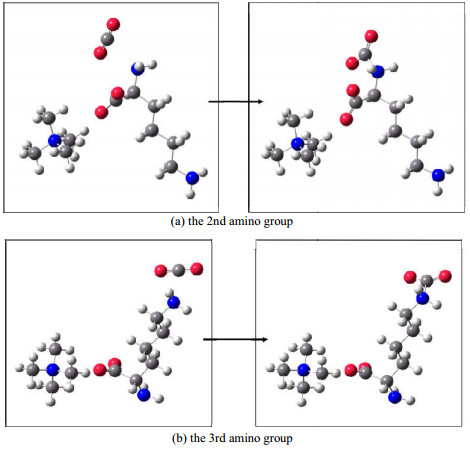
在机理探究中,13CNMR谱图中未能捕捉到两性离子中间体的存在,可能是由于两性离子结构不稳定,生成后极易被去质子化。此外,赖氨酸上含有两个不同位置的氨基,故在去质子化过程中,对应的两性离子被哪个氨基夺取了质子尚无法通过上述实验结果进行判断。因此,本研究借助DFT分子模拟计算进行分析与解释。首先,在Gaussian16中构建[N1111][Lys]分子结构并进行优化及频率计算,随后模拟两性离子生成的反应寻找反应过渡态,最后进行反应轨迹追踪来保证过渡态的正确性,图 6为两个氨基与CO2作用生成两性离子的反应物和产物结构,过渡态和反应物的能垒分别为28.60和29.21 kJ·mol-1。此外,2号碳和3号碳(与图 5中的序号对应)所连的氨基上N的电负性(mulliken charge[13])分别为-0.322 7和-0.419 7,后者的电负性要强于前者,即与CO2的结合能力后者更强[13],这也与前文的反应机理中3号碳所连的氨基优先与CO2作用相对应,说明了计算结果的可靠性。
|
图 6 氨基与CO2作用的反应物和产物结构图 Fig.6 Structures of reactants and products for amino group and CO2 reaction |
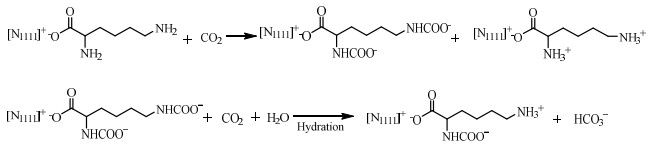
在此基础上,进一步模拟两性离子去质子化的过程。根据Hwang等[12]的研究结果,在水溶液中,两性离子上的质子通过水分子进行传递。由于赖氨酸阴离子上有两个氨基,故去质子化可能的路径有两种,一是2号碳相连的两性离子被另一个2号碳所连的氨基夺去质子,相应的3号两性离子则被另一个3号碳所连的氨基夺去质子;二是2号碳相连的两性离子被另一个3号碳所连的氨基夺去质子,而3号两性离子则被另一个2号碳所连的氨基夺去质子。通过计算,路径一存在合理的过渡态和反应路径追踪,而路径二无法寻找到合适的过渡态,故认为去质子化的过程为路径一,即两性离子会被对应的另一分子氨基夺去质子从而生成氨基甲酸酯。综上所述,推测[N1111][Lys]水溶液吸收CO2的反应机理如图 7所示。
|
图 7 [N1111][Lys]水溶液吸收CO2反应机理图 Fig.7 Proposed reaction mechanism for CO2 absorption of aqueous solution of [N1111][Lys] |
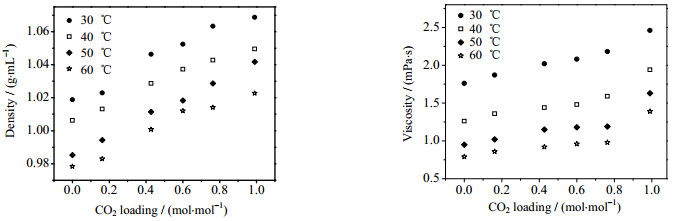
表 3列出了[N1111][Lys]新鲜吸收液的相关动力学数据。可见,不同温度下的八田数Ha和增强因子E的数值大小相等,表明前文中关于快速拟一级反应的假定成立。另外还可以看出,随着温度的升高,离子液体水溶液的黏度和密度都有所降低。图 8对比了温度、CO2吸收负荷对吸收剂黏度和密度的影响,显然溶于水后吸收剂的黏度很低,并且温度对黏度的影响要大于CO2吸收负荷的影响;密度受温度和CO2吸收负荷的影响都较为明显。此外,由表 3可知,N、kOV、E和
|
|
表 3 [N1111][Lys]水溶液吸收CO2的动力学数据 Table 3 Kinetics data of CO2 absorption by aqueous solution of [N1111][Lys] |
|
图 8 不同温度不同CO2吸收负荷下离子液体水溶液的密度和黏度 Fig.8 Density and viscosity of aqueous solutions of ionic liquids at different CO2 loadings and temperatures |
Arrhenius公式可以用来描述反应速率常数k和反应温度T之间的关系,其表达式如下:
| $k=A \mathrm{e}^{-\frac{E_{\mathrm{a}}}{R T}}$ | (11) |
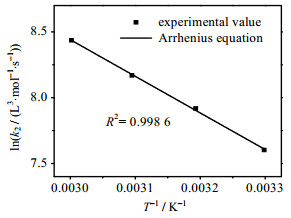
图 9为[N1111][Lys]水溶液吸收CO2的二级反应速率常数对数值ln k2与1/T的实验值拟合所得曲线,拟合所得的Arrhenius公式如下:
|
图 9 [N1111][Lys]水溶液吸收CO2过程中的Arrhenius关系图 Fig.9 Arrhenius curve of CO2 absorption by aqueous solution of [N1111][Lys] |
| $k_{2}=1.95 \times 10^{7} \mathrm{e}^{-\frac{2781.84}{T}}$ | (12) |
由此可得表观活化能Ea为23.04 kJ·mol-1,而相同实验条件、相同浓度下的MEA水溶液吸收CO2的表观活化能为26.72 kJ·mol-1[24],可见,[N1111][Lys]水溶液吸收CO2的表观活化能略低于MEA水溶液,这说明该离子液体水溶液在拥有更高的CO2吸收容量和更快的吸收速率的同时,反应也更容易进行。
4 结论为了提高CO2吸收性能,合成了双氨基离子液体[N1111][Lys],其水溶液在对CO2的吸收容量和吸收速率上都有较好的表现,30~60 ℃时,CO2的吸收容量分别为1.197、1.169、1.133和0.994 mol·mol-1。利用13CNMR探究其反应机理并结合分子模拟计算,发现[N1111][Lys]阴离子上的氨基并非同时参与CO2吸收,而是存在先后顺序;在水解阶段,受周围基团影响,也并非所有氨基生成的氨基甲酸酯都能参与水解。动力学探究结果表明,该离子液体水溶液吸收CO2的化学反应属于快速拟一级反应,其表观活化能为23.04 kJ·mol-1。本文为离子液体水溶液吸收CO2提供了基础数据和理论依据。
| [1] |
STOCKER T F, QIN D H. Climate Change 2013: The physical science basis. Contribution of Working Group I to the Fifth Assessment Report of the IPCC[R]. In: Cambridge, United Kingdom and New York, NY, USA: Cambridge University Press; 2013.
|
| [2] |
安祥华, 姜昀. 我国火电行业二氧化碳排放现状及控制建议[J]. 中国煤炭, 2011, 37(1): 108-110, 191. AN X H, JIANG J. Status quo and some suggestions on control of CO2 emission from the thermal power industry of China[J]. China Coal, 2011, 37(1): 108-110, 191. |
| [3] |
RUBIN E, MEYER L, DE CONINCK H. IPCC special report on carbon dioxide capture and storage[R]. In: Intergovernmental Panel on Climate Change; 2005.
|
| [4] |
KOHL A, NIELSEN R. Gas Purification[M]. Fifth Edition. US: Gulf Publishing Company, 1997.
|
| [5] |
SEKAR R. C. Carbon dioxide capture from existing coal-fired power plants: A real options analysis[R]. In: Massachusetts Insititute of Technology, MA, 2005. https://sequestration.mit.edu/pdf/LFEE_2005-002_RP.pdf
|
| [6] |
IEA.CO2 emissions from fuel combustion[R]. In: IEA, Paris, 2018. https://www.iea.org/co2-emissions-from-fuel-combustion-2018.
|
| [7] |
刘婷.中国CO2排放的区域转移与碳税分析[D].北京: 清华大学, 2017. LIU T. Regional embodied carbon emissions and carbon tax in China[D]. Beijing: Tsinghua University, 2017. |
| [8] |
SARAVANAMURUGAN S, KUNOV-KRUSE A J, FEHRMANN R, et al. Amine-functionalized amino acid-based ionic liquids as efficient and high-capacity absorbents for CO2[J]. ChemSusChem, 2014, 7(3): 897-902. DOI:10.1002/cssc.201300691 |
| [9] |
VENTURA P M, PAULY J, DARIDON J L, et al. High pressure solubility data of carbon dioxide in (tri-iso-butyl(methyl) phosphonium tosylate+water) systems[J]. The Journal of Chemical Thermodynamics, 2008, 40(8): 1187-1192. DOI:10.1016/j.jct.2008.04.012 |
| [10] |
LV B H, GUO B S, ZHOU Z M, et al. Mechanisms of CO2 capture into monoethanolamine solution with different CO2 loading during the absorption/desorption processes[J]. Environmental Science & Technology, 2015, 49(17): 10728-10735. |
| [11] |
周作明, 郭冰松, 吕碧洪, 等. 氨基酸离子液体水溶液吸收及解吸二氧化碳机理[J]. 中国科学:化学, 2015, 45(7): 747-754. ZHOU Z M, GUO B S, LV B H, et al. Absorption/desorption mechanism of carbon dioxide capture into amino acid ionic liquid aqueous solution[J]. Scientia Sinica Chimica, 2015, 45(7): 747-754. |
| [12] |
HWANG G S, STOWE H M, PAEK E, et al. Reaction mechanisms of aqueous monoethanolamine with carbon dioxide: A combined quantum chemical and molecular dynamics study[J]. Phys. Chem. Chem. Phys., 2015, 17(2): 831-839. DOI:10.1039/C4CP04518A |
| [13] |
LUO X Y, GUO Y, DING F, et al. Significant improvements in CO2 capture by pyridine-containing anion-functionalized ionic liquids through multiple-site cooperative interactions[J]. Angewandte Chemie-International Edition, 2014, 53(27): 7053-7057. DOI:10.1002/anie.201400957 |
| [14] |
SCHUMPE A. The estimation of gas solubilities in salt-solutions[J]. Chemical Engineering Science, 1993, 48(1): 153-158. |
| [15] |
VERSTEEG G F, SWAAIJ W V. Solubility and diffusivity of acid gases (CO2, N2O) in aqueous alkanolamine solutions[J]. Journal of Chemical and Engineering Data, 1988, 33(1): 29-34. DOI:10.1021/je00051a011 |
| [16] |
WEISENBERGER S, SCHUMPE A. Estimation of gas solubilities in salt solutions at temperatures from 273 K to 363 K[J]. AIChE Journal, 1996, 42(1): 298-300. DOI:10.1002/aic.690420130 |
| [17] |
PORTUGAL A F, MAGALHAES F D, MENDES A. Carbon dioxide absorption kinetics in potassium threonate[J]. Chemical Engineering Science, 2008, 63(13): 3493-3503. DOI:10.1016/j.ces.2008.04.017 |
| [18] |
LI S J, ZHAO C J, SUN C, et al. Reaction mechanism and kinetics study of CO2 absorption into[C2OHmim][Lys][J]. Energy & Fuels, 2016, 30(10): 8535-8544. |
| [19] |
SHARMA M M, DANCKWERTS P V. Chemical methods of measuring interfacial area and mass transfer coefficients in 2-fluid systems[J]. British Chemical Engineering, 1970, 15(4): 522-522. |
| [20] |
DANCKWERTS P V, MCNEIL K M. Absorption of carbon dioxide into aqueous amine solutions and effects of catalysis[J]. Transactions of the Institution of Chemical Engineers and the Chemical Engineer, 1967, 45(1): 32-49. |
| [21] |
LV B H, SUN C, LIU N, et al. Mass transfer and kinetics of CO2 absorption into aqueous monoethanolamine/1-hydroxyethy-3-methyl imidazolium glycinate solution[J]. Chemical Engineering Journal, 2015, 280: 695-702. DOI:10.1016/j.cej.2015.06.004 |
| [22] |
申淑锋, 冯晓霞, 赵瑞红. 活化碳酸钾溶液吸收CO2的动力学研究[J]. 高校化学工程学报, 2013, 27(5): 903-909. SHEN S F, FENG X X, ZHAO R H. Kinetics of CO2 absorption by promoted aqueous potassium carbonate solution[J]. Journal of Chemical Engineering of Chinese Universities, 2013, 27(5): 903-909. |
| [23] |
FRISCH M J, TRUCKS G W, SCHLEGEL H B, et al. Gaussian 16 Rev. B.01[CP]. In: Wallingford, CT: 2016.
|
| [24] |
吕碧洪. MEA/离子液体混合水溶液吸收CO2的传质-反应机理[D].杭州: 浙江大学, 2014. LV B H. Mechanism of mass transfer with chemical reaction of CO2 absorption into the mixed aqueous solution of MEA and ionic liquid[D]. Hangzhou: Zhejiang University, 2014. |




