2. 浙江大学衢州研究院,浙江 衢州 324000;
3. 新秀化学(烟台)有限公司,山东 烟台 264006
2. Institute of Zhejiang University-Quzhou, Quzhou 324000, China;
3. Xinxiu Chemistry(Yantai) Co. Ltd., Yantai 264006, China
2, 2, 6, 6-四甲基-4-哌啶胺简称四甲基哌啶胺或TEMP,四甲基哌啶胺是一种重要的化工中间体,主要用于合成键合型和高分子聚合型光稳定剂[1-6]。
合成四甲基哌啶胺的方法主要有两类,电化学法和催化胺化法。电化学法以铝为阴极,铅为阳极,在阴极区以碱金属磷酸盐水溶液作为介质,阳极区以20%硫酸作为介质[7],以2, 2, 6, 6-四甲基-4-哌啶酮(简称四甲基哌啶酮或哌啶酮,TAA)为原料,进行还原胺化反应,得到产物四甲基哌啶胺。该方法产品收率高,可达到93%以上。但是使用酸性电解质,对设备有强腐蚀性。
催化胺化法是目前工业上最广泛使用的方法。催化胺化法以2, 2, 6, 6-四甲基-4-哌啶酮和氨为原料,使用金属催化剂或负载型金属催化剂在加氢条件下进行反应。根据文献报道,采用Ni催化剂或Co催化剂,反应温度均在100 ℃以上[8-16],温度较高,能耗大,且反应过程中会产生2, 2, 6, 6-四甲基-4-哌啶醇(简称四甲基哌啶醇或哌啶醇,TAA-OL)等副产物,后处理需要精馏提纯等操作。为提高还原胺化的选择性,学者在不断探究许多新型催化剂,如氮掺杂碳负载钴催化剂[18],还有学者采用加入Cr元素的过度金属催化剂Cu系二元催化剂,负载在γ-Al2O3上进行还原胺化,产物四甲基哌啶胺选择性可达到81.9% [19]。但是这些新型催化剂制备过程工艺复杂,成本较高。
在催化胺化反应体系中,2, 2, 6, 6-四甲基-4-哌啶酮与氨反应转化为亚胺的过程可以影响最终四甲基哌啶胺的生成,而改变催化剂种类只能在亚胺加氢还原过程中产生促进作用。若能从本质上促进亚胺中间体的生成,则可以提高最终四甲基哌啶胺的产率,而pH值则是影响该步反应的重要影响因素。
有文献深入探讨了pH值与不同反应进程的联系,在双氯酚酸被Mn(Ⅶ)氧化过程[20]、等离子体催化4-硝基苯硫醇二聚化为DMAB等[21]反应过程中,pH值影响了反应速率以及原料转化率。同时,文献[22]在证实了pH对反应过程存在影响的基础上,又进一步研究了pH是如何影响反应历程的,并建立了动力学模型或速率方程深入讨论。pH作为重要的反应条件之一,影响了体系中分子的存在状态及反应历程。本文基于亚胺分子中间体考虑,通过调整pH值促进中间体亚胺的生成,从而对现有的催化胺化工艺进行改进,以达到较高的四甲基哌啶胺选择性和收率。
2 实验(材料与方法) 2.1 仪器与试剂(1) 主要试剂:2, 2, 6, 6-四甲基-4-哌啶酮(工业品,新秀化学(烟台)有限公司),氨水(w = 25%~28%,国药试剂),Raney Ni催化剂(50 μm,阿拉丁试剂),片状NaOH(CP,国药试剂)。
(2) 气相色谱-质谱联用:TRACE GC 2000/TRACE MS气相色谱-质谱联用仪(Thermo Quest公司);气相色谱另配安捷伦1790F氢火焰检测器。
2.2 合成2, 2, 6, 6-四甲基-4-哌啶胺加氢反应在高压釜中进行,水作为溶剂,按照一定比例加入浓度为w = 25%~28%的氨水,2, 2, 6, 6-四甲基哌啶酮10~20 g,以及原料四甲基哌啶酮质量的1%~10%的Raney Ni催化剂,通入氮气置换釜内空气。充分搅拌,达到设定温度一段时间后,通入氢气至指定压力,反应一段时间后,氢气压力下降,继续补充氢气至指定压力,重复此操作至釜内压力不再变化。反应结束后,停止搅拌,冷却降温,取出釜内物料,减压蒸馏除去水分以及轻组分杂质,回收催化剂并循环使用。催化胺化法合成四甲基哌啶胺的反应方程式如图 1所示。
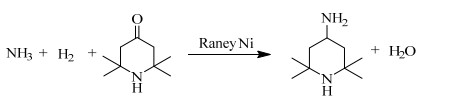
|
图 1 目标化合物反应式 Fig.1 Scheme of target compound synthesis |
可能发生的副反应方程式如图 2所示。其中A物质为2, 2, 6, 6-四甲基-4-哌啶醇,B物质为异丙胺,C物质为4-甲基-2-戊胺。
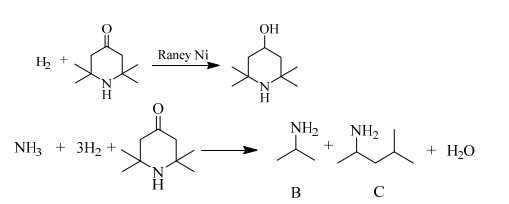
|
图 2 副反应式 Fig.2 Scheme of side reactions |
在四甲基哌啶酮制备哌啶胺的过程中,主要的副反应有2, 2, 6, 6-四甲基-4哌啶酮直接加氢生成副产物2, 2, 6, 6-四甲基-4-哌啶醇,此外还伴随着开环反应,生成异丙胺等轻沸点开环产物。
3.2 影响反应的因素 3.2.1 pH值对反应的影响在四甲基哌啶酮催化胺化过程中,原料的摩尔比是重要的影响因素。当氨的摩尔量较少时,生成的四甲基哌啶胺会继续与过量的四甲基哌啶酮进行反应。反应方程式如图 3所示。因此在确定四甲基哌啶酮与氨的摩尔比时,应当使n(NH3):n(四甲基哌啶酮)≥1,确保体系中氨过量。
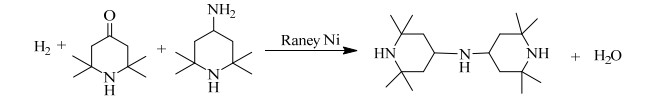
|
图 3 过量的四甲基哌啶酮与四甲基哌啶胺继续反应方程式 Fig.3 Reaction of overdosed TAA with TEMP |
其中4组反应物料摩尔比不同,其他条件均相同,反应温度60 ℃,反应压力2 MPa,催化剂加入量w=7%。
根据实验结果,当摩尔比为1:1时,四甲基哌啶胺选择性不高,生成了较多的四甲基哌啶醇;摩尔比1:3与1:5对于四甲基哌啶胺选择性的影响区别不大。但是开环产物却随氨摩尔量的增多而增多。
翟亚锐[17]曾对氨与四甲基哌啶酮的原料配比与产物的结果进行研究,其实验结果表明,当氨与四甲基哌啶酮摩尔比为5.25:1时,产物的收率为89%,选择性为90%,均为最佳值。其归纳原因为随着氨的摩尔量的增多,氨在体系中浓度增大,从而促进主反应进行。
伴随体系中氨的增加,体系的碱性也随之增强。为验证体系碱性对于实验结果的影响,在体系中加入NaOH调整体系pH值进行对比实验。实验结果如表 2所示。当体系pH值为12.5左右时,四甲基哌啶胺的选择性最高,随着pH值的增大,四甲基哌啶胺的选择性有所下降。
|
|
表 1 原料摩尔比与产物选择性实验结果 Table 1 Correlation of material molar ratios with target product selectivity |
|
|
表 2 pH值对于实验影响 Table 2 Effects of pH on experimental results |
体系的酸碱度主要从两个方面影响实验过程,亚胺的生成和四甲基哌啶酮开环反应。根据有机化学[24]中酮与氨的反应机理,推导本反应四甲基哌啶酮还原胺化过程反应机理如图 4所示,主要分为两个阶段。第1阶段是亚胺生成过程,第2阶段是亚胺加氢还原过程。在亚胺生成阶段中,体系中氨分子浓度的增加有利于平衡向生成亚胺的方向移动。适量的加入强碱抑制了一水合氨的电离过程,液相中的水合氨分子浓度上升,从而促进氨分子与四甲基哌啶酮的反应,亚胺生成过程平衡右移,有利于主反应进行。并且在碱性环境下,亚胺中间体也更为稳定,有报道指出,亚胺中间体在碱性条件[25-26]时,水解速率最小。但是体系碱性过强时,会导致异丙胺等物质增多。
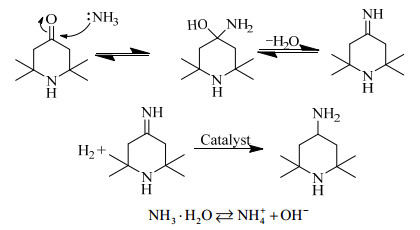
|
图 4 反应机理 Fig.4 Reaction mechanism |
综合以上结果,通过加入适量强碱调整体系pH值,使平衡右移,在反应的第1阶段促进亚胺的生成,从而达到提高四甲基哌啶胺的收率的目的。强碱的加入量为原料质量的0.5%~1.5%时为最佳,控制体系pH值在12.5左右有利于反应进行。
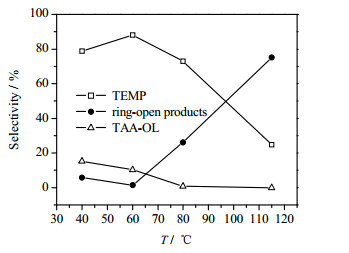
3.2.2 温度对反应的影响在不同反应温度下进行实验,反应的选择性有所不同。反应结果见图 5,其中4组反应温度条件不同,其他条件均相同,摩尔比n(四甲基哌啶酮):n(NH3) = 1:3,反应压力2 MPa,体系pH值为12.5,催化剂加入量w = 7%。
|
图 5 反应温度与各产物选择性 Fig.5 Relationship between reaction temperature and selectivity |
根据以上实验结果,在反应温度115 ℃时,四甲基哌啶胺收率极低,结果显示有异丙胺等低沸点轻组分物质大量出峰。当反应温度降低至60 ℃时,轻组分产物减少,四甲基哌啶胺的选择性明显提高。分析原因有以下几点:(1)在升温过程中,温度升高至90 ℃时,观察到釜内压力有所上升,由初始状态的0 MPa上升至0.2 MPa左右。这是由于温度升高,氨在液相中溶解度下降,导致釜内气体压力增大。液相中氨逸出导致液相中氨浓度降低,不利于反应初期亚胺的形成,这是高温不利于反应的原因之一。(2)四甲基哌啶酮催化胺化还原反应体系是一个复杂的反应体系,在进行主反应的过程中还伴随着开环、分子间缩合等一系列的副反应。当温度升高时,有利于C─C键的活化过程[24],从而更容易导致C─C键断裂,因此异丙胺等轻组分产物增多。(3)亚胺生成以及水解过程为二级反应,已有文献针对不同的亚胺进行动力学研究[27-29],亚胺生成焓为负数,温度高并不利于亚胺生成。
为验证高温导致异丙胺等物质增加,进行了对比实验,在对比实验中,不加入催化剂,只加入四甲基哌啶酮和氨水,将温度升高至120 ℃,正常充入氢气至一定压力,其余实验条件相同。反应一段时间后,进行GC检测,检测结果表 3所示。高温下反应结果中开环产物异丙胺等轻组分较多,四甲基哌啶胺含量较少。综合上述原因与实验结果,四甲基哌啶酮催化胺化过程温度不宜过高,60 ℃为最佳反应温度。
|
|
表 3 对比实验结果组分含量 Table 3 Component concentrations from comparative tests |
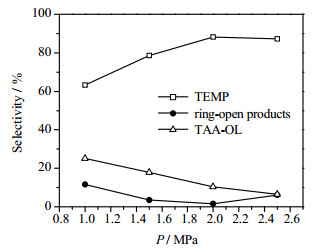
反应压力是影响加氢过程的重要因素。四甲基哌啶酮催化胺化过程是在高压下进行,为探究压力对反应的影响,进行以下实验:其中3组反应压力条件不同,其他条件均相同,摩尔比n(四甲基哌啶酮):n(NH3) = 1:3,反应温度60 ℃,体系pH值为12.5,催化剂加入量w = 7%。结果如图 6所示。
|
图 6 加氢压力与各产物选择性 Fig.6 Effects of pressure on target product selectivity |
氢气压力主要影响反应物在催化剂上的吸附脱附过程。当压力低时,反应物吸附速率较慢,生成物脱附速率快,有利于反应正向进行;但是压力过低导致四甲基哌啶酮转化不完全,原料有所剩余。
当压力条件上升到使得吸附过程与脱附过程平衡时,此时吸附速率最快,产物生成速率也最快,此时的压力条件为最佳压力条件。当反应压力过高时,生成物脱附速率降低,过多的生成物难以从催化剂表面脱附下来,占据了催化剂的活性位点,不利于反应的进行。而且压力过高也不利于实际生产,过高的压力条件对于技术性和安全性要求较高,也会导致器材成本升高。
4 结论根据以上实验结果,得出以下结论:
(1) 反应温度和体系pH值主要影响四甲基哌啶酮还原胺化反应过程中的选择性,而反应压力则影响反应物的吸附-脱附过程。反应温度过高导致C─C键活化而断裂,产生异丙胺等轻组分物质,降低了四甲基哌啶胺的选择性。
(2) 调整加入碱和氨的量可以控制体系的pH值。体系碱性过强或者过弱都不利于目标产物四甲基哌啶胺的生成。强碱性环境下会导致异丙胺等轻沸点物质增多,四甲基哌啶胺选择性降低。当体系碱性过弱时,不利于反应第一步亚胺的生成,亚胺能水解变回羰基结构。而适量的加入强碱,抑制一水合氨的电离,则促使生成亚胺,反应正向进行。压力影响反应物和产物的吸附脱附过程,对于该反应,过低的压力导致原料无法完全转化。
(3) 根据实验结果,最适宜的反应温度在60 ℃左右,体系pH值应控制在12.5左右,压力2 MPa左右,在该条件下,反应温度较低,四甲基哌啶胺选择性高,可达到95%,副产物少。
| [1] |
颜庆宁. 国内外塑料助剂产业发展状况(一)[J]. 精细与专用化学品, 2014, 22(11): 10-13. YAN Q N. Development situation of plastic additive industry at home and abroad (I)[J]. Fine and Specialty Chemicals, 2014, 22(11): 10-13. DOI:10.3969/j.issn.1008-1100.2014.11.002 |
| [2] |
白福臣, 程凤梅, 叶永成, 等. 受阻胺类光稳定剂的研究进展[J]. 塑料科技, 2002(4): 20-24. BAI F C, CHENG F M, YE Y C, et al. Research advance of hindered amine light stabilizer[J]. Plastics Science and Technology, 2002(4): 20-24. DOI:10.3969/j.issn.1005-3360.2002.04.006 |
| [3] |
蔡智奇, 张平安, 盛春蕊, 等. HALS中间体三丙酮胺及其衍生物的合成技术及应用研究进展[J]. 塑料助剂, 2015(5): 20-25. CAI Z Q, ZHANG P A, SHENG C R, et al. Advance in research of synthesis technology and application for hals intermediates triacetonamine and its derivatives[J]. Plastic Additives, 2015(5): 20-25. DOI:10.3969/j.issn.1672-6294.2015.05.004 |
| [4] |
付伟强, 王锐, 张辉, 等. 四甲基哌啶胺对PA6抗紫外光老化和热氧稳定性的影响[J]. 北京服装学院学报(自然科学版), 2014, 34(3): 15-21. FU W Q, WANG R, ZHANG H, et al. Influence of 4-amino-2, 2, 6, 6-tetramethylpiperidine on the UV light aging and thermal oxidation stability of PA6[J]. Journal of Beijing Institute of Clothing Technology, 2014, 34(3): 15-21. |
| [5] |
GIJSMAN P. A review on the mechanism of action and applicability of hindered amine stabilizers[J]. Polymer Degradation & Stability, 2017, 145: 2-10. |
| [6] |
陈宇, 马良芳, 刘焰, 等. 聚合型受阻胺光稳定剂在温室覆盖薄膜中的应用研究[J]. 中国塑料, 2007, 21(8): 78-83. CHEN Y, MA L F, LIU Y, et al. Research on the application of polymeric hindered amine light stabilizer in greenhouse film[J]. China Plastics, 2007, 21(8): 78-83. |
| [7] |
袁燕静. 2, 2, 6, 6-四甲基哌啶类紫外吸收剂合成工艺研究[D].烟台: 烟台大学, 2016. YUAN Y J. Research on the synthesis of 2, 2, 6, 6-tetramethylpiperidyl ultraviolet absorbent[D]. Yantai: Yantai University, 2016. |
| [8] |
FIOSHIN M. Preparation of 2, 2, 6, 6-tetramethyl-4-aminopiperidine and its substituted compounds by electroreduction of azomethines of 2, 2, 6, 6-tetramethyl-4-oxopiperidine (triacetonamine)[J]. Collection of Czechoslovak Chemical Communications, 1987, 52(1): 182-191. DOI:10.1135/cccc19870182 |
| [9] |
POPOVA Z G, TATSITOV V I. Method for preparing 4-amino-2, 2, 6, 6, -tetrameth ylpipe ridine: CN, 2176473[P]. 1986-12-31.
|
| [10] |
黄红梅, 王多禄, 陈立功, 等. 催化胺化法合成2, 2, 6, 6-四甲基-4-哌啶胺[J]. 天津大学学报, 1999(4): 96-99. HUANG H M, WANG D L, CHEN L G, et al. Synthesis of 2, 2, 6, 6 tetramethyl 4 piperidiamine by catalytic amination[J]. Journal of Tianjin University, 1999(4): 96-99. |
| [11] |
BREHME V, DEMBKOWSKI D. Process for the preparation of 4-amino-2, 2, 6, 6-tetramethylpiperidine: US, 2009209766[P]. 2009-08-20.
|
| [12] |
JEGELKA U Dr. KREILKAMP G. Continuous process for the preparation of 4-amino-2, 2, 6, 6-tetramethylpiperidine: US, 5945536[P]. 1997-06-05.
|
| [13] |
FRENTZEN S NEUBER E, THELEN G. Process and the preparation of 4-amino-2, 2, 6, 6-tetra-methyl piperidine: EP, 0714890[P], 1997-01-22.
|
| [14] |
叶岗, 俞芳, 时昭, 等. 2, 2, 6, 6-四烷基-4-哌啶胺类的制备方法: CN, 1336365[P]. 2002-02-20. YE G, YU F, SHI Z, et al. Prepn. of 2, 2, 6, 6-tetraalkyl-4-piperylhydrazines: CN, 1336365[P]. 2002-02-20. |
| [15] |
李阳, 邢俊德, 王磊, 等. 催化合成2, 2, 6, 6-四甲基-4-氨基哌啶[J]. 化学工业与工程, 2006, 23(4): 323-326. LI Y, XING J D, WANG L, et al. Preparation of 4-amino-2, 2, 6, 6-tetramethyl-4-piperidine in presence of catalyst[J]. Chemical Industry and Engineering, 2006, 23(4): 323-326. DOI:10.3969/j.issn.1004-9533.2006.04.011 |
| [16] |
吴添, 崔现宝, 尹伟超, 等. 2, 2, 6, 6-四甲基-4-氨基哌啶的精馏提纯[J]. 化学工业与工程, 2010, 27(4): 294-298. WU T, CUI X B, YIN W C, et al. Purification of 4-amino-2, 2, 6, 6-tetramethyl-4-piperidine by distillation[J]. Chemical Industry and Engineering, 2010, 27(4): 294-298. DOI:10.3969/j.issn.1004-9533.2010.04.003 |
| [17] |
翟亚锐.三丙酮胺衍生物的合成与分离[D].天津: 天津大学, 2005. ZHAI Y R. Preparation and separation of the derivatives of Triacetonamine[D]. Tianjin: Tianjin University, 2005. |
| [18] |
YUAN Z L, LIU B, ZHOU P, et al. Preparation of nitrogen-doped carbon supported cobalt catalysts and its application in the reductive amination[J]. Journal of Catalysis, 2019, 370(2): 347-356. |
| [19] |
杜小宝.芳香醛酮的绿色还原和三丙酮胺的还原胺化研究[D].天津: 天津大学, 2014. DU X B. Studies on the green reduction of aromatic aldehydes and ketones and the reductive amination of triacetoneamine[D]. Tianjin: Tianjin University, 2014 |
| [20] |
CHENG H, SONG D, LIU H, et al. Permanganate oxidation of diclofenac:The pH-dependent reaction kinetics and a ring-opening mechanism[J]. Chemosphere, 2015, 136(10): 297-304. |
| [21] |
WANG J G, DONG Y, LI Y Z, et al. pH-Dependent plasmonic catalysis of 4-nitrobenzenethiol in aqueous environment[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2016, 153: 542-545. DOI:10.1016/j.saa.2015.09.033 |
| [22] |
MARTINS S I F S, BOEKEL M A J S V. Kinetics of the glucose/glycine Maillard reaction pathways:Influences of pH and reactant initial concentrations[J]. Food Chemistry, 2005, 92(3): 437-448. DOI:10.1016/j.foodchem.2004.08.013 |
| [23] |
高鸿宾. 有机化学[M]. 第四版. 北京: 高等教育出版社, 2005: 490-491. GAO H B. Organic chemistry[M]. 4th ed. Beijing: Higher Education Press, 2005: 490-491. |
| [24] |
JUN C H. Transition metal-catalyzed carbon-carbon bond activation[J]. Chemical Society Reviews, 2004, 33(9): 610-618. DOI:10.1039/B308864M |
| [25] |
EL-TAHER M A, EL-HATY M T, HUSSIEN T M. Effect of partially aqueous solutions of different pH's on the hydrolysis rate of some Schiff bases[J]. Polish Journal of Chemistry, 2001, 75(1): 79-91. |
| [26] |
HASSIB H B, ABDEL-KADER N S, ISSA Y M. Kinetic study of the hydrolysis of Schiff bases derived from 2-aminothiophenol[J]. Journal of Solution Chemistry, 2012, 41(11): 2036-2046. DOI:10.1007/s10953-012-9920-6 |
| [27] |
袁慎峰, 张旭东, 尹红, 等. 异佛尔酮腈亚胺化反应动力学研究[J]. 高校化学工程学报, 2014, 28(1): 46-50. YUAN S F, ZHANG X D, YIN H, et al. A kinetic study of imination of isophorone nitrile[J]. Journal of Chemical Engineering of Chinese Universities, 2014, 28(1): 46-50. DOI:10.3969/j.issn.1003-9015.2014.01.007 |
| [28] |
金晓晓, 王江涛, 白洁. 壳聚糖与肉桂醛的缩合反应制备席夫碱及其抑菌活性研究[J]. 高校化学工程学报, 2010, 24(4): 645-650. JIN X X, WANG J T, BAI J. Synthesis of Schiff base from chitosan and cinnamaldehyde and its antimicrobial activity[J]. Journal of Chemical Engineering of Chinese Universities, 2010, 24(4): 645-650. DOI:10.3969/j.issn.1003-9015.2010.04.017 |
| [29] |
陈建, 余欣, 车圆圆, 等. 连续反应精馏法合成席夫碱及其动力学研究[J]. 高校化学工程学报, 2019, 33(2): 380-387. CHEN J, YU X, CHE Y Y, et al. Synthesis of Schiff base by continuous reactive distillation and its reaction kinetics[J]. Journal of Chemical Engineering of Chinese Universities, 2019, 33(2): 380-387. DOI:10.3969/j.issn.1003-9015.2019.02.016 |




