2. 西安航天源动力工程有限公司,陕西 西安 710100;
3. 西北化工研究院,陕西 西安 710061
2. Xi'an Aerospace Yuan Dongli Engineering Co., Ltd., Xi'an 710100, China;
3. The Northwest Research Institute of Chemical Industry, Xi'an 710061, China
我国化石能源“富煤、贫油、少气”的赋存特征,决定了目前以煤炭为主的能源结构现状。煤气化技术是实现煤炭清洁高效利用的核心途径。目前已实现工业化的煤气化技术主要包括固定床煤气化技术、流化床煤气化技术和气流床煤气化技术。气流床煤气化技术操作压力和温度高、负荷大,煤种适应范围广,已成为煤气化技术发展的主流[1]。气流床煤气化技术包括以水煤浆为原料的湿法煤气化和以粉煤为原料的干法煤气化。总体上以煤为原料气化产生的合成气氢碳比较低,后续化工利用需要进行补氢。另一方面,油田开采过程中所产生一定量的伴生气体,主要成分是甲烷,这部分气体可以通过制备合成气加以有效利用。甲烷转化制合成气主要有水蒸气重整、非催化部分氧化和二氧化碳重整,分别能制取H2/CO理论值为3:1、2:1和1:1的合成气[2]。相比于煤气化,利用甲烷转化所得合成气氢碳比较高,而且CO2含量低。因此,在煤气化工艺的基础上,辅以甲烷转化技术,有望实现氢碳互补,调整合成气的H2/CO比在1~2之间,提高原料的利用率。此外,吸放热反应分析表明,煤气化总体上是放热过程,而甲烷转化过程是吸热过程。如果将煤气化过程剩余的热量用于甲烷转化,能够实现能量互补,提高能源利用效率。因此水煤浆与甲烷共气化2种气化模式有效耦合,可望达到不同气化工艺的协同优化与通达匹配。
目前对共气化的实验研究还停留在小试阶段[3-5],理论分析也只进行热力学平衡方面的分析[3, 6],对共气化反应体系的基础理论研究尚不完善。本文将在工业操作条件下,对水煤浆与甲烷共气化体系中产物组成的分布情况和操作可行域进行研究。
共气化体系包含许多复杂反应,直接分析这些过程非常困难。但是这些过程必定受化学计量关系的约束,并遵守吸热量和放热量之间的平衡原则[7-8]。本文采用化学计量法分析水煤浆与甲烷共气化,而且为了提高分析结果的准确性,本研究特别考虑了煤中挥发组分的影响。因为挥发组分参与的化学反应对共气化体系中化学计量关系和热平衡的影响不可忽略,若简单地将煤视作固定碳来处理,则将对分析结果的准确性带来影响。其次,本研究考虑了反应物和产物的温度对热平衡的影响,反应物为常温(298 K)进料,产物出口温度为1 623 K。最后,在进行化学计量分析时,将水煤浆中的原料水作为液态水来处理。
2 共气化体系中非负基本反应的确定 2.1 煤的元素组成分析和热力学分析煤是由种类繁多的有机物组成,但除微量元素外,主要的元素为C、H、O 3大类。而气化的主产物CO,CO2和H2也是由这3类元素构成。因此借鉴集总合并同类项的基本思路,只需引入一个能反映煤的元素组成的分子式而不必去考虑其复杂的组成,这样可使图解法方便应用,使复杂研究得以简化。
基于以上考虑,本文用一个能反映可燃组分元素组成的基本分子式CHmOn,来表示煤中的挥发组分和固定碳,m和n的值可以根据煤的元素分析来确定。表 1为用于化学计量分析的神府煤在空气干燥基下的元素分析结果。
|
|
表 1 神府煤的元素分析 Table 1 Elemental analysis of Shenfu coal |
表 1中wB为煤中可燃组分中各元素的质量分数,将其换算为元素的摩尔分数后可得m和n的值分别为0.765和0.116。因此,本文用分子式CH0.765O0.116来表示煤。
煤的热力学分析主要用于计算煤在共气化过程中的热效应。一般情况下,对于化学反应式
| ${\alpha _1}{A_1}({T_1}) + {\alpha _2}{A_2}({T_1}) + {\alpha _3}{A_3}({T_1}) + \cdots \to {\beta _1}{B_1}({T_2}) + {\beta _2}{B_2}({T_2}) + {\beta _2}{B_2}({T_2}) + \cdots $ | (1) |
其反应热可用式
| $\Delta H = \sum {{\beta _i}{\Delta _{f, {B_i}}}} H_{\text{m}}^\theta (298{\rm{K}}) - \sum {{\alpha _i}} {\Delta _{f, {A_i}}}H_{\text{m}}^\theta (298{\rm{K}}) + \sum {{\alpha _i}\int_{298{\text{K}}}^{{T_1}} {{C_{p, {A_i}}}} } {\text{d}}T + \sum {{\beta _i}\int_{298{\text{K}}}^{{T_2}} {{C_{p, {B_i}}}} } {\text{d}}T$ | (2) |
获得。要用式(2)来计算煤参与反应的反应热,必须知道煤对应的
| ${\Delta _{f, {\text{C}}{{\text{H}}_m}{{\text{O}}_n}}}H_{\text{m}}^\theta \left( {{{298}_{}}{\text{K}}} \right) = {\Delta _{f, {\text{C}}{{\text{O}}_2}}}H_{\text{m}}^\theta \left( {{{298}_{}}{\text{K}}} \right) + \frac{m}{2} \cdot {\Delta _{f, {{\text{H}}_2}{\text{O}}\left( l \right)}}H_{\text{m}}^\theta \left( {{{298}_{}}{\text{K}}} \right) + \frac{{{Q_{{\text{b, ad}}}}\left( {12 + m + 16n} \right)}}{{{1_{}}000\left( {w{\text{(F}}{{\text{C}}_{{{\text{ad}}}}}) + w({{\text{V}}_{{\text{ad}}}})} \right)}}$ | (3) |
根据表 2中的数据,在式(3)中代入CO2和H2O(l)的标准摩尔生成焓,可得
|
|
表 2 神府煤的工业分析和弹筒发热量 Table 2 Proximate analysis and heating quantity of bomb cylinder of Shenfu coal |
以水煤浆与甲烷共气化的原料主要成分为煤、甲烷、水和氧气,产物为CO2、CO和H2,所以体系的总变化必然是CH0.765O0.116、O2、H2O及CH4的消失和CO2、CO及H2的生成。为了能够将共气化体系中反应物消失、产物生成这一总变化用一组反应的非负线性组合来表示,引入以下8个非负基本反应:
| ${r_1}:{\rm{C}}{{\rm{H}}_{{\rm{0}}{\rm{.765}}}}{{\rm{O}}_{{\rm{0}}{\rm{.116}}}}{\rm{(s, 29}}{{\rm{8}}_{}}{\rm{K) + 0}}{\rm{.442}}{{\rm{O}}_{\rm{2}}}{\rm{(g, 29}}{{\rm{8}}_{}}{\rm{K)}} \to {\rm{CO(g, }}{{\rm{1}}_{}}{\rm{62}}{{\rm{3}}_{}}{\rm{K) + }}{{\rm{H}}_{\rm{2}}}{\rm{(g, }}{{\rm{1}}_{}}{\rm{62}}{{\rm{3}}_{}}{\rm{K)}}, \\{{\rm{\Delta }}_{\rm{1}}}H = - {8.8_{}}{\rm{kJ}} \cdot {\rm{mo}}{{\rm{l}}^{ - {\rm{1}}}}$ | (4) |
| ${r_2}:{\rm{C}}{{\rm{H}}_{{\rm{0}}{\rm{.765}}}}{{\rm{O}}_{{\rm{0}}{\rm{.116}}}}{\rm{(s, 29}}{{\rm{8}}_{}}{\rm{K) + 0}}{\rm{.942}}{{\rm{O}}_{\rm{2}}}{\rm{(g, 29}}{{\rm{8}}_{}}{\rm{K)}} \to {\rm{C}}{{\rm{O}}_{\rm{2}}}{\rm{(g, }}{{\rm{1}}_{}}{\rm{62}}{{\rm{3}}_{}}{\rm{K) + 0}}{\rm{.38}}{{\rm{2}}_{}}{\rm{5}}{{\rm{H}}_{\rm{2}}}{\rm{(g, }}{{\rm{1}}_{}}{\rm{62}}{{\rm{3}}_{}}{\rm{K)}},\\ {{\rm{\Delta }}_{\rm{2}}}H = {\rm{ - }}{317.49_{}}{\rm{kJ}} \cdot {\rm{mo}}{{\rm{l}}^{ - {\rm{1}}}}$ | (5) |
| ${r_3}:{\rm{C}}{{\rm{H}}_{{\rm{0}}{\rm{.765}}}}{{\rm{O}}_{{\rm{0}}{\rm{.116}}}}{\rm{(s, 29}}{{\rm{8}}_{}}{\rm{K) + 0}}{\rm{.884}}{{\rm{H}}_{\rm{2}}}{\rm{O(l, 29}}{{\rm{8}}_{}}{\rm{K)}} \to {\rm{CO(g, }}{{\rm{1}}_{}}{\rm{62}}{{\rm{3}}_{}}{\rm{K) + 1}}{\rm{.26}}{{\rm{5}}_{}}{\rm{5}}{{\rm{H}}_{\rm{2}}}{\rm{(g, }}{{\rm{1}}_{}}{\rm{62}}{{\rm{3}}_{}}{\rm{K), }}\\{{\rm{\Delta }}_{\rm{3}}}H{\rm{ = + 135}}{\rm{.8}}{{\rm{7}}_{}}{\rm{kJ}} \cdot {\rm{mo}}{{\rm{l}}^{ - {\rm{1}}}}$ | (6) |
| ${r_4}:{\rm{C}}{{\rm{H}}_{{\rm{0}}{\rm{.765}}}}{{\rm{O}}_{{\rm{0}}{\rm{.116}}}}{\rm{(s, 29}}{{\rm{8}}_{}}{\rm{K) + 1}}{\rm{.884}}{{\rm{H}}_{\rm{2}}}{\rm{O(l, 29}}{{\rm{8}}_{}}{\rm{K)}} \to {\rm{C}}{{\rm{O}}_{\rm{2}}}{\rm{(g, }}{{\rm{1}}_{}}{\rm{62}}{{\rm{3}}_{}}{\rm{K) + 2}}{\rm{.26}}{{\rm{5}}_{}}{\rm{5}}{{\rm{H}}_{\rm{2}}}{\rm{(g, }}{{\rm{1}}_{}}{\rm{62}}{{\rm{3}}_{}}{\rm{K), }}\\{{\rm{\Delta }}_4}H{\rm{ = + 484}}{\rm{.8}}{{\rm{7}}_{}}{\rm{kJ}} \cdot {\rm{mo}}{{\rm{l}}^{ - {\rm{1}}}}$ | (7) |
| ${r_5}:{\rm{C}}{{\rm{H}}_{\rm{4}}}{\rm{(g, 29}}{{\rm{8}}_{}}{\rm{K) + 0}}{\rm{.5}}{{\rm{O}}_{\rm{2}}}{\rm{(g, 29}}{{\rm{8}}_{}}{\rm{K)}} \to {\rm{CO(g, }}{{\rm{1}}_{}}{\rm{62}}{{\rm{3}}_{}}{\rm{K) + 2}}{{\rm{H}}_{\rm{2}}}{\rm{(g, }}{{\rm{1}}_{}}{\rm{62}}{{\rm{3}}_{}}{\rm{K), }}{{\rm{\Delta }}_{\rm{5}}}H{\rm{ = 88}}{\rm{.15}}{{\rm{8}}_{}}{{\rm{3}}_{}}{\rm{kJ}} \cdot {\rm{mo}}{{\rm{l}}^{ - {\rm{1}}}}$ | (8) |
| ${r_6}:{\rm{C}}{{\rm{H}}_{\rm{4}}}{\rm{(g, 29}}{{\rm{8}}_{}}{\rm{K) + }}{{\rm{O}}_{\rm{2}}}{\rm{(g, 29}}{{\rm{8}}_{}}{\rm{K)}} \to {\rm{C}}{{\rm{O}}_2}{\rm{(g, }}{{\rm{1}}_{}}{\rm{62}}{{\rm{3}}_{}}{\rm{K) + 2}}{{\rm{H}}_{\rm{2}}}{\rm{(g, }}{{\rm{1}}_{}}{\rm{62}}{{\rm{3}}_{}}{\rm{K), }}{{\rm{\Delta }}_6}H{\rm{ = }} - 169.{\rm{13}}{{\rm{4}}_{}}{\rm{kJ}} \cdot {\rm{mo}}{{\rm{l}}^{ - {\rm{1}}}}$ | (9) |
| ${r_7}:{\rm{C}}{{\rm{H}}_{\rm{4}}}{\rm{(g, 29}}{{\rm{8}}_{}}{\rm{K) + }}{{\rm{H}}_{\rm{2}}}{\rm{O(l}}{\rm{298}}{}_{}{\rm{K)}} \to {\rm{CO(g, }}{{\rm{1}}_{}}{\rm{62}}{{\rm{3}}_{}}{\rm{K) + 3}}{{\rm{H}}_{\rm{2}}}{\rm{(g, }}{{\rm{1}}_{}}{\rm{62}}{{\rm{3}}_{}}{\rm{K), }}{{\rm{\Delta }}_7}H{\rm{ = + }}{411.08_{}}{\rm{kJ}} \cdot {\rm{mo}}{{\rm{l}}^{ - {\rm{1}}}}$ | (10) |
| $ {r_8}:{\rm{C}}{{\rm{H}}_{\rm{4}}}{\rm{(29}}{{\rm{8}}_{}}{\rm{K) + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O(l}}{\rm{29}}{{\rm{8}}_{}}{\rm{K)}} \to {\rm{C}}{{\rm{O}}_{\rm{2}}}{\rm{(g, }}{{\rm{1}}_{}}{\rm{62}}{{\rm{3}}_{}}{\rm{K) + 4}}{{\rm{H}}_{\rm{2}}}{\rm{(g, }}{{\rm{1}}_{}}{\rm{62}}{{\rm{3}}_{}}{\rm{K), }}{{\rm{\Delta }}_8}H{\rm{ = + }}{476.70_{}}{\rm{kJ}} \cdot {\rm{mo}}{{\rm{l}}^{ - {\rm{1}}}} $ | (11) |
现以反应r1和r2为例来说明非负基本反应的选取原则。在不生成H2O的情况下,r1可以看作CH0.765O0.116与O2之间反应的最小程度,r2则可以看作CH0.765O0.116与O2之间反应的最大程度。气化过程中,CH0.765O0.116与O2的反应总会介于最大、最小程度之间,因此所有发生在CH0.765O0.116与O2之间的总反应都可以用r1与r2的非负线性组合来表示。同理r3和r4的非负线性组合可以表示所有发生在CH0.765O0.116和H2O之间的总反应,r5和r6的非负线性组合可以表示所有发生在CH4和O2之间的总反应,r7和r8的非负线性组合可以表示所有发生在CH4和H2O之间的总反应。水煤浆与甲烷共气化是发生在CH0.765O0.116、CH4、O2和H2O之间的总反应,因此水煤浆与甲烷共气化过程中发生的任何变化都可由r1~r8这8个非负基本反应的非负线性组合表示。
8个非负基本反应的反应物消耗关系绘于图 1中,图 1中CH0.765O0.116、CH4、O2和H2O对应的四面体顶点分别表示其对应的纯组分,例如CH4对应的顶点表示纯的CH4进料。r1~r8这8个点分别代表 8个反应的反应物计量系数比,例如图 1中的点r5代表反应r5的反应物CH4与O2摩尔比为2:1。
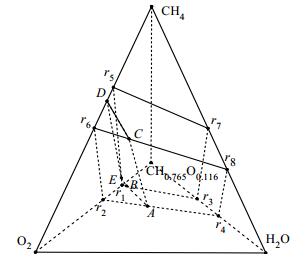
|
图 1 非负基本反应、反应物消耗关系、无过剩组分可行域和热平衡面 Fig.1 Schematic diagram of non-negative basic reactions, reactant consumption relationships, no-surplus-component viable regions and heat balance surface |
图 1中六面立体r1r2r4r3-r5r6r8r7为无过剩组分时的可行域,在无过剩组分可行域以外,靠近CH4和CH0.765O0.116的立体区域r5r7CH4-r1r3 CH0.765O0.116表示CH4和CH0.765O0.116过剩区,靠近O2和H2O的立体区域r2r6O2-r4r8H2O表示O2和H2O过剩区。
共气化过程中产物分布关系可用图 2中的三棱柱来表示,图 2所示棱柱的上底面对应进料仅为CH4、O2和H2O的甲烷转化体系的产物分布,下底面对应进料为CH0.765O0.116、O2和H2O的水煤浆气化体系的产物分布。与图 1相类似地,图 2中 r1~r8这8个点分别代表 8个反应的产物组成,例如图 2中的点r5代表反应r5的反应物H2与CO摩尔比为2:1。图 2中六面立体r1r2r4r3-r5r6r8r7为无过剩组分时的产物分布区。
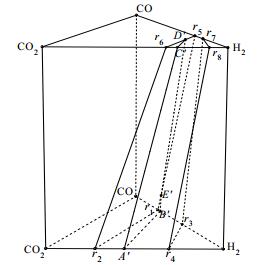
|
图 2 非负基本反应、产物分布和热平衡面 Fig.2 Schematic diagram of non-negative basic reactions, product distribution and heat balance surface |
如果反应器绝热操作,那么共气化反应体系中吸热反应吸收的热量和放热反应放出的热量必然相互平衡。水煤浆与甲烷共气化反应体系的热平衡关系可以用图 1中的阴影面ABEDC来表示。其中点A表示放热反应r2和吸热反应r4的热平衡进料组成,A点可以利用杠杆规则来确定:
| $\overline {{r_2}A} :\overline {A{r_4}} = \left| {{\Delta _4}H} \right|:\left| {{\Delta _2}H} \right|$ | (12) |
同理,图 1中的点B、E、D、C分别对应反应r1和r3、反应r1和r5、反应r5和r6、反应r6和r8之间满足热平衡关系的进料组成。4条线段AB、ED、DC和CA则分别表示4个四边形区域r1-r2-r4-r3、r1-r2-r6-r5、r5-r6-r8-r7和r2-r4-r8-r6内的热平衡线。在图 1中,由线段AB、BE、ED、DC和CA所围成的面ABEDC即为共气化体系的热平衡面。在图 1中的无过剩组分可行域内,位于热平衡面左侧的区域内组分的放热反应放出的热量大于吸热反应吸收的热量,该区域为过热区。热平衡面ABEDC右侧的无过剩组分可行域为过冷区。
与图 1相对应地,图 2中的点A’、B’、C’、D’和E’分别对应反应r1和r3、反应r1和r5、反应r5和r6、反应r6和r8之间满足热平衡关系的产物组成,由热平衡线A’B’、B’E’、E’D’、D’C’和C’A’所围成的面A’B’E’D’C’为产物分布的热平衡面。
4 热平衡区图 1所示的热平衡面不是一个平面,如果用一个虚拟的物质X来代替气化原料CH0.765O0.116和CH4,那么图 1的四面体图就可以转化为三角型图(图 3),图 1中的热平衡面就可以转化为图 3中的热平衡区,方便分析。CH0.765O0.116、CH4和物质X的关系为:
| $ {\text{X = }}\left( {1 - \delta } \right){\text{C}}{{\text{H}}_{0.765}}{{\text{O}}_{0.116}}{\text{ + }}\delta {\text{C}}{{\text{H}}_{\text{4}}}{\text{ }}~~~~0≤\delta≤1 $ | (13) |
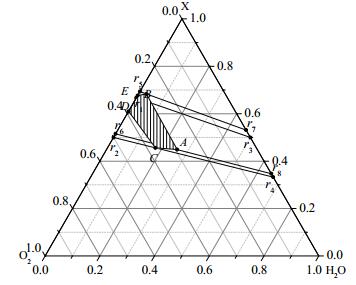
|
图 3 共气化过程中的产物组成分布和热平衡区 Fig.3 Product distribution and heat balance area during co-gasification processes |
本文中将δ定义为共气化因子,可以看出,共气化因子的值会影响气化原料的组成。如果δ=1,说明气化原料为甲烷,体系为甲烷转化制合成气;如果δ=0,则为水煤浆气化;如果
| $ {r_9}:{\rm{X}} + \left( {{\rm{0}}{\rm{.442 + 0}}{\rm{.058}}\delta } \right){{\rm{O}}_{\rm{2}}} \to {\rm{CO}} + \left( {{\rm{0}}{\rm{.382 5 + 1}}{\rm{.617 5}}\delta } \right){{\rm{H}}_{\rm{2}}},{\Delta _9}H = - 8.80{\rm{ + }}96.96\delta $ | (14) |
| ${r_{10}}:{\rm{X}} + \left( {{\rm{0}}{\rm{.942 + 0}}{\rm{.058}}\delta } \right){{\rm{O}}_{\rm{2}}} \to {\rm{C}}{{\rm{O}}_2} + \left( {{\rm{0}}{\rm{.382 5 + 1}}{\rm{.617 5}}\delta } \right){{\rm{H}}_{\rm{2}}},{\Delta _{10}}H = ( - 317.49{\rm{ + }}148.36)\delta $ | (15) |
| $ {r_{11}}:{\rm{X}} + \left( {0.844 + 0.116\delta } \right){{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{CO}} + \left( {{{1.265}_{}}5 + {{1.734}_{}}5\delta } \right){{\rm{H}}_{\rm{2}}},{\Delta _{11}}H = 135.87{\rm{ + }}275.21\delta $ | (16) |
| $ {r_{12}}:{\rm{X}} + \left( {1.844 + 0.116\delta } \right){{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{C}}{{\rm{O}}_{\rm{2}}} + \left( {{{2.265}_{}}5 + {{1.734}_{}}5\delta } \right){{\rm{H}}_{\rm{2}}},{\Delta _{12}}H = 484.87 - 8.17\delta $ | (17) |
不难看出,
| $ {r_9}{\rm{ = }}\left( {1 - \delta } \right){r_1} + \delta {r_5} $ | (18) |
| $ {r_{10}}{\rm{ = }}\left( {1 - \delta } \right){r_2} + \delta {r_6} $ | (19) |
| $ {r_{10}}{\rm{ = }}\left( {1 - \delta } \right){r_2} + \delta {r_6} $ | (20) |
| $ {r_{12}}{\rm{ = }}\left( {1 - \delta } \right){r_4} + \delta {r_8} $ | (21) |
因此r9、r10、r11和r12也可以作为体系的非负基本反应。共气化过程中发生的任何化学反应都可由这4个反应的线性组合表示。图 3为转化后共气化体系的反应物消耗关系图,AB为δ=0时的热平衡线,CD为δ=1时的热平衡线,由于共气化为混合进料,所以共气化反应的热平衡将落在区域ABEDC内。
类似地,反应产物分布可表示在图 4所示的以CO2、CO和H2为顶点的三角形图中,与图 3相对应的A’B’为δ=0时的热平衡线,C’D’为δ=1时的热平衡线。当确定点A’、B’、C’和D’的坐标后,可以利用两点式导出2条热平衡线方程分别为
| $ A'B':{x_{{{\rm{H}}_{\rm{2}}}}} = 0.410{x_{{\rm{CO}}}} + 0.783{x_{{\rm{C}}{{\rm{O}}_{\rm{2}}}}}{\rm{或}}\frac{{{x_{{{\rm{H}}_{\rm{2}}}}}}}{{{x_{{\rm{CO}}}}}}{\rm{ = 0}}{\rm{.410 + 0}}{\rm{.783}}\left( {\frac{{{x_{{\rm{C}}{{\rm{O}}_{\rm{2}}}}}}}{{{x_{{\rm{CO}}}}}}} \right) $ | (22) |
| $ C'D':{x_{{{\rm{H}}_{\rm{2}}}}} = 1.819{x_{{\rm{CO}}}} + 2.356{x_{{\rm{C}}{{\rm{O}}_{\rm{2}}}}}{\rm{或}}\frac{{{x_{{{\rm{H}}_{\rm{2}}}}}}}{{{x_{{\rm{CO}}}}}}{\rm{ = }}1.819{\rm{ + }}2.356\left( {\frac{{{x_{{\rm{C}}{{\rm{O}}_{\rm{2}}}}}}}{{{x_{{\rm{CO}}}}}}} \right) $ | (23) |
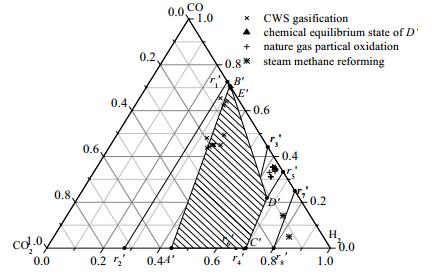
|
图 4 共气化过程中的产物组成分布和热平衡区 Fig.4 Product distribution and heat balance area during co-gasification processes |
由式(22)可以看出,水煤浆气化体系中产物的氢碳比大于0.410,由式(23)可以看出,甲烷转化制合成气体系中,产物中的H2/CO(氢碳比)必然大于1.819。如果认为共气化产物仅包含CO2、CO和H2这3种物质,则必有:
| $ {x_{{{\rm{H}}_{\rm{2}}}}} + {x_{{\rm{CO}}}} + {x_{{\rm{C}}{{\rm{O}}_{\rm{2}}}}}{\rm{ = }}1 $ | (24) |
联立式(22)和式(24)可得:
| $ {x_{{{\rm{H}}_{\rm{2}}}}}{\rm{ = }}0.439 - 0.209{x_{{\rm{CO}}}}{\rm{ = }}0.291 + 0.265{x_{{\rm{C}}{{\rm{O}}_{\rm{2}}}}} $ | (25) |
根据式(25)可以看出,煤气化体系的产物中,H2的摩尔分数最高为43.9% (
| $ {x_{{{\rm{H}}_{\rm{2}}}}}{\rm{ = }}0.702 - 0.160{x_{{\rm{CO}}}}{\rm{ = }}0.645 + 0.190{x_{{\rm{C}}{{\rm{O}}_{\rm{2}}}}} $ | (26) |
根据式(26),甲烷转化制合成气的产物中,H2的摩尔分数最高为70.2% (xCO为零, 对应于图 4中的C’点),最低为66.7%(
为验证此化学计量分析方法的准确性,将在文献中搜集到的工业和中试等实际操作条件下的水煤浆气化[1, 9-16]、甲烷非催化部分氧化[17-21]和甲烷蒸汽重整[15, 22]工艺的产物分布绘于图 4中。可以看出,水煤浆气化工艺的产物分布靠近热平衡线A’B’,而甲烷非催化部分氧化和甲烷蒸汽重整工艺的产物分布偏离了热平衡线C’D’。甲烷非催化部分氧化制合成气工艺的主要反应物只有O2和CH4,如果不生成H2O,则发生在O2和CH4之间的所有反应的产物分布都将落在图 4中的线段r5’r6'上,而满足热平衡关系的状态只有图 4中的点D’。事实上,非催化部分氧化过程中是有H2O生成的,把利用Gibbs自由能最小化原理求得的点D’在绝热状态下的化学平衡状态绘于图 4中后,发现所有实际操作情况下的甲烷非催化部分氧化后的产物均靠近该化学平衡点。甲烷蒸汽重整工艺主要反应物只有CH4和H2O,该体系内不存在供热的反应,因此,该体系的产物分布线段r7’r8'落了在热平衡区外右下方的过冷区内。但是甲烷重整的产物分布仍要受化学计量关系的约束,实际工况下的产物分布都落在线段r7’r8'附近。由此可以看出,用化学计量法分析共气化的结果是可信的。
水煤浆与伴生气共气化工艺是甲烷转化制合成气与煤气化的耦合,共气化反应的热平衡区将落在图 4中的区域A’B’E’D’C’内。
为适应下游生产的需要,希望共气化产物的氢碳比能在1~2之间实现可调。如图 5所示,在热平衡图中作出氢碳比为1和氢碳比为2的线,交A’B’于M1、N1两点,交B’D’于M2、Q两点,四边形区域M1M2QN1即为氢碳比合适的热平衡区。从图 5中可以看出,在热平衡区域内,在氢碳比相同的情况下,随着δ的增加,CO2的含量降低;当δ值一定时,随着氢碳比的增加,CO2的含量升高。在保证氢碳比在1~2的情况下,为了将CO2的含量降到最低,产物分布要沿着线M2Q变化,M2所在的热平衡线M2L对应δ=0.518,Q所在的热平衡线QP对应δ=0.844,即当δ在0.518~0.844之间调节时,可以实现氢碳比在1~2且CO2的含量最低。在δ≤0.518时,共气化体系能实现固定δ值的情况下氢碳比在1~2的连续可调。
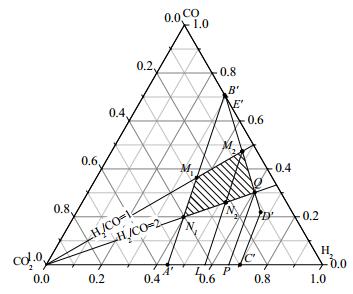
|
图 5 H2/CO在1~2之间的热平衡区 Fig.5 Heat balance areas with H2/CO ratio of 1 ~ 2 |
在工业生产过程中,设备内传热传质速率对化学反应速率是有影响的,从而有可能会导致气化原料的不完全转化。除此之外,煤的结构复杂,在气化过程中会有除合成气之外的的有机副产物生成。因此本文分析的结论可以作为气化原料百分之百转化为合成气的极限状态来考虑。
5 结论(1) 利用化学计量关系和热量守恒这两个约束条件,水煤浆与伴生气制备合成气的复杂的反应历程最终可以被简化在三角形图中来分析。
(2) 与水煤浆气化体系相比,水煤浆与伴生气气化工艺相耦合能够降低产物中废气CO2的含量,提高合成气的产量。
(3) 当共气化因子小于0.844时,共气化过程能实现合成气产品的氢碳比在1~2之间连续可调。
符号说明:
|
|
| [1] |
王辅臣, 于广锁, 龚欣, 等. 大型煤气化技术的研究与发展[J]. 化工进展, 2009, 28(2): 173-180. WANG F C, YU G S, GONG X, et al. Research and development of large-scale coal gasification technology[J]. Chemical Industry and Engineering Progress, 2009, 28(2): 173-180. DOI:10.3321/j.issn:1000-6613.2009.02.001 |
| [2] |
徐占林, 毕颖丽, 甄开吉. 甲烷催化二氧化碳重制合成气反应研究进展[J]. 化学进展, 2000, 12(2): 121-130. XU Z L, BI Y L, ZHEN K J. Progress in studies of CO2-reforming of methane to synthesis gas[J]. Progress in Chemistry, 2000, 12(2): 121-130. DOI:10.3321/j.issn:1005-281X.2000.02.001 |
| [3] |
宋学平, 郭占成. 移动床煤与天然气共气化制备合成气的工艺技术[J]. 化工学报, 2005, 56(2): 312-317. SONG X P, GUO Z C. Research on moving bed to prepare synthesis gas co-gasification of coal and natural gas[J]. Journal of Chemical Industry and Engineering, 2005, 56(2): 312-317. DOI:10.3321/j.issn:0438-1157.2005.02.025 |
| [4] |
欧阳朝斌, 段东平, 郭占成, 等. 天然气-煤共气化制备合成气热态模拟[J]. 化工学报, 2005, 56(10): 1936-1941. OUYANG Z B, DUAN D P, GUO Z C, et al. Natural gas & coal co-gasification to produce synthesis gas in hot simulation[J]. Journal of Chemical Industry and Engineering, 2005, 56(10): 1936-1941. DOI:10.3321/j.issn:0438-1157.2005.10.023 |
| [5] |
欧阳朝斌, 郭占成, 段东平, 等. 煤种对煤与天然气共气化过程的影响[J]. 过程工程学报, 2006, 6(5): 773-776. OUYANG Z B, GUO Z C, DUAN D P, et al. Effect of coal type on coal and natural gas co-gasifying process[J]. The Chinese Journal of Process Engineering, 2006, 6(5): 773-776. DOI:10.3321/j.issn:1009-606X.2006.05.016 |
| [6] |
李俊岭, 赵月红, 温浩, 等. 天然气和煤联合制备廉价合成气新工艺及其热力学分析[J]. 计算机与应用化学, 2002, 19(4): 381-384. LI J L, ZHAO Y H, WEN H, et al. A new preparation process of low- cost synthesis gas from natural gas and coal and its thermodynamic analysis[J]. Computers and Applied Chemistry, 2002, 19(4): 381-384. DOI:10.3969/j.issn.1001-4160.2002.04.001 |
| [7] |
朱开宏, 袁渭康. 化学反应工程分析[M]. 北京: 高等教育出版社, 2002. ZHU K H, YUAN W K. Analysis of Chemical Reaction Engineering[M]. Beijing: Higher Education Press, 2002. |
| [8] |
WEI J. A Stoichiometric Analysis of Coal Gasification[J]. Industrial & Engineering Chemistry Process Design and Development, 1979, 18(3). |
| [9] |
王旭宾. 德士古煤气化工艺烧嘴的探讨[J]. 上海化工, 2000(11): 15-18. WANG X B. Burner study for texaco coal gasification process[J]. Shanghai Chemical Industry, 2000(11): 15-18. |
| [10] |
彭伟锋, 钟伟民, 孔祥东, 等. 德士古水煤浆气化过程的建模与优化分析[J]. 计算机与应用化学, 2012, 29(7): 779-783. PENG W F, ZHONG W M, KONG X D, et al. Modeling and optimization of texaco coal-water slurry gasification process[J]. Computers and Applied Chemistry, 2012, 29(7): 779-783. DOI:10.3969/j.issn.1001-4160.2012.07.003 |
| [11] |
李伟锋, 于广锁, 龚欣, 等. 多喷嘴对置式煤气化技术[J]. 氮肥技术, 2008, 29(6): 1-5. LI W F, YU G S, GONG X, et al. Multi-nozzle opposed coal gasification technology ()[J]. Nitrogenous Fertilizer Technology, 2008, 29(6): 1-5. |
| [12] |
吴玉新, 张建胜, 王明敏, 等. 简化PDF模型对Texaco气化炉的三维数值模拟[J]. 化工学报, 2007, 58(9): 2369-2374. WU Y X, ZHANG J S, WANG M M, et al. 3D numerical simulation of Texaco gasifier using assumed PDF mode[J]. Journal of Chemical Industry and Engineering, 2007, 58(9): 2369-2374. DOI:10.3321/j.issn:0438-1157.2007.09.036 |
| [13] |
范玮. 气流床气化工艺水煤浆和煤粉两种进料方式比较[J]. 洁净煤技术, 2013, 19(3): 65-67. FAN W. Comparison of coal water slurry and coal dust feeding methods of entrained flow gasification technology[J]. Clean Coal Technology, 2013, 19(3): 65-67. |
| [14] |
于海龙.新型水煤浆气化喷嘴和气化炉的开发以及气化过程数值模拟[D].杭州: 浙江大学, 2004. YU H L. Development of a new coal water slurry gasification nozzle and gasifier and numerical simulation of gasification process[D]. Hangzhou: Zhejiang University, 2004. http://cdmd.cnki.com.cn/Article/CDMD-10335-2005030668.htm |
| [15] |
ZHENG X, SU Q, MI W, et al. Effect of steam reforming on methane-fueled chemical looping combustion with Cu-based oxygen carrier[J]. International Journal of Hydrogen Energy, 2014, 39(17): 9158-9168. DOI:10.1016/j.ijhydene.2014.03.245 |
| [16] |
李超, 代正华, 孙钟华, 等. 气流床气化炉综合模型及颗粒粒径对气化结果的影响研究[J]. 高校化学工程学报, 2013, 27(4): 597-603. LI C, DAI Z H, SUN Z H, et al. Development of a Comprehensive Model of Entrained Flow Coal Gasifier and Study of Effects of Particle Diameter on Gasification Results[J]. Journal of Chemical Engineering of Chinese Universities, 2013, 27(4): 597-603. DOI:10.3969/j.issn.1003-9015.2013.04.009 |
| [17] |
曾树彦. 天然气非催化部分氧化喷嘴的设计[J]. 中氮肥, 2004(5): 37-38. ZENG S Y. Nozzle design for non-catalytic partial oxidation of natural gas[J]. M-Sized Nitrogenous Fertilizer Progress, 2004(5): 37-38. DOI:10.3969/j.issn.1004-9932.2004.05.017 |
| [18] |
王辅臣, 李伟锋, 代正华, 等. 天然气非催化部分氧化制合成气过程的研究[J]. 石油化工, 2006, 35(1): 47-51. WANG F C, LI W F, DAI Z H, et al. Preparation of syngas from natural gas by non-catalytic partial oxidation[J]. Petrochemical Technology, 2006, 35(1): 47-51. |
| [19] |
XU Y, DAI Z, LI C, et al. Numerical simulation of natural gas non-catalytic partial oxidation reformer[J]. International Journal of Hydrogen Energy, 2014, 39(17): 9149-9157. DOI:10.1016/j.ijhydene.2014.03.204 |
| [20] |
RICHTER A, SEIFERT P, COMPART F, et al. A large-scale benchmark for the CFD modeling of non-catalytic reforming of natural gas based on the Freiberg test plant HP POX[J]. Fuel, 2015, 152: 110-121. DOI:10.1016/j.fuel.2014.12.004 |
| [21] |
徐月亭, 代正华, 李超, 等. 天然气非催化部分氧化转化炉模拟[J]. 高校化学工程学报, 2014, 28(6): 1249-1254. XU Y T, DAI Z H, Li C, et al. Simulations studies on non-catalytic partial oxidation reformer for natural gas[J]. Journal of Chemical Engineering of Chinese Universities, 2014, 28(6): 1249-1254. DOI:10.3969/j.issn.1003-9015.2014.06.011 |
| [22] |
SPATH P L, MANN M K. Life cycle assessment of hydrogen production via natural gas steam reforming[R]. [S.l.]: N.P. 2000.
|




