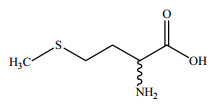
甲硫氨酸,又名甲硫基丁氨酸(俗名蛋氨酸,CAS:59-51-8),分子式C5H11O2NS,分子量149.21。外观为白色薄片状结晶或结晶性粉末,有特殊气味,味微甜,溶于水、稀酸和稀碱,易溶于95%乙醇,极难溶于无水乙醇,几乎不溶于乙醚,其结构式如图 1所示。
|
图 1 甲硫氨酸的分子结构式 Fig.1 Molecular structure of methionine |
甲硫氨酸是构成人体的必需氨基酸之一,参与蛋白质合成。因其不能在体内自身生成,所以必须由外部获得。如果人体中缺乏甲硫氨酸就会导致体内蛋白质合成受阻,造成机体损害。甲硫氨酸在食品、医药以及饲料添加剂方面有广泛应用,工业上主要是通过化学法合成DL-型混旋甲硫氨酸,但仍存在着环境污染、分离纯化困难等诸多问题。为了指导甲硫氨酸的工艺开发、工程设计以及工业化生产,弥补文献报道对其热分解机理及动力学规律的缺失,本文对其物性数据进行补充。
TG-DTA热分析是在程序控制温度下测量物质的物理性质与温度变化关系的一类技术[1]。热分析技术能快速准确地测定物质的晶型转变、熔融、升华、吸附、脱水、分解等变化,能对无机、有机及高分子材料的理化性能进行实时实验测定[1-4]。近年来,热分析研究最活跃的领域是热分析动力学研究[1-2, 4-5]。本文采用热重分析法(TG),通过考察甲硫氨酸在程序升温过程中的TG-DTA曲线[6],研究甲硫氨酸热分解过程,并根据Flynn-Wall-Ozawa积分法、Kissinger最大速率法和Šatava-Šesták积分法[7-8]求出热分解反应动力学参数,进而推导可能的热分解反应机理模型,得到热分解反应的动力学方程。
2 实验部分 2.1 实验仪器与试剂DSC-60差示扫描量热仪和DTG-60热重-差热联用分析仪, 日本岛津公司;SPN-500型氮气发生器,北京中惠普分析技术研究所。DL-甲硫氨酸,分析纯,国药集团化学试剂有限公司;α-Al2O3,TGA标准物质,日本岛津公司。
2.2 实验条件程序升温速率分别控制为5、10、15、20、25℃·min-1;用DTG-60型热分析仪(微量天平精度0.1 μg),称样为(2.5±0.5) mg,在氮气流量为30 mL·min-1的气氛中以一定的升温速率从室温升温至673.15 K,用氧化铝(α-Al2O3)作参比物,测定样品的(TG-DTA)曲线。
2.3 理论分析根据非等温动力学理论[9-14]并结合Arrhenius方程[9~11],固体物质热分解动力学方程可写为:
| $ \frac{{{\rm{d}}a}}{{{\rm{d}}t}} = \beta \frac{{{\rm{d}}T}}{{{\rm{d}}t}} = A{{\rm{e}}^{ - \frac{E}{{RT}}}}f(a)\;\;\;{\rm{or}}\;\;\;\frac{{{\rm{d}}a}}{{{\rm{d}}T}} = \frac{A}{\beta }{{\rm{e}}^{ - \frac{E}{{RT}}}}f(a) $ | (1) |
式中:β是升温速率,K·min-1;T为热力学温度,K;t为反应时间,s;A为指前因子,min-1;E为活化能,kJ·mol-1;R为通用摩尔气体常数,8.314 J·mol-1·K-1;f(α)为动力学函数模型;α为失重率,它的定义式书写为:α = (m0-mt)/(m0-mf),其中m0、mt、mf分别为反应起始、终止和时间t时的样品质量,mg。
式(1)通常为固体物质热分解动力学分析的基础,在实际分析过程中,采用的数学处理方法不同,其热分解动力学的计算方法也不同。本研究用Flynn-Wall-Ozawa (F-W-O)、Kissinger和Šatava-Šesták (S-S)法来探讨甲硫氨酸的热分解动力学,求出“动力学三因子”,即E、A和f(α)[4, 8]。
2.3.1 Flynn-Wall-Ozawa (FWO)方法FWO是一种常用的等转化率线性积分法[9, 15],如式(2)所示[4, 16]。
| $ {\rm{lg}}\beta = {\rm{lg}}\left( {\frac{{AE}}{{Rg(a)}}} \right) - 2.315 - 0.4567(\frac{E}{{RT}}) $ | (2) |
式中的g(α)为30种机理函数的积分形式[16],见表 1。考虑到固体物质在TG分析过程中,尽管加热速度不同,但在一定的时间间隔内,α一定时,lgβ与1/T呈线性关系,根据斜率可求出不同α的活化能Eo。FWO法避开了反应机理函数的选择,可直接求出E值;不需要预知反应机理,可避免不同反应机理带来的误差,因此常被用来计算活化能值,这是FWO法的一个突出优点。值得注意的是,该方法要求E/RT值不得小于13。因此,此法可用来检验假设反应机理函数求出的活化能值。
|
|
表 1 各种机理函数的g(α)形式 Table 1 Different mechanism functions of g(α) |
Kissinger法,可用式(3)来表示[4, 17-18]
| $ {\rm{ln}}\frac{{{\beta _i}}}{{T_{pi}^2}} = \left( {\frac{{{A_k}R}}{{{E_k}}}} \right) - \frac{{{E_k}}}{R}\frac{1}{{{T_{pi}}}} $ | (3) |
式中Tpi表示当升温速率为βi (i=1, 2, 3……N)时固体样品熔程的峰温。以ln(βi/Tpi2)对1/Tpi进行线性回归,可得到该直线的斜率和截距。活化能Ek可根据斜率(-Ek/R)求出,指前因子Ak可用截距ln(AkR/Ek)来求得。
2.3.3 Šatava-Šesták法S-S法适用于非等温固相热分解动力学研究,其方程可用式(4)来表示[4, 16]。
| $ {\rm{lg}}\;g\left( \alpha \right) = {\rm{lg}}\left( {\frac{{{A_s}{E_s}}}{{R\beta }}} \right) - 2.315 - 0.4567\frac{{{E_{\rm{s}}}}}{{RT}} $ | (4) |
方程式(4)中的函数g(α)取自表 1中给出的30种积分形式。对于每一个固定的βi(i = 1, 2, 3…),都要用表 1中每个机理函数g(α),通过式(4)将得出的lgg(α)对1/T作图,根据直线斜率(-0.4567Es/R)计算出Es,根据直线截距(lg(AsEs/(Rβ))-2.315)计算出lgAs。本文是用最小二乘法线性回归,得到直线方程(4)的斜率和截距,进而计算出Es和lgAs。Šatava-Šesták法由于推导严密、判断有据,因此一般认为S-S法求出的结果比较合理。
根据以上计算结果,筛选出满足条件0 < Es < 400 kJ·mol-1的Es及对应的lgAs,用筛选出的Es和FWO法计算出的Eo进行比较,找出在|(Es-Eo)/Eo| ≤ 0.22范围内的Es,再用筛选出的lgAs同Kissinger法计算出的lgAk进行比较,找出在|(lgAs-lgAk)/lgAk| ≤ 0.30范围内的lgAs,凡是符合上述所有要求的函数g(α)才有可能是热分解反应机理函数的积分式[19]。
用非等温法求得E和A后,可由方程(5)、(6)、(7)来进一步计算出热分解过程的焓变ΔH、熵变ΔS和吉布斯自由能变ΔG。
| $ A{{\rm{e}}^{( - \frac{E}{{RT}})}} = v{{\rm{e}}^{^{( - \frac{{\Delta G}}{{RT}})}}} = \frac{{kT}}{h}{{\rm{e}}^{^{( - \frac{{\Delta G}}{{RT}})}}} $ | (5) |
| $ \Delta H = E - RT $ | (6) |
| $ \Delta G = \Delta H - T\Delta S $ | (7) |
式中:v为爱因斯坦振动频率,k为玻尔兹曼常量(1.3807×10-23 J·K-1),h为普朗克常量(6.625×10-34 J·s)。
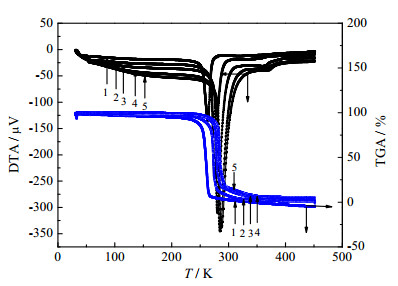
3 结果与讨论 3.1 甲硫氨酸的热分解过程图 2和表 2为甲硫氨酸在氮气气氛下,升温速率分别为5、10、15、20、25 K·min-1的一系列TG曲线,实验结果表明甲硫氨酸的失重温度区间是480~715 K,其平均失重率为96.77%,因此该过程是一个不完全热分解过程,其分解温度与文献[20]中提及的281℃基本一致。值得注意的是,该系列曲线的失重趋势以及甲硫氨酸的熔融吸热峰都随着升温速率的增加而发生了轻微的位移,这些热现象表明了甲硫氨酸的分解温度会受到升温速率β的影响。
|
图 2 不同升温速率时甲硫氨酸DTA-TGA曲线 Fig.2 DTA-TGA curves of methionine under different heating rates 1. 5 K·min-1 2. 10 K·min-1 3. 15 K·min-1 4. 20·K·min-1 5. 25·K·min-1 |
|
|
表 2 TG-DTA测定的动力学基础数据 Table 2 Fundamental kinetic data obtained from TG-DTA |
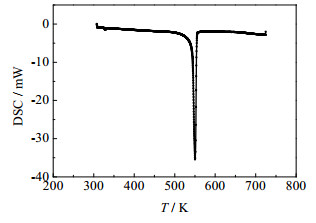
甲硫氨酸的TG-DTA曲线见图 2所示。甲硫氨酸的DTA曲线仅有一个峰,且对应TG曲线的台阶,有明显的失重现象,表明甲硫氨酸在此处有热反应发生,其分解过程中所对应的基础数据见表 2。物质的纯度、熔点和熔融焓等物性数据都可以通过DSC-60差热扫描仪得到,测定物质理化性质前要用高纯度铟对DSC-60仪器的量热计进行标定[21]。图 3是样品甲硫氨酸的DSC分析图,由图可见在277.36℃处出现了一个明显的吸热峰,这与甲硫氨酸在文献中的281℃熔点和TG-DTA结果分析基本一致。与TG-DTA分析相比较,结果表明甲硫氨酸在熔融过程中伴随着热分解反应的发生。
|
图 3 甲硫氨酸的DSC曲线 Fig.3 DSC curves of methionine |
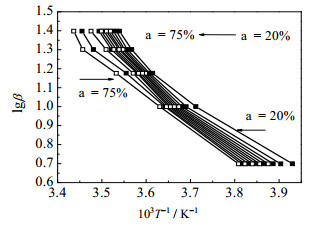
根据FWO法,以lgβ对1/T进行线性回归,如图 4所示。由直线的斜率和截距可得不同α的E0,不同α对应的E0见表 3所示。
|
图 4 不同转化率下甲硫氨酸的FWO曲线 Fig.4 FWO curves of methionine under different conversion |
|
|
表 3 FWO法计算甲硫氨酸的活化能E0 Table 3 Activation energy E0 of methionine calculated by FWO |
根据Kissinger法,如图 5所示,用最小二乘法进行线性回归得到直线的斜率和截距,由直线的斜率和截距计算得到Ek = 155.59 kJ·mol-1,lgAk = 194.06 min-1,线性回归的R2 = 0.993。
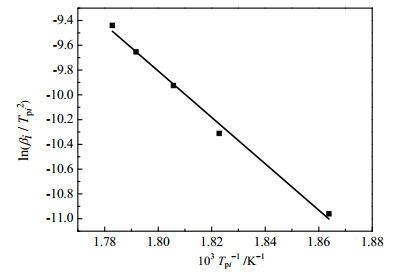
|
图 5 Kissinger法lnβi/Tpi2与1/Tpi的图 Fig.5 Plot of lnβi/Tpi2 vs. 1/Tpi obtained by Kissinger method |
根据S-S法计算所得Es和lgAs如表 4所示。其中表中符号“/”为计算过程中出现不满足基本数学条件而无法计算出最终结果的情况。
|
|
表 4 S-S法动力学方程的计算结果 Table 4 Activation energies and pre-exponential factors obtained by Šatava-Šesták method |
根据以上计算结果,将E0和Es、lgAk和lgAs分别进行比较,结果见表 5所示。因机理函数9同时符合条件|(Es-Eo)/Eo| ≤ 0.22和|(lgAs-lgAk)/lgAk| ≤ 0.30,且线性相关关系显著,所以该动力学机理为化学反应,机理函数为G(α)=-ln(1-α),相应的活化能Es和指前因子lgAs分别为1609.102 kJ·mol-1,152.332 min-1。
|
|
表 5 动力学方程筛选标准 Table 5 Selection criteria for kinetic equations G(α) = -ln(1-α) |
将采用函数序列号为9的机理函数计算得到的E和A分别代入式(6)~(8)中,在峰温(取平均温度551.59 K)处计算出热分解过程的ΔH、ΔS和ΔG,其结果分别为1604.52 kJ·mol-1,1787.7 J·mol-1·K-1和618.437 kJ·mol-1。
4 结论通过热重分析法(TA-TGA)对甲硫氨酸动态热分解过程进行分析,其分解过程伴随着吸热过程,且只存在一个热失重分解阶段,非等温热分解反应的机理为化学反应,通过Flynn–Wall–Ozawa (FWO),Kissinger和Šatava-Šesták三种方法确定其机理函数的积分形式为:G(α)=-ln(1-α),并计算得到甲硫氨酸热分解反应过程中的活化能E = 155.59 kJ·mol-1;指前因子的对数lgAk=194.06;焓变ΔH、熵变ΔS和吉布斯自由能变ΔG分别为1604.52 kJ·mol-1,1787.7 J·mol-1·K-1和618.437 kJ·mol-1。
符号说明:
| A | —指前因子,min-1 | t | —反应时间,s或min |
| E | —活化能,kJ·mol-1 | T | —热力学温度,K |
| f(α) | —动力学函数的微分形式 | v | —爱因斯坦震动频率 |
| G(α) | —动力学函数的积分形式 | α | —样品失重率 |
| G | —吉布斯自由能,kJ·mol-1 | β | —升温速率,K·min-1 |
| h | —普朗克常量,6.625×10-34 J·s | 下标 | |
| H | —焓变,kJ·mol-1 | i | —峰数 |
| k | —玻尔兹曼常量,1.3807×10-23J·K-1 | k | —Kissinger法求得的热力学参数 |
| m | —样品的质量,mg | o | —Flynn-Wall-Ozawa法求得的热力学参数 |
| R | —摩尔气体常数,8.314 J·mol-1·K-1或相对误差 | p | —峰顶 |
| S | —熵变,J·mol-1·K-1 | s | —Šatava-Šesták法求得的热力学参数 |
| [1] | Peter H. Principles of thermal analysis and calorimetry[M].Manchester: The Royal Society of Chemistry, 2002: 4-10. |
| [2] | Takeo O. Thermal analysis-review and prospect[J]. Thermochimica Acta, 2000, 355(2): 35-42. |
| [3] | ZHOU Cai-rong(周彩荣), LI Jing(李静), SHI Xiao-hua(石晓华), et al. Study on thermal analysis of inositol(肌醇的热分析研究)[J]. Journal of Zhengzhou University (Engineering Science)(郑州大学学报(工学版)), 2006, 27(4): 29-31. DOI:10.3969/j.issn.1671-6833.2006.04.008. |
| [4] | HU Rong-zu(胡荣祖), SHI Qi-zhen(史启祯), GAO Sheng-li(高胜利), et al. Thermal analysis kinetics(热分析动力学)[M].2nd ed.Beijing(北京): Science Press(科学出版社), 2008: 57-152. |
| [5] | Dollimore D, Lerdkanchanaporn S. Thermal analysis[J]. Analytical Chemistry, 1998, 70(12): 27-35. DOI:10.1021/a19800038. |
| [6] | LIU Zhong-ping(刘中平), LÜ Shu-chen(吕书琛), ZHOU Cai-rong(周彩荣). Thermal decomposition kinetic of inositol(肌醇热分解动力学)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报), 2013, 27(3): 542-546. DOI:10.3969/j.issn.1003-9015.2013.03.029. |
| [7] | ZHOU Cai-rong(周彩荣), REN Jun-liang(任军亮), XU Min-qiang(徐敏强), et al. Study on the thermal action of furfural residue(废弃糠醛渣的热分析研究)[J]. Journal of Zhengzhou University (Engineering Science)(郑州大学学报(工学版)), 2011, 32(4): 81-85. DOI:10.3969/j.issn.1671-6833.2011.04.020. |
| [8] | ZHANG Yu-dong(张予东), ZHANG Pu-yu(张普玉), PENG Li-chao(彭李超), et al. Thermal decomposition kinetics of N, N'-diphenyl maleic amide β-nucleating agen(N, N'-二苯基顺丁二甲酰胺β晶型成核剂的热分解动力学)[J]. Journal of Henan University (Natural Science)(河南大学学报(自然科学版)), 2009, 39(2): 148-152. DOI:10.3969/j.issn.1003-4978.2009.02.009. |
| [9] | Chen F X, Zhou C R, Li G P. Study on thermal decomposition and the non-isothermal decomposition kinetics of glyphosate[J]. Journal of Thermal Analysis Calorimetry, 2012, 109(3): 1457-1462. DOI:10.1007/s10973-011-1834-9. |
| [10] | Serge B, Jeffrey W G, Charles A W. Kinetic analysis of the thermal degradation of polystyrene-montmorillonite nanocomposite[J]. Polymer Degradation and Stability, 2004, 84(3): 483-492. |
| [11] | Yamada S, Koga N. Kinetics of the thermal decomposition of sodium hydrogencarbonate evaluated by controlled rate evolved gas analysis coupled with thermogravimetry[J]. Thermochimica Acta, 2005, 431(1-2): 38-43. DOI:10.1016/j.tca.2005.01.032. |
| [12] | Muraleedharan K, Kannan M P, Devi T G. Thermal decomposition kinetics of potassium iodate[J]. Journal of Thermal Analysis and Calorimetry, 2011, 103(3): 943-955. DOI:10.1007/s10973-010-1162-5. |
| [13] | Girish D, Mary E R. Kinetic aspects of the thermal degradation of poly(dimethylsiloxane) and poly(dimethyl diphenyl siloxane)[J]. Polymer Degradation and Stability, 2002, 76(1): 19-24. |
| [14] | Takeo O. Kinetic analysis by repeated temperature scanning. Part 1. Theory and methods[J]. Thermochimica Acta, 2000, 256(1-2): 173-180. |
| [15] | LU Lin-gang(卢林刚), ZHANG Yan(张燕), YANG Shou-sheng(杨守生), et al. Thermal decomposition kinetics of novel flame retardant from 1, 3, 5-tri(5, 5-dibromomethyl-1, 3, -dioxaphosphorinanyl-2-oxy)benzene(新型阻燃剂1, 3, 5-三(5, 5-二溴甲基-1, 3-二氧杂己内磷酰氧基)苯的热分解动力学研究)[J]. Plastics(塑料), 2009, 38(1): 43-45. |
| [16] | Dimitris S A, Elpiniki P, Ioannis Z. Thermal degradation kinetics and isoconversional analysis of biodegradable poly (3-hydroxybutyrate)/organomodified montmorillonite nanocomposites[J]. Thermochimica Acta, 2011, 514(1-2): 58-66. DOI:10.1016/j.tca.2010.12.003. |
| [17] | Rotaru A, Moanţa A, Popa G, et al. Thermal decomposition kinetics of some aromatic azomonoethers[J]. Journal of Thermal Analysis and Calorimetry, 2009, 97(2): 485-491. DOI:10.1007/s10973-009-0214-1. |
| [18] | ZHU Yuan-jiao(祝远姣), CHEN Xiao-peng(陈晓鹏), ZHOU Long-chang(周龙昌), et al. Non-isothermal decomposition kinetic of dehydroabieticacid(脱氢枞酸的非等温热分解动力学)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报), 2009, 23(3): 435-439. |
| [19] | Zhang L, Huang M X, ZHOU C R. Thermal stability and decomposition kinetics of polysuccinimide[J]. American Journal of Analytical Chemistry, 2013, 4: 749-755. DOI:10.4236/ajac.2013.412091. |
| [20] | CUI Xiao-ming(崔小明). Production application and market prospect of methionine(蛋氨酸的生产应用及市场前景)[J]. Chemical Production and Technology(化工生产与技术), 2000, 7(4): 19-19. DOI:10.3969/j.issn.1006-6829.2000.04.027. |
| [21] | LI Wen-li (李文俐). The simulation and design on methyl oleate continuous production process by two step reactions ("两步法"制备油酸甲酯连续化生产工艺流程模拟设计)[D]. Zhengzhou (郑州): Zhengzhou University (郑州大学). 2016. |




