1895年,德国物理学家伦琴发现了X射线,从此拉开了现代医学影像发展的序幕。1973年,Hounsfield[1]首次报道计算机X射线断层扫描(computed tomography, CT)的临床应用,同时完成了对物体内部结构精确的三维重建,对临床诊断而言,具有革命性的意义。第一代应用于临床的医用CT空间分辨率只有厘米数量级,存在精准性低和漏诊率高的问题,虽然科技的发展促成毫米数量级医用CT的出现,但其分辨率仍不能满足使用小动物(如小鼠/大鼠)及精准研究领域的成像要求。
随着影像科技的不断发展,如今分辨率高达微米数量级的高分辨率显微CT(micro-computed tomgraphy,micro-CT/μ-CT)在成像影像技术应用和发展中扮演着重要的角色,尤其是在小动物标本和大型动物离体标本的研究领域,micro-CT已经成为评价骨形态和骨微结构的“金标准”[2]。Micro-CT具有高空间分辨率、成本相对低廉、使用方便、并已经实现了在不处死动物或损伤标本的前提下,对小动物和标本进行扫描。能够获得组织内部详尽的三维空间结构信息,利用强大的图像处理软件,研究人员可以观察任意角度的断层图像,克服了病理切片中因标本形状或结构而限制操作或观察目标区域的困难;获得三维表面图像及三维透视图;实现对指定骨组织进行定量体积骨密度(bone mineral density,BMD)分析[3];肿瘤及骨转移监测[4];借助造影剂进行血管管径测量等[5-6]。此外,在micro-CT在材料学、组织工程、考古学等众多领域得到广泛应用。
如今,随着micro-CT系统技术的不断成熟及应用范围的逐渐扩大,系统深入地了解micro-CT系统检测指标在各个研究领所指代的具体意义和应用价值显得尤为重要。目前,micro-CT在骨代谢领域应用最为广泛,因此,本文以SkyScan 1176 micro-CT(Bruker,Kontich,Belgium)为例,主要介绍micro-CT系统的工作原理、特点及其相关指标的在骨代谢研究领域的意义和应用。
Micro-CT系统的组成和工作原理Micro-CT系统主要硬件由X射线源、X线探测器、机械控制系统及计算机控制处理系统等4个单元组成。细分还包括抗震基座、高速电子束扫描装置、钨酸镉集成电路电荷耦合装置(charge coupled device,CCD)检测器、高电压X线球管和控制台等硬件及图像数据分析处理等软件系统。
根据扫描标本状态的不同,现有的micro-CT系统设计有两种构型,活体扫描成像系统,工作时样品固定,X线发射和接收系统围绕样本旋转以完成扫描;离体扫描成像系统,工作中样品旋转,X线发射和接收系统位置固定,唯有活体扫描系统可以同时满足离体和活体两种扫描要求。因此,活体扫描型micro-CT应用相对广泛。但活体扫描时,小动物心跳、呼吸、抽搐及震颤等生理条件限制其扫描精度,比如SkyScan 1176最高扫描精度为8.96 μm,而离体扫描型micro-CT在标本充分固定的情况下可以达到小于1 μm扫描精度。
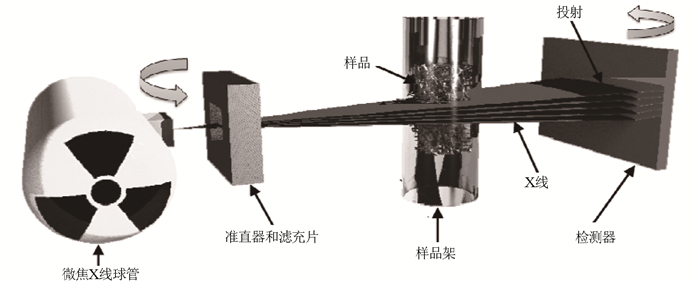
SkyScan 1176活体扫描系统在工作时,微焦距X线球管发出的X射线经过滤光器(材质通常为铝或铜)滤过而缩小射线能谱,射线通过样品后的二维图像信息反应在CCD上,这样射线发生滤过系统和CCD以预设的旋转角度环绕样本做180°或者360°旋转扫描(图 1)[7]。图像信息最终储存在计算机系统中。通过重构软件再将CCD获取的图像重构CT断层图像,以此作为后续三维图像制作和数据分析的基础。
|
| 图 1 活体成像micro-CT系统基本构件和工作原理 Figure 1 Basic components and working principle of micro-CT system in vivo |
Micro-CT系统描述骨形态和微结构检测结果的准确性和有效性已在众多科学研究中得到证实。在分别以大鼠[8-10]和人离体样本[11-13]作为实验对象的研究中,通过对micro-CT系统和组织形态计量学方法所得结果的一致性进行分析,结果提示在骨微结构和骨形态的描述结果方面,两者高度一致。但是两者的一致性同时受到micro-CT扫描和数据分析系统因素的影响,如扫描分辨率和区分骨和软组织的阈值等。因此,在做形态计量定量检测前,所有扫描、重构及分割的相关参数和设置必须保证严格一致。
在传统研究方法中,通过对样本某个切面的二维图像进行组织形态计量学分析,以获得骨小梁结构相关指标,如骨体积分数和骨表面积骨体积比。但是对于计算骨小梁数目、骨小梁厚度、骨小梁分离度、用于描述骨小梁杆状或板状形态的骨小梁模式因子、结构模式指数、皮质骨孔隙率等指标计算和三维图像制作而言,都需要建立在micro-CT构建的三维模型基础之上。下面具体解读micro-CT检测参数具体意义(表 1)。
| 指标名称 | 单位 | 解释及意义 |
| 骨表面积 | mm2 | 通过移动立方体算法对骨组织进行三角测量计算的骨组织表面积 |
| 组织体积 | mm3 | 指感兴趣区域总体积,该指标主要根据研究者或研究重点观察区域而定 |
| 骨体积 | mm3 | 指特定感兴趣区域中被定义为骨组织的体积 |
| 骨表面积骨体积比 | 1/mm | 表示单位体积骨组织的面积大小 |
| 骨表面积组织体积比 | 1/mm | 又称为骨表面积密度,可以间接反映骨量多少 |
| 骨体积分数 | % | 表示骨组织体积与组织体积比值,可直接反应骨量变化情况 |
| 骨小梁数目 | 1/mm | 代表感兴趣区域中,每mm中骨组织与非骨组织交点数量的平均值 |
| 骨小梁厚度 | μm | 指骨小梁平均厚度 |
| 骨小梁分离度 | μm | 代表骨小梁之间髓腔平均宽度 |
| 骨小梁模式因子 |
1/mm |
用以形容骨小梁表面凹凸程度,该值降低提示骨小梁由杆状向板状变化,发生骨质疏松时Tb.Pf增加,即骨小梁从板状变为杆状 |
| 结构模式指数 |
- |
描述小梁结构组成结构中板层结构和杆状结构比例的参数。如果结构中骨小梁主要为板层结构,那么SMI接近于0;反之,如果主要是杆状骨小梁,SMI则接近3 |
| 各向异性程度 | - | 用于评价骨小梁的方向性和对称性 |
| 骨小梁连接密度 | 1/mm3 | 表示每立方毫米体积中骨小梁网状结构之间的连接数量 |
| 皮质骨总面积 | mm2 | 为皮质骨横断面的总面积 |
| 皮质骨面积 | mm2 | 为皮质骨横断面的平均截面积 |
| 皮质骨厚度 | μm | 感兴趣区域皮质骨的平均厚度 |
| 总孔隙率 | % | 代表皮质骨组织中孔隙的百分比 |
双能X线吸收检测法(dual energy X-ray absorptiometry,DXA)作为诊断骨质疏松症的“金标准”,可测量股骨颈和腰椎皮质和松质骨的平均面积BMD,以间接反映骨质量和强度[14],单位为g/cm2。Micro-CT扫描获得的断层图像信息,可借助分析软件选择感兴趣区域(region of interest, ROI)并做阈值分割,排除皮质骨(或松质骨)、软组织及髓腔中的液体的影响,单独计算骨小梁(或皮质骨)BMD,称之为组织骨密度(tissue mineral density, TMD)或骨矿物质密度,单位为g/cm3,即通常意义上的BMD。因其不包括非骨组织的体素,所以TMD要大于DXA计算的BMD。TMD是通过体模和已知的标准CT值计算出来的骨矿物质含量,体模成分主要为羟基磷灰石,因此TMD以单位体积羟基磷灰石表示。众所周知,骨组织总矿物质含量和矿化程度因解剖部位、生长状态、性别及年龄等因素存在较大差异,micro-CT不仅可以迅速地获得活体动物BMD,而且不会破坏骨组织标本结构,这与传统评价矿化程度的方法(如定量显微成像术、散射电子显微镜及灰份含量)相比,具有显著优越性。
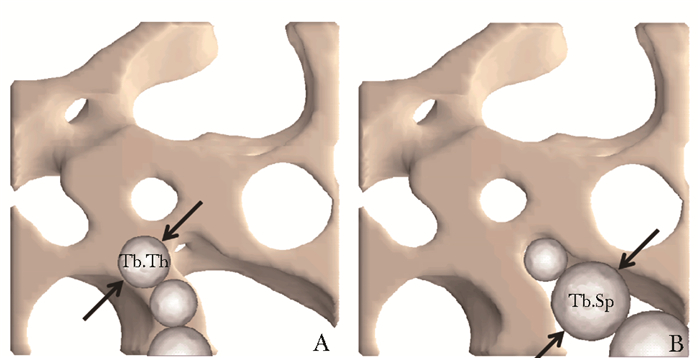
骨小梁微结构形态测量学指标骨表面积(bone surface,BS),该指标是通过移动立方体算法对骨组织进行三角测量[15];组织体积(tissue volume, TV),该指标主要根据研究者或研究重点观察区域而定。通常情况下,实验组和对照组或同一研究对象干预前后进行比较时,TV对应的感兴趣区域应该保证一致,这样有助于减少系统误差,增加研究结果的可比性。骨体积(bone volume, BV),当比较对象感兴趣区域TV相同时,BV和骨体积分数都能反映骨量多少。BS与TV和BV的比值同样可反应骨组织形态特征。骨表面积骨体积比值(BS/BV)和骨表面积组织体积比值(BS/TV),可以间接反映骨量多少。骨体及分数(BV/TV),该指标为皮质骨和松质骨骨量评价常用指标,对于髓腔内松质骨而言,该比值能够反应不同样本骨小梁骨量的多少,该值增高说明骨合成代谢大于分解代谢,骨量增加,反之亦然,从而能够间接反应骨代谢状况。在评价长骨中段皮质骨骨量和骨代谢状况方面具有同样的价值。骨小梁数(trabecular number,Tb.N)、骨小梁厚度(trabecular thickness,Tb.Th)和骨小梁分离度(trabecular separation,Tb.Sp), 是评价骨小梁空间形态结构的主要指标,采用球面拟合法进行计算,在计算Tb.Th时球体拟合对象为骨小梁,而Tb.Sp拟合对象则是骨小梁之间的间隙(图 2)[16]。在计算过程中采用最大化原则,从每个体素测量最大球体直径,然后计算所有直径平均值,即为分析感兴趣区域中骨小梁的平均厚度或平均分离度。值得注意的是,由于这3个指标计算的的都是平均值,因此,在描述时要同时考虑其标准差的大小。在骨分解代谢大于骨合成代谢时情况下,如发生骨质疏松时,Tb.N和Tb.Th数值减少;Tb.Sp数值增加。如果研究对象为多孔材料,Tb.Th和Tb.Sp数值可理解为孔壁厚度和孔隙率。骨小梁模式因子(trabecular bone pattem factor, Tb.Pf),形容骨小梁表面凹凸程度,其与结构模式指数(structure model index, SMI),是描述小梁结构组成结构中板层结构和杆状结构比例的参数。后者以三角形骨表面辨别分析为基础通过三维分析方法计算获得[16]。如果结构中骨小梁主要为板层结构,那么SMI接近于0;反之,如果主要是杆状骨小梁,SMI则接近3。发生骨质疏松时,骨小梁从板状向杆状转变,该值增大。但是在计算皮质骨时,因BV/TV过大,可能导致SMI为负数。因此,SMI仅在描述较为疏松结构时才有意义,如骨小梁及多孔材料等。各向异性程度(degree of anisotropy, DA),用于评价骨小梁的方向性和对称性,指椭圆体截距长度平均值(mean intercept length, MIL)中长径和短径的比值,该比值越大说明各向异性程度越大,即椭圆越偏,比值为1时,椭圆为球体,各向异性最小。在骨质疏松早期,承重骨小梁DA值通常增加,随着骨质疏松加剧,DA会减小。骨小梁连接密度(connectivity density, Conn.D),表示每立方毫米体积中骨小梁网状结构之间的连接数量。连通性是通过欧拉数获得[17]。只有当连通性取决待评价结构大小的情况下,结合总体积计算的连接密度才能称之为连接密度。
|
| 图 2 骨小梁厚度和骨小梁分离度计算示意图 Figure 2 Calculation diagram of trabecular thickness and trabecular separation A:骨小梁厚度(Tb.Th); B:骨小梁高度(Tb.Sp) |
通常选择长骨骨干作为皮质骨形态学测量的感兴趣区域,值得注意的是在分析前,需要将分析区域骨骼的长轴作调整,使其与冠状位及矢状位的轴线保持平行(Skyscan1176中通过Dataviewer软件实现)。除了TMD、BV、TV、BV/TV、BS、BS/TV及BS/BV这些与骨小梁计算方法及意义类似外,皮质分析中还可以获得如下指标:皮质骨总面积(total cortical bone area, Tt.Ar),为皮质骨横断面的总面积,单位为mm2;皮质骨面积(cortical bone area, Ct.Ar),为皮质骨横断面的平均截面积,计算公式为Ct.Ar=皮质骨体积÷(层数×层厚),单位为mm2;皮质骨厚度(cortical bone thickness, Ct.Th),为分析区域皮质骨的平均厚度,单位为μm;连接密度(connectivity density, Conn.D),单位为1/mm3。总孔隙率[total porosity (percent), Po(tot)],代表皮质骨组织中孔隙的百分比,单位为%,骨质疏松时皮质骨发生多孔性改变,孔隙率会随着骨质疏松症的进展而增加,计算孔隙率需在足够高的扫描分辨率。孔隙总体积[total volume of pore space, Po.V(tot)],为分析区域骨组织孔隙总体积,单位mm3,其应用条件和意义同孔隙率。
展望目前,随着人口老龄化的加剧,骨质疏松症发病率和病死率逐年升高,骨质疏松症及其并发症已经成为危害人类健康重大疾病[18]。预计2050年全球骨质疏松性骨折患病人群将达到2 100万[19],对人群健康状况和生活质量造成巨大影响[20-21]。骨质疏松导致骨强度下降的机制不仅是骨量下降,而且是骨小梁微结构破坏、皮质骨多孔性改变及总骨量降低等综合导致[22-23]。由于松质骨结构复杂多变,导致其力学特征也存在不均一性和各向异性等特点,骨小梁的三维形态结构指标TB.Th、TB.Sp、TB.N及SMI等决定了其在维持骨强度中的作用。在骨质疏松症患者骨脆性增加的危险因素中,骨强度下降比骨量下降更为突出。双能X线吸收仪仅能检测面积BMD[24],代表骨量变化,不能反映骨强度改变情况,存在一定局限性。micro-CT不仅能够获得比双能X线吸收仪更为准确的体积BMD来反映骨量变化,同时还能获得骨骼内部骨小梁骨微结构的定量指标,进而将骨小梁微结构指标、皮质骨指标及骨量结合起来,综合评价骨强度和骨量在骨质疏松症发生和发展中的作用。因此,针对动物实验和人离体标本骨微结构而言,micro-CT在骨质疏松症、骨关节炎、骨硬化及其他骨代谢性疾病的研究中具有重要的意义和代表性。但是目前micro-CT未能直接检测人体骨结构,期待将来能够应用于临床,达到方便、快捷、精确评估人体各部位骨质量。
| [1] | Hounsfield GH. Computerized transverse axial scanning (tomography). Deseription of system[J]. Br J Radiol, 1973, 46: 1016–1022. DOI:10.1259/0007-1285-46-552-1016 |
| [2] | Bouxsein ML, Boyd SK, Christiansen BA, et al. Guidelines for assessment of bone microstructure in rodents using micro-computed tomography[J]. J Bone Miner Res, 2010, 25: 1468–86. DOI:10.1002/jbmr.141 |
| [3] | Feldkamp LA, Goldstein SA, Parfitt AM, et al. The direct examination of three-dimensional bone architec-ture in vitro by computed tomography[J]. J Bone Miner Res, 1989, 4: 3–11. |
| [4] | De Clerck NM, Meurrens K, Weiler H, et al. High-resolution X-ray microtomography for the detec-tion of lung tumors in living mice[J]. Neoplasia, 2004, 6: 374–379. DOI:10.1593/neo.03481 |
| [5] | Wan SY, Kiraly AP, Ritman EL, et al. Extraction of the hepatic vasculature in rats using 3-D Micro-CT images[J]. IEEE Med Imaging, 2000, 19: 964–997. DOI:10.1109/42.887843 |
| [6] | Bolland BJ, Kanczler JM, Dunlop DG, et al. Development of in vivo muCT evaluation of neovascularisation in tissue engineered bone constructs[J]. Bone, 2008, 43: 195–202. DOI:10.1016/j.bone.2008.02.013 |
| [7] | Stauber M, Muller R. Micro-computed tomography:a method for the non-destructive evaluation of the three-dimensional structure of biological specimens[J]. Methods Mol Biol, 2008, 455: 273–292. DOI:10.1007/978-1-59745-104-8 |
| [8] | Bonnet N, Laroche N, Vico L, et al. Assessment of trabecular bone microarchitecture by two different X-ray microcomputed tomographs:a comparative study of the rat distal tibia using Skyscan and Scanco devices[J]. Med Phys, 2009, 36: 1286–1297. DOI:10.1118/1.3096605 |
| [9] | Waarsing JH, Day JS, Weinans H. An improved segmentation method for in vivo microCT imaging[J]. J Bone Miner Res, 2004, 19: 1640–1650. DOI:10.1359/JBMR.040705 |
| [10] | Alexander J, Bab I, Fish S, et al. Human parathyroid hormone 1-34 reverses bone loss in ovariectomized mice[J]. J Bone Min Res, 2001, 16: 1665–1673. DOI:10.1359/jbmr.2001.16.9.1665 |
| [11] | Fanuscu MI, Chang TL. Three-dimensional morphometric analysis of human cadaver bone:microstructural data from maxilla and mandible[J]. Clin Oral Implants Res, 2004, 15: 213–218. DOI:10.1111/clr.2004.15.issue-2 |
| [12] | Chappard D, Retailleau-Gaborit N, Legrand E, et al. Comparison insight bone measurements by histomorphometry and micro-CT[J]. J Bone Miner Res, 2005, 20: 1177–1184. DOI:10.1359/JBMR.050205 |
| [13] | Akhter MP, Lappe JM, Davies KM, et al. Transmenopausal changes in the trabecular bone structure[J]. Bone, 2007, 41: 111–116. DOI:10.1016/j.bone.2007.03.019 |
| [14] | Link TM. Osteoporosis imaging:state of the art and advanced imaging[J]. Radiology, 2012, 263: 3–17. DOI:10.1148/radiol.12110462 |
| [15] | Lorensen W, Cline H. Marching cubes:a high resolution 3D surface construction algorithm[J]. Comput Graph, 1987, 21: 163–169. DOI:10.1145/37402 |
| [16] | Hildebrand T, Ruegsegger P. A new method for the model independent assessment of thickness in three-dimensional images[J]. J Micros, 1997, 185: 67–75. DOI:10.1046/j.1365-2818.1997.1340694.x |
| [17] | Odgaard A, Gundersen HJ. Quantification of connec-tivity in cancellous bone, with special emphasis on 3-D reconstructions[J]. Bone, 1993, 14: 173–182. DOI:10.1016/8756-3282(93)90245-6 |
| [18] | Cathleen S, Colon E, Saag KG. Osteoporotic fractures in older adults[J]. Best Pract Res Clin Rheumatol, 2006, 20: 695–706. DOI:10.1016/j.berh.2006.04.004 |
| [19] | Cummings SR, Melton LJ. Epidemiology and outcomes of osteoporotic fractures[J]. Lancet, 2002, 359: 1761–1767. DOI:10.1016/S0140-6736(02)08657-9 |
| [20] | Willson T, Nelson SD, Newbold J, et al. The clinical epidemiology of male osteoporosis:a review of the recent literature[J]. Clin Epidemiol, 2015, 7: 65–76. |
| [21] | Giusti A, Bianchi G. Male osteoporosis[J]. Reumatismo, 2014, 66: 136–143. DOI:10.4081/reumatismo.2014.786 |
| [22] | Kanis JA, McCloskey EV, Johansson H, et al. European guidance for the diagnosis and management of osteoporosis in postmenopausal women[J]. Osteoporos Int, 2013, 24: 23–57. DOI:10.1007/s00198-012-2074-y |
| [23] | Siu WS, Qin L, Leung KS. pQCT bone strength index may serve as a better predictor than bone mineral density for long bone breaking strength[J]. J Bone Miner Metab, 2003, 21: 316–322. DOI:10.1007/s00774-003-0427-5 |
| [24] | Genant HK, Engelke K, Fuerst T, et al. Noninvasive assessment of bone mineral and structure:state of the art[J]. J Bone Miner Res, 1996, 11: 707–730. |
| (收稿日期:2017-04-06) |

