2.710032 西安,第四军医大学基础部药理学教研室
2.Department of Pharmacology, School of Pharmacy, Fourth Military Medical University, Xi'an 710032, China
骨质疏松症是一种以骨量降低和骨组织微结构破坏为特征,骨脆性和骨折风险增高的代谢性骨病,其引起的疼痛和骨折严重影响患者的生活质量[1],骨质疏松的作用机制十分复杂,目前尚未完全明确。各年龄段人群中均有发生,主要包括绝经后骨质疏松、废用性骨质疏松以及药物诱导性骨质疏松等类型。动物模型既可避免实验研究对人体造成的伤害,还能以较短的时间模拟疾病病理状态,为研究骨质疏松症的发生、发展以及治疗药物提供了一种重要手段[2]。绝经后骨质疏松动物模型通过切除雌性动物双侧卵巢建立;药物诱导性骨质疏松在人类十分常见,但药物不良反应较大,影响动物正常代谢且效果不稳定,目前缺乏稳定的动物模型[3]。废用性骨质疏松模型主要采用尾悬吊,坐骨神经切除,肌腱离断或者机械固定等方法,其中以尾悬吊法最为常见,是研究瘫痪、骨折等患者及航天员失重状态下出现骨质疏松的重要手段[4]。
尾悬吊法最早在1979年由Morey等[5]提出,用于模拟宇航员失重状态的研究。研究发现,大鼠尾悬吊后,比目鱼肌萎缩明显,骨生长受限,生物力学性能退化,胶原代谢紊乱,骨转化增强,而骨钙素以及转化生长因子β,前列素E2等血清指标明显下降[6, 7, 8]。尾悬吊模型在一定程度上体现了骨骼肌与骨骼之间的关系,是一种可以较好地模拟人体骨质疏松过程的方法。目前尾悬吊法多以大鼠为主,但大鼠骨皮质重建活性较低,不宜用于评价可促进骨哈佛氏系统重建药物的研究[9],小鼠则以各种骨代谢相关基因敲除小鼠的研究为主。不同品系小鼠对尾悬吊适应性迥异,其中以C57BL背景的小鼠悬吊后骨质流失个体差异性最小[10],生长期小鼠对悬吊最敏感[11]。本文结合文献[12, 13],自制了一种小鼠悬尾装置,观察尾悬吊14 d后以及经过14 d缓解后雄性C57小鼠股骨骨质流失情况,并探讨建立一种废用性骨质疏松模型的可行性。
材料与方法 实验分组和造模32只8~10周龄健康雄性C57BL/6J小鼠 (23~25 g),由第四军医大学实验动物中心提供,实验动物许可证号:SYXK(陕)2008-005。采用数表法随机分为4组,即尾悬吊14 d组(tail-suspension,TS)以及相应的对照组(control 1,C1),悬尾14 d后休息14 d组(TS+rest,TS+R)和相应的对照组(control 2,C2),每组8只。造模前小鼠适应性饲养1周,采用自制装置建立尾悬吊模型(图1),在(23±2)℃的室温环境中饲养,对照组除无悬吊处置外,其余与悬吊组一致。本实验相关动物使用遵守《第四军医大学动物实验管理条例》。
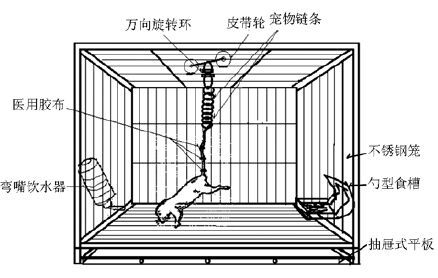
|
| 图1 小鼠尾悬吊装置示意图 Fig.1 Device of mouse |
实验过程中密切关注小鼠活动,避免出现排泄物堵塞引起的感染。14 d后分别断颈处死TS和C1组小鼠,28 d后处死TS+R和C2组小鼠,取各组小鼠双侧股骨,用0.9%氯化钠注射液浸润的纱布包裹,-70 ℃保存。
Micro CT扫描及重建分析显微CT是一种非侵入性评估手段,为骨质疏松程度提供准确的定性及定量分析[14]。每组取4根左侧股骨,用小动物显微CT(Inveon公司,德国西门子公司)进行扫描重建。选取股骨髁生长板近端1.0~1.5mm处(图2A1)和股骨中段0.5 mm区域(图2A2)作为感兴趣区(region of interest,ROI),采用Mimics软件(版本10.0,美国Materialise公司)分析ROI骨小梁骨矿物质密度(bone mineral density,BMD),骨相对体积(bone volume/total volime,BV/TV)、小梁数量(trabecular bone number,Tb.N)、小梁分离度(trabecular bone separation,Tb.Sp)、小梁厚度(trabecular bone thickness,Tb.Th),皮质骨BMD,表面积(cortical area,Ct.Ar)、厚度(cortical thickness,Ct.Th)等指标。
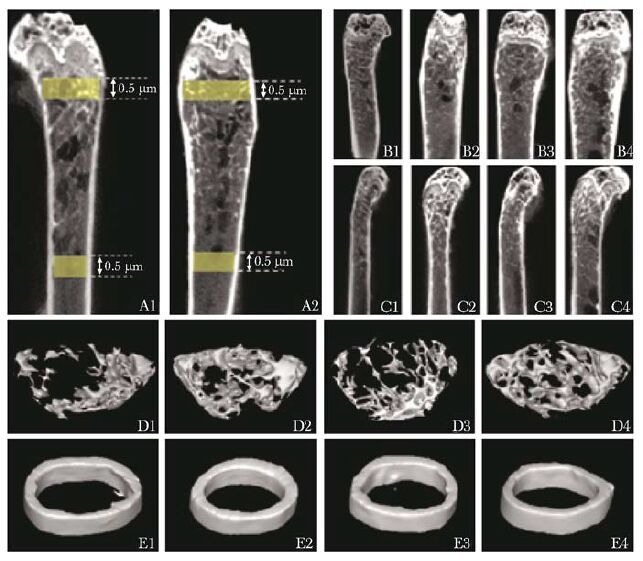
|
| 图2 显微CT扫描不同组小鼠股骨ROI及三维重建图 Fig.2 3D pictures of ROI among different groups by 编号1~4分别对应TS,C1,TS+R和C2组;A1:ROI矢状面; A2:ROI冠状面;B1~4和C1~4分别是不同组小鼠股骨矢状面和冠状面示意图;D1~4和E1~4分别为ROI三维重建图;ROI:感兴趣区 |
取小鼠右侧股骨在3 d内利用电子三点弯曲疲劳试验机(型号ELF3520,美国BOSE公司)进行3点弯曲测试,测试股骨中段生物力学性能。参数:速度1.2 mm/min,跨距8 mm至股骨断裂。随后使用游标卡尺量取断端内外径以及皮质骨厚度,重复3次取平均值。根据结果绘制载荷-变形曲线,记录最大载荷(max loading),根据公式计算弯曲弹性模量(elastic modulus)等指标[15]。
形态学检查每组取4根新鲜的左侧股骨,浸泡于4%多聚甲醛溶液中,EDTA脱钙,石蜡包埋,用于RANKL、TRAP、甲苯胺蓝以及Masson染色。RANKL染色观察成骨细胞形态,TRAP染色观察破骨细胞形态,甲苯胺蓝染色用于观察生长板和软骨细胞形态,Masson染色用于观察股骨远端纤维化程度。每根股骨各选取两张200倍镜染色图片,使用Image Pro Plus软件(版本6.0,美国Cybernetics公司)分析后取平均值进行统计。
统计学方法所有数据均采用SPSS17.0(美国IBM公司)进行统计分析,数据以均值±标准误(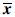 ±s)表示,尾悬吊组与其对照组之间采用两独立样本t检验,以P<0.05为差异有统计学意义。
±s)表示,尾悬吊组与其对照组之间采用两独立样本t检验,以P<0.05为差异有统计学意义。
小鼠一般状况良好,未出现明显感染、脱毛等情况,悬尾过程中均处于后肢离地状态,无意外死亡。不同组小鼠体质量,股骨长度变化情况见表1,监测体质量变化情况发现小鼠悬吊3 d后体质量达到谷底,随后缓慢上升,至14 d或28 d时与各自对照组相比,差异无统计学意义(P>0.05)。TS组和TS+R组股骨长度较各自对照组分别下降8.23%和7.68%,而两组股骨长度下降程度之间比较,差异无统计学意义(P>0.05)。
| 组别 | 体质量(g) | 股骨长度(mm) | |
| 0 d | 14 or 28 d | ||
| C1组(n=8) | 24.14±0.42 | 26.45±0.76 | 16.40±0.16 |
| TS组(n=8) | 24.21±0.36 | 25.32±0.62 | 15.05±0.05* |
| C2组(n=8) | 24.27±0.51 | 28.02±0.64 | 16.53±0.14 |
| TS+R组(n=8) | 24.62±0.46 | 27.63±0.87 | 15.26±0.11* |
| C1:尾悬吊14 d对照组;TS:尾悬吊14 d组; C2:尾悬吊14 d+休息后14 d对照组; R:休息14 d; 尾悬吊组与各自对照组比较,*P<0.05 | |||
显微CT对骨的微观结构进行定量分析,可见TS组和TS+R组的骨小梁BMD与各自对照组相比分别下降26.80%和20.52%,悬吊导致小梁骨相对体积、厚度、数量等指标明显下降,小梁分离度显著升高(表2),但上述指标的变化在TS组和TS+R组之间比较,差异无统计学意义(P>0.05)。TS组BMD较C1组下降8.51%,而TS组和TS+R组表面积和厚度与各自对照组相比,差异无统计学意义(P>0.05)(表3)。显微CT扫描可见TS组和TS+R组股骨远端骨小梁区域较对照组明显稀疏,结构不清(图2)。小梁骨三维重建可更加直观的发现TS组和TS+R组的小梁结构破坏,空洞明显,而4组皮质骨形态正常,结构完整(图2)。
| 小梁骨检测指标 | BMD(mg/cm3) | BV/TV(%) | Tb.Th(μm) | Tb.N(N) | Tb.Sp(μm) |
| C1组(n=4) | 351.69±21.35 | 31.90±2.70 | 52.18±6.68 | 5.42±0.84 | 130.65±12.03 |
| TS组(n=4) | 257.44±15.17** | 6.77±0.71** | 32.25±3.52* | 2.01±0.33** | 442.20±26.05** |
| C2组(n=4) | 336.78±22.73 | 29.34±2.48 | 54.94±5.86 | 5.85±0.78 | 134.98±14.21 |
| TS+R组(n=4) | 267.73±17.48* | 8.01±0.87* | 38.53±3.13* | 2.32±0.64** | 420±30.12** |
| BMD:骨小梁骨矿物质密度; BV/TV:小梁骨相对体积; Tb.Th:小梁骨厚度; Tb.N:小梁骨数量; Tb.Sp:小梁骨分离度; 尾悬吊组与各自对照组比较,*P<0.05,**P<0.01 | |||||
| 组别 | BMD(mg/cm3) | Ct.Ar(mm3) | Ct.Th(μm) |
| C1组(n=4) | 1209.41±35.36 | 0.67±0.08 | 0.20±0.03 |
| TS组(n=4) | 1106.41±34.98* | 0.56±0.10 | 0.18±0.02 |
| C2组(n=4) | 1235.95±33.87 | 0.71±0.09 | 0.21±0.02 |
| TS+R组(n=4) | 1172.19±24.55 | 0.63±0.11 | 0.19±0.03 |
| C1:尾悬吊14 d对照组;TS:尾悬吊14 d组; C2:尾悬吊14 d+休息后14 d对照组; R:休息14 d; BMD:骨小梁骨矿物质密度; Ct.Ar:皮质骨表面积, Ct.Th:皮质骨厚度;尾悬吊组与各自对照组比较,*P<0.05 | |||
尾悬吊导致TS组和TS+R组最大载荷较各自对照组下降23.01%和18.54%,两组间下降程度相比,差异无统计学意义(P>0.05),TS组弯曲弹性模量较C1组下降21.99%,TS+R组与C2组相比,差异无统计学意义(P>0.05)(表4),两组下降程度间比较,差异有统计学意义(t=6.462,P=0.008)。
| 组别 | 最大载荷(N) | 弯曲弹性模量(MPa) |
| C1组(n=8) | 14.25±1.34 | 3792.61±329.26 |
| TS组(n=8) | 10.97±1.13* | 2958.80±285.73** |
| C2组(n=8) | 14.45±1.56 | 3749.17±366.87 |
| TS+R组(n=8) | 11.77±1.47* | 3687.15±374.20 |
| C1:尾悬吊14 d对照组;TS:尾悬吊14 d组; C2:尾悬吊14 d+休息后14 d对照组;R:休息14 d; 尾悬吊组与各自对照组比较,*P<0.05,**P<0.01 | ||
光镜下观察,TS组和TS+R组骨小梁变薄变细,数量减少(表5),部分区域出现断裂甚至消失,骨髓腔面积增大,生长板变薄,而对照组骨小梁结构完整规则,呈网状结构,无明显缺损和破坏表现。统计各组骨小梁表面单位长度内成骨细胞,发现TS和TS+R组比各自对照组低47.76%和41.44%,两组下降程度间差异无统计学意义(P>0.05);TS和TS+R组骨小梁内破骨细胞增多,分别较各自对照组上升30.06%和16.93%;甲苯胺蓝染色显示,TS和TS+R组生长板部位软骨细胞明显少于各自对照组;Masson染色显示TS组胶原纤维面积明显小于C1组(图3)。
| 组别 | N.Ob/BS(1/μm) | N.Oc/BS(1/μm) | ||
| C1组(n=4) | 16.56±4.34 | 3.16±0.33 | ||
| TS组(n=4)) | 8.65±1.31** | 4.11±0.54** | ||
| C2组(n=4) | 15.83±3.67 | 3.13±0.27 | ||
| TS+R组(n=4) | 9.27±1.49** | 3.66±0.38* | ||
| C1:尾悬吊14 d对照组;TS:尾悬吊14 d组; C2:尾悬吊14 d+休息后14 d对照组; R:休息14 d; N.Ob/BS:成骨细胞数; N.Oc/BS:破骨细胞数; 尾悬吊组与各自对照组比较,*P<0.05,**P<0.01 | ||||
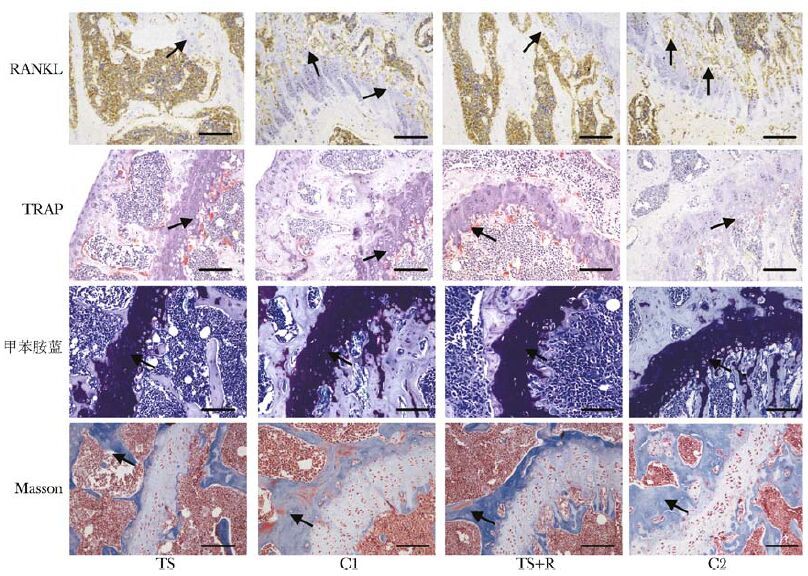
|
| 图3 不同组小鼠小梁骨形态学示意图(n=4,比例尺:100 μm) Fig.3 Morphological changes of mice's trabecular bone among different groups 第1行:成骨细胞形态(箭头,RANKL染色);第2行:破骨细胞形态(箭头,TRAP染色);第3行:生长板软骨细胞形态(箭头,甲基胺蓝染色);第4行:胶原纤维面积(箭头,masson染色) |
骨质疏松在各年龄段人群中均有发生,以往研究多集中于女性绝经后骨质疏松[16],近年来因废用性原因导致的青壮年男性骨质疏松的比例越来越高[13],建立一种快速、稳定的动物模型显得尤为迫切。小鼠在尾悬吊实验中运用不多,可能跟其体质量轻,运动能力强,易翻身咬断悬吊装置逃脱等原因有关[17]。
本研究在大鼠悬吊装置的基础上进行了改造,使之更加适合小鼠,并在造模前适应性饲养1周,发现悬吊14 d小鼠的一般状况良好,无明显的感染、脱毛、脱落或死亡,提高了造模成功率。
尾悬吊对肌肉等软组织的影响较大,短期内引起TS组和TS+R组小鼠体质量下降,但随着小鼠逐渐适应之后恢复很快,TS+R组体质量与其对照组比较,差异无统计学意义(P>0.05)。相比而言,骨恢复较慢,本研究中TS组与TS+R组股骨长度之间的关系与Guo等[8]的研究一致。显微CT发现尾悬吊小鼠小梁骨ROI的BMD等多项空间结构指标显著下降,Tb.sp升高,三维重建发现骨小梁结构退化,由板状向杆状发展,悬吊移除并不能完全改善。而小鼠皮质骨ROI除TS组BMD低于C1组,其余指标组间比较,差异无统计学意义(P>0.05)。可见尾悬吊对小鼠小梁骨影响较大,而对皮质骨影响有限。生物力学检测主要研究骨受到外力后所产生的生物学效应,是对显微CT的重要补充[18]。本实验发现,TS组小鼠股骨最大载荷和弯曲弹性模量等指标降低明显,表明悬吊导致小鼠骨脆性增强,骨折的风险增大。但是随着悬吊的解除,TS+R组弯曲弹性模量等反映骨韧性的指标恢复迅速,骨韧性增强。此外,我们发现RANKL染色标记的成骨细胞在TS组和TS+R组明显低于各自对照组,且两组间差异无统计学意义(P>0.05),表明尾悬吊可引起干骺端成骨细胞增殖活性显著下降,且短期内难以恢复。与之相对应的是,TRAP染色标记的破骨细胞在TS组和TS+R组高于各自对照组,表明尾悬吊同时具有激活破骨细胞的作用,但是随着悬吊解除,破骨细胞数较悬吊时有所下降。甲苯胺蓝染色进一步发现悬吊可导致小鼠生长板厚度变薄,软骨细胞数目较对照组下降。Masson染色发现TS组胶原纤维面积显著低于C1组,当悬吊解除14 d之后胶原纤维面积上升明显,表明悬吊是导致胶原纤维分解的重要原因。结合上述结果,本研究发现成骨细胞、破骨细胞、软骨细胞以及胶原纤维的变化共同构成了骨质疏松的基础,尾悬吊在这个过程中发挥了抑制小梁骨重建的作用。
卵巢切除是目前最常用的一种骨质疏松动物模型,但其造模周期较长,一般2.5~3.0个月后股骨髁部BMD下降幅度为20%~30%[19],与其相比,本研究采用的方法14 d就能达到类似的骨质流失程度,且无手术创伤应激,造模时间短,避免了长期悬吊带来的动物伦理问题[20]。此外本研究还发现,将悬吊14 d的小鼠解除悬吊后14 d,小鼠股骨的大多数空间结构参数和生物力学指标并无明显变化,依然可以保持骨质疏松状态,有利于开展对骨质疏松治疗药物的研究。有文献发现雌性动物比雄性对悬吊更为敏感[21],因此该模型可以进一步推广到雌性小鼠。但本实验也存在一些不足,骨质疏松是一种代谢性疾病,缺乏代谢方面的指标,TS+R组的小鼠休息时间仅有14 d,时间较短,不利于对药物疗效的观察。总而言之,本研究通过尾悬吊法建立的C57雄性小鼠废用性骨质疏松模型,值得进一步推广运用。
| [1] | Saxena R,Pan G,Dohm ED,et al. Modeled microgravity and hindlimb unloading sensitize osteoclast precursors to RANKL-mediated osteoclastogenesis[J]. J Bone Miner Metab,2011,29:111-122. |
| [2] | Giangregorio L,Blimkie CJ. Skeletal adaptations to alterations in weight-bearing activity:a comparison of models of disuse osteoporosis[J]. Sports Med,2002,32:459-476. |
| [3] | Lang TF,Leblanc AD,Evans HJ,et al. Adaptation of the proximal femur to skeletal reloading after long-duration spaceflight[J]. J Bone Miner Res,2006,21:1224-1230. |
| [4] | Sun LW,Fan YB,Li DY,et al. Evaluation of the mechanical properties of rat bone under simulated microgravity using nanoindentation[J]. Acta Biomaterialia,2009,5:3506-3511. |
| [5] | Morey ER,Sabelman EE,Turner RT,et al. A new rat model simulating some aspects of space flight[J]. Physiologist,1979,22:S23-24. |
| [6] | Machwate M,Zerath E,Holy X,et al. Systemic administration of transforming growth factor-beta 2 prevents the impaired bone formation and osteopenia induced by unloading in rats[J]. J Clin Invest,1995,96:1245-1253. |
| [7] | Keila S,Kelner A,Weinreb M. Systemic prostaglandin E2 increases cancellous bone formation and mass in aging rats and stimulates their bone marrow osteogenic capacity in vivo and in vitro[J]. J Endocrinol,2001,168:131-139. |
| [8] | Guo BS,Cheung KK,Yeung SS,et al. Electrical stimulation influences satellite cell proliferation and apoptosis in unloading-induced muscle atrophy in mice[J]. PLoS One,2012,7:e30348. |
| [9] | Martin EA,Ritman EL,Turner RT. Time course of epiphyseal growth plate fusion in rat tibiae[J]. Bone,2003,32:261-267. |
| [10] | Judex S,Garman R,Squire M,et al. Genetically linked site-specificity of disuse osteoporosis[J]. J Bone Miner Res,2004,19:607-613. |
| [11] | Sakai A,Nakamura T. Changes in trabecular bone turnover and bone marrow cell development in tail-suspended mice[J]. J Musculoskelet Neuronal Interact,2001,1:387-392. |
| [12] | Falcai MJ,Louzada MJ,de Paula FJ,et al. A modified technique of rat tail suspension for longer periods of observation[J]. Aviat Space Environ Med,2012,83:1176-1180. |
| [13] | Lau RY,Guo X. A review on current osteoporosis research:with special focus on disuse bone loss[J]. J Osteoporos,2011,2011:293808. |
| [14] | Cowles EA,Kovar JL,Curtis ET,et al. Near-infrared optical imaging for monitoring the regeneration of osteogenic tissue-engineered constructs[J]. Biores Open Access,2013,2:186-191. |
| [15] | Jing D,Cai J,Wu Y,et al. Moderate-intensity rotating magnetic fields do not affect bone quality and bone remodeling in hindlimb suspended rats[J]. PLoS One,2014,9:e102956. |
| [16] | Kang WB,Cong Y,Ru JY,et al. Osteoprotective effect of combination therapy of low-dose oestradiol with G15, a specific antagonist of GPR30/GPER in ovariectomy-induced osteoporotic rats[J]. Biosci Rep,2015,35:e00239. |
| [17] | Oheim R,Beil FT,Barvencik F,et al. Large animal models of osteoporosis[J]. Osteologie,2011,20:41-49. |
| [18] | Conti MI,Martinez MP,Olivera MI,et al. Biomechanical performance of diaphyseal shafts and bone tissue of femurs from hypothyroid rats[J]. Endocrine,2009,36:291-298. |
| [19] | Shahnazari M,Wronski T,Chu V,et al. Early response of bone marrow osteoprogenitors to skeletal unloading and sclerostin antibody[J]. Calcif Tissue Int,2012,91:50-58. |
| [20] | Ziambaras K,Civitelli R,Papavasiliou SS. Weightlessness and skeleton homeostasis[J]. Hormones:Athens,2005,4:18-27. |
| [21] | Aguirre JI,Plotkin LI,Stewart SA,et al. Osteocyte apoptosis is induced by weightlessness in mice and precedes osteoclast recruitment and bone loss[J]. J Bone Miner Res,2006,21:605-615. |
| (收稿日期:2016-01-20) |

