骨纤维异常增生症是一种因体细胞G蛋白α亚单位突变所致的罕见的先天性非遗传性良性骨病,临床主要表现为骨骼系统异常,同时并发内分泌功能亢进或皮肤牛奶咖啡斑者,称为McCune Albright综合征。FD本身为良性骨病,且病情一般在成人趋于稳定,但在罕见情况下可发生恶变,且预后极差,主要死因为局部复发和转移。本文报道1例诊断为MAS的青年女性,FD骨骼病变在短期内加重,手术病理证实为FD骨肉瘤变,旨在提醒临床医生当FD患者出现骨骼病变部位肿胀、疼痛加重时需高度警惕FD恶变可能。
病例摘要患者女性,31岁,出生日期1978年7月22日,因“皮肤色素沉着31年,月经来潮25年,骨骼畸形22年,下颌骨病变加重1年余”于2009年4月1日入住本院。患者为第二胎第二产,母亲妊娠期无特殊疾病及用药史,足月头位顺产。出生1个月时发现耳后、右臂、颈背部、臀部多发斑片状不规则色素沉着,随年龄增长,颜色有所加深。6岁时月经来潮,1~2年1次,当时无乳房发育,无阴毛、腋毛生长,生长速度与同龄儿相当,未诊疗。12岁起月经规律,每月1次,并出现乳房发育及阴毛、腋毛生长。9岁时出现右小腿胫前局部疼痛伴局部皮温略高,无明显红肿,后局部出现2 cm×2 cm质硬隆起包块,压痛明显伴皮温增高。9岁时一次玩耍中摔倒,右侧小腿磕在水泥台阶上后局部疼痛剧烈,当地医院行X线检查结果提示“右侧胫腓骨骨折,右侧胫腓骨纤维囊性改变”,予以夹板固定,休养数月后,可正常行走,仍间断有右下肢疼痛,不影响活动,无跛行,未再进一步诊治。12岁时,患者出现下颌部剧烈疼痛,影响睡眠,局部可触及一质硬包块,压痛明显,并逐渐增大。12岁起,患者反复出现全身多发骨痛,包括肋骨、双手、双足、右下肢,负重、活动时疼痛加重,疼痛剧烈时需使用止痛药,并逐渐出现肋骨局部隆起,双手关节变形,双足远端趾间关节增粗变形。15岁时,患者下颌部包块破溃,流出大量咖啡样液体,无特殊气味,当地医院予以抗感染治疗后破溃处愈合,曾行X线片(图 1)示:双侧颌骨正常形态消失,呈膨胀样改变。18岁时,患者外伤后出现右股骨骨折,X线提示右股骨纤维囊性改变,予以钢板固定,1年后取钢板时再次出现右股骨骨折,予以手术治疗,手术后开始服用钙剂。19岁时患者下颌肿物长至7~8 cm,口唇可闭合,此后肿物大小基本稳定,无明显增长。期间仍间断有全身多发骨痛,未进一步诊治。2008年10月以来,无明显诱因下颌肿物进行性增大,疼痛明显,局部皮温增高,面部被明显拉长,牙齿错位,下唇肿胀明显,曾就诊于外院查血碱性磷酸酶(alkaline phosphatase,ALP)1 044 U/L,丙氨酸氨基转移酶(alanine aminotransferase,ALT) 33 U/L,肌酐(creatinine,Cr)54 μmol/L。颌面CT及三维重建(图 2):双侧颌骨、颞骨、蝶骨、额骨、左侧颧骨正常结构消失,呈膨胀样、磨玻璃样改变,下颌骨颌部异常膨大,内见软组织肿块。胫腓骨正侧位影像与检查(图 3):胫腓骨呈膨胀样改变,骨质内密度不均。建议其行手术治疗,患者拒绝。近1月下颌部肿块疼痛明显,口唇闭合困难,需要使用止痛药物。2009年3月于北京协和医院门诊,查血生化:ALP 1 525 U/L,ALT 19 U/L,谷氨酸氨基转移酶(glutamyl transferase,GGT)116 U/L,Cr 58 μmol/L,血钙(serum calcium,Ca)2.39 mmol/L,血磷(serum phosphate,P)0.93 mmol/L。垂体MRI:颅骨多发异常增厚,符合骨纤维异常增生样表现,余未见明显异常。发病以来,身高无明显改变,无头痛、视力改变,精神、食欲可,睡眠较差,大小便正常,体质量无明显变化。既往史:自幼身高、体质量生长与同龄人比较略偏小,体力较差,间断于活动时出现乏力、口唇青紫,喜蹲踞,不易感冒,6岁时在当地医院诊断“先天性心脏病”,未治疗。G0P0。家族史无特殊。
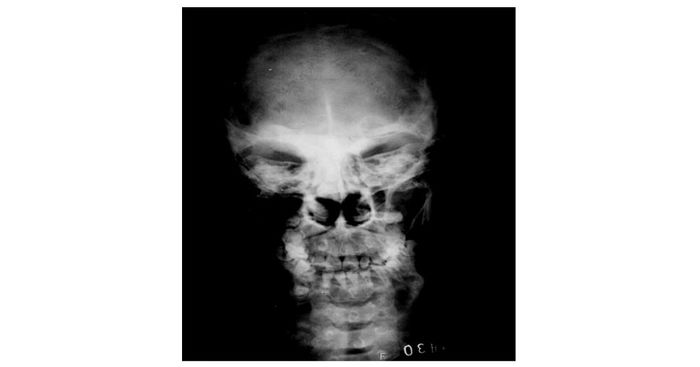
|
| 图 1 1993年头颅X线 Figure 1 Cranial X-ray film in 1993 |
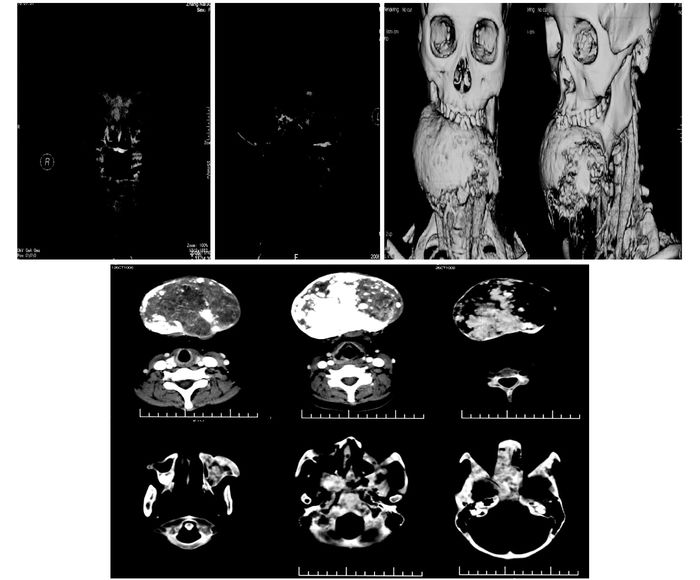
|
| 图 2 2008年下颌骨X线、CT三维重建及下颌骨冠状位CT片 Figure 2 Mandibular X-ray films and three-dimensional reconstruction in CT scan and mandibular coronal CT slices in 2008 |
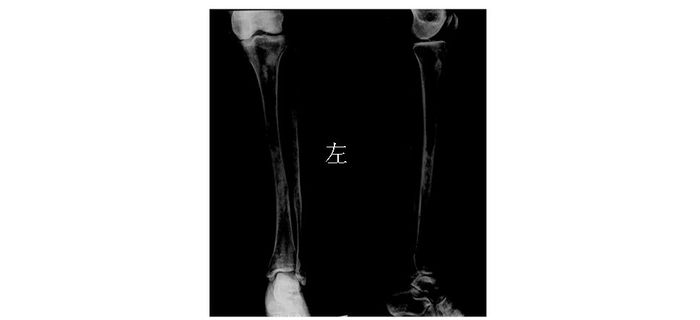
|
| 图 3 2008年双侧胫腓骨X线片 Figure 3 Bilateral tibia and fibula X-ray film in 2008 |
入院查体:身高(height,Ht) 158 cm,体质量(weight,Wt) 50 kg,体质量指数(body mass index,BMI) 20.0 kg/m2,心率(heart rate,HR) 80次/min,血压(blood pressure,BP)120/80 mmHg(1 mmHg=0.133 kPa),皮肤干燥、粗糙。右臂、颈背部、臀部可见不规则斑片状色素沉着(图 4)。下颌部可见一15 cm×11 cm×7 cm肿物,面部较长,牙裂错位,咬合关系紊乱,下唇肿胀,口唇不能闭合。胸廓双侧不对称,可见多处隆起,轻压痛,胸廓挤压痛(+)。胸骨左缘第二肋间可闻及粗糙收缩期杂音。外阴无异常。双手关节畸形,双足远端趾间关节增粗变形。
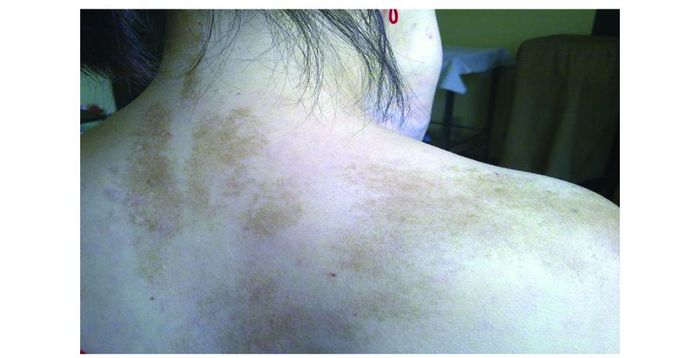
|
| 图 4 牛奶咖啡斑(颈背部) Figure 4 Café-au-lait pigmentation(neck and back) |
诊治经过:血、尿常规无异常。血生化:ALP 1 340 U/L,Cr 61 μmol/L,Ca 2.32 mmol/L,P 0.98 mmol/L,甲状旁腺素(parathyroid hormone,PTH) 50.2 pg/mL,游离钙(实测值) 1.10 mmol/L。24 h尿钙35.3 mg,24 h尿磷397.1 mg。骨扫描:全身骨骼多发异常放射性增高及减低区,下颌骨肿物可见示踪剂摄取,其内放射性分布不均匀,符合骨纤维异常增生症。骨盆及双手正位X线片检查(图 5):骨盆组成骨、双侧股骨颈及股骨上段、双侧多个掌骨及指骨骨质形态不规则,可见多发骨质膨胀样改变,骨皮质变薄,髓腔密度增高,骨质密度不均,符合骨纤维异常增生症。骨密度示腰椎及右股骨骨密度在正常范围。垂体前叶功能:胰岛素样生长因子-1、甲状腺激素、性腺激素、促肾上腺皮质激素及血尿皮质醇水平正常。心脏超声:先天性心脏病,房间隔缺损(Ⅱ孔型,左向右分流),右室增大(横径44 mm),轻度肺动脉高压,少量心包积液,左心室射血分数(left ventricular ejection fraction,LVEF) 59%。治疗:予以扶他捷对症止痛,患者仍间断主诉下颌部胀痛。2009年4月8日予以唑来膦酸(择泰)4 mg静脉输注,过程顺利,1周后复查ALP降至1 186 U/L。先天性心脏病方面,患者活动耐量基本正常,请内科会诊建议随诊检测B型钠尿肽(type B natriuretic peptide,BNP)。2009年5月12日于口腔医院行下颌肿物切除术,病理为“骨纤维异常增生症恶变,恶变成分为骨肉瘤”。术后回当地,2009年7月复查ALP 520 U/L,2009年8月发现下颌部位软组织及淋巴结转移,随后发现肺转移,2010年死亡。
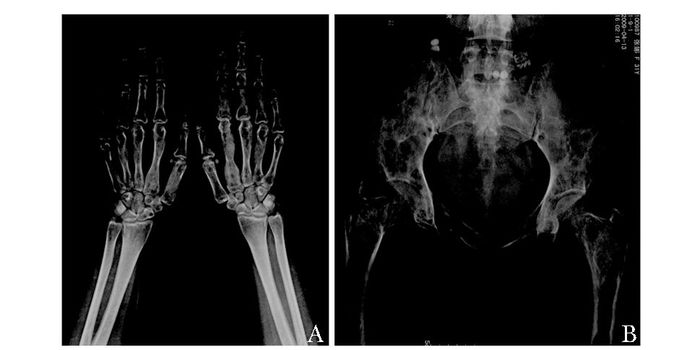
|
| 图 5 2009年X线片 Figure 5 X-ray films in 2009 A:双手;B:骨盆正位X线 |
诊断:McCune-Albright综合征;多骨型骨纤维异样增生症(FD)伴下颌骨肉瘤样变;牛奶咖啡斑;性早熟;先天性心脏病;房间隔缺损。
讨论本例临床特点:患者青年女性,自幼起病,慢性病程,主要有三方面的临床表现:(1) 皮肤色素沉着:出生不久即发现全身多发斑片状棕色色素沉着,身体近中线两侧均有,以右侧为主;(2) 内分泌腺功能异常:6岁时出现月经初潮,提示性早熟,目前内分泌功能检查基本正常;(3) 骨畸形:9岁开始出现多部位骨痛、骨畸形,并多次骨折,主要累及右下肢、肋骨、双手、双足、颅面骨,呈多骨型病变;其中以颌骨病变为重,局部肿物形成,30岁起下颌肿物进行性增大、伴疼痛和局部皮温升高。X线及CT检查结果提示多发骨正常结构消失,呈膨胀样改变,近期查血ALP明显升高,血钙、磷、PTH均正常。结合患者典型的三联征,MAS诊断明确。最终下颌骨手术病理证实为FD骨肉瘤变。
骨纤维异常增生症为罕见的先天性非遗传性良性骨病,发生机制为体细胞G蛋白α亚单位突变,该突变导致GTP酶活性的抑制,持续刺激腺苷环化酶,导致cAMP的过度合成,引起成骨细胞增生及分化异常,主要临床表现为骨痛、骨畸形和病理性骨折;并可引起内分泌器官功能亢进,从而出现多系统症状。FD分单骨型和多骨型两种,多骨型中同时伴有内分泌器官功能亢进和皮肤色素沉着斑者称为MAS。
通常FD病变在成年后趋于稳定。该患者12岁时即出现下颌骨病变,局部疼痛、包块形成,15岁时曾出现包块破溃,19岁时下颌骨肿块体积趋于稳定,曾行X线检查提示下颌骨病变符合FD表现。但其特殊之处为近半年(30岁起)无诱因下颌骨肿块进行性增大,疼痛明显伴局部皮温增高,有咬合紊乱和面部畸形,血ALP处于高水平。主要考虑两种可能:骨纤维异常增生症恶变及囊肿退行性变。该患者短期内下颌骨肿块进行性增大、疼痛肿胀明显,血ALP水平较高,经双膦酸盐治疗后血ALP水平有所下降,首先考虑下颌骨恶变的可能性大。最终该患者下颌骨手术病理证实为FD肉瘤样变,且术后ALP水平进一步显著下降。但术后很快出现局部软组织及淋巴结、肺部转移,最终死亡。
FD恶变率低,国内外不同研究中心的结果不同(表 1),国内为0.93%~4.2%[1-3],国外为2.5%~3.1%[4-5],因多数患者在出现症状后就诊,故其实际恶变率可能较此更低;其恶变在多骨型FD中更多见;有研究认为并发MAS或Mazabraud综合征(FD并发肌内黏液瘤或MAS并发肌内黏液瘤)者恶变率更高[6-8];目前的研究提示FD恶变无性别倾向。恶变可能的诱因有放射治疗、手术刺激和局部复发。有研究认为发生在颌面部的FD恶变与放射治疗有关[9-10],但一些大样本研究发现多数FD恶变患者并无先前放射治疗史,提示放射治疗并非FD恶变的必需因素。另有研究提示FD恶变多发生在其囊性扩张的部位,Qu等[3]研究发现恶变的患者一半有FD前期手术史,先前也有研究者认为手术刺激(包括骨移植和内固定)的部位,为引发间质干细胞发生肿瘤的场所[11-12]。也有研究者认为妊娠时的高骨转换及并发肢端肥大症均为FD恶变的诱因[13]。该患者并未找到恶变的可能诱因,考虑为FD自发转化为骨肉瘤。FD恶变的临床表现包括:(1) 局部症状:进展迅速的疼痛、肿胀、压迫症状,内部出血、坏死,结构畸形,病理性骨折;(2) 全身症状:后期可出现食欲不振、低热、贫血、消瘦等消耗症状。其中,突发进行性加重的疼痛、肿胀需警惕为恶变的信号。有研究者曾认为FD患者ALP水平为预测疾病转归的一个指标[14-15]。Park等[14]研究发现FD患者行病灶部分切除术后血ALP水平升高提示疾病复发;而Ma等[15]研究认为FD患者术前血ALP水平并非提示预后的可靠指标。恶变可出现在儿童期或成人期,平均年龄为30~50岁。从初诊为FD到恶变的时间间隔变异较大,文献报告1~50余年不等,也有FD和肉瘤同时诊断的病例报告。恶变多发生在颅颌面骨、股骨、肱骨、胫骨、腓骨、盆骨,肋骨、肩胛骨相对少见;在颅面骨中,上颌骨多于下颌骨,且临近的骨质如蝶骨、颧骨、额骨也多有受累。组织类型可为单发的骨肉瘤、纤维肉瘤、软骨肉瘤和恶性纤维组织细胞瘤,也有个别报道为混合瘤[16-17]。
| 作者 | 恶变率 (恶变数/总FD数) | 多/单型比例 | 研究部位或 FD类型 | 男:女 | 恶变的平均年龄(岁) | FD初诊到恶变 时间间隔(年) (平均年限) |
| Xu等[1] | 4.2%(15/357) | 11:4 | 全身 | 3:2 | 36.5 | 15~39(25.1) |
| Cheng等[2] | 0.93%(3/324) | 3:0 | 颅颌面 | 2:1 | 46 | 20~50 |
| Qu等[3] | 2.77%(15/542)* | 4:10 | 单骨型FD | 8:2 | 46.5±15.9** | - |
| Hoshi等[4] | 3.1%(4/128) | 3:1 | 全身 | 3:1 | 39.8(28~46) | - |
| Ruggieri等[5] | 2.5%(28/1 122) | 9:19 | 全身 | 12:16 | -(18~66) | 1~52 |
| Huvos等[20] | 12例(-) | 6:6 | 全身 | 7:5 | - | - |
| 作者 | 恶变部位及例数 | 恶变前放射 治疗史 | 恶变组织病理类型 | 转归 | 随访时间 | |
| Xu等[1] | 股骨上段3例 股骨下段1例 胫骨上段2例 肱骨上段2例 肋骨2例 坐骨2例 髂/耻/肩胛骨各1例 | 0 | 骨肉瘤8例 纤维肉瘤5例 软骨肉瘤2例 | 共随访9例, 6例均在5年内先后死亡, 3例失访 | 1个月至5年 | |
| Cheng等[2] | 左上颌骨3例 | - | 骨肉瘤3例 | 2例分别在6个月、16个月时死于肿瘤,1例随访23个月为DFS | 6~23个月 | |
| Qu等[3] | 肱骨2例 胫骨3例 髂骨1例 | 0 | 骨肉瘤7例 纤维肉瘤2例 恶性纤维组织细胞瘤1例 | 1例死于肿瘤,1例有肺转移尚存活,1例复发,7例DFS | 9年 | |
| Hoshi等[4] | 胫骨2例 股骨干1例 肋骨1例 | 0 | 骨肉瘤2例 纤维肉瘤1例 恶性纤维组织细胞瘤1例 | 1例术后13个月死于肺部转移,3例DFS | 61.3个月(13~108个月) | |
| Ruggieri等[5] | 颅面骨13例 近端股骨7例 肱骨3例 骨盆2例 胫骨2例 肩胛骨1例 | 13(46%) | 骨肉瘤19例 纤维肉瘤5例 软骨肉瘤3例 恶性纤维组织细胞瘤1例 | 15例死亡,7例DFS,2例带瘤生存,4例失访 | 3~25个月 | |
| Huvos等[20] | 股骨5例 上颌骨3例 肱骨1例 肩胛骨1例 耻骨1例 腓骨1例 | 1 | 骨肉瘤8例 软骨肉瘤2例 恶性纤维细胞肉瘤2例 | 6例死亡 6例存活 | 1~13年 | |
| *15例变患者中缺乏影像学资料被排除;**80%为40岁以上;DFS:无病生存 | ||||||
典型的FD放射学表现为囊性变、硬化变和骨骼变形,多为无明显边界的磨玻璃样改变。恶变的X线表现为在FD的基本病变区内,出现斑点状或虫噬样溶骨性破坏,逐渐融合为囊样或不规则形透亮区,并逐渐扩大;原硬化边消失,骨皮质破坏、中断以至消失,并于病变区及邻近软组织内形成硬性肿块。其中,骨肉瘤在肿瘤区和软组织肿块内可见斑片状瘤骨,有时还可见放射状瘤骨;纤维肉瘤则常表现为肿瘤区骨结构完全消失,呈大片状溶骨性缺损,肿瘤区和软组织肿块呈中等密度;软骨肉瘤,在肿瘤区和巨大软组织肿块内常可见斑点状或环状肿瘤基质钙化。故怀疑FD恶变的患者行影像学检查或有一定提示意义。
FD本身为良性病变,且多在成年期发展静止,而FD恶变后的患者预后较差,主要死因为局部复发和转移。Cheng等[2]结果表明,平均随访23.8个月时,其总生存率为43.7%(14/32);Ruggieri等[5]研究表明,随访3月至25年不等,FD恶变的病死率为53.6%;因随访时间、队列大小不同,结果也不尽相同(表 1)。
目前,无FD根治及阻止其恶变的方法;故建议FD患者终生随访以早期发现恶变。恶变者治疗首选根治性手术,术后联合放化疗或可控制局部病变和提高总体生存率。
也有报道FD患者局灶出现进行性肿胀、疼痛,临床表现及影像学检查结果都支持为FD恶变,后来病理证实为囊肿退行性变[18]。鉴于FD恶变与其囊性退变表现重叠,要求我们在怀疑FD恶变时需除外囊性退变。
目前关于FD囊性退变相关的报道有限。Diah等[19]报道了1982-2005年的113例FD,10例诊断为囊肿退变(1例资料不完整),其中男性3例,女性6例,平均发病年龄14.9岁(出生~40岁),MAS 2例,退变发生时间为FD诊断后的1~7年(平均2.8年)。最常见的临床表现:包块突然增大(7/9,78%)、疼痛(6/9,67%),视力改变(4/9,44%);部位包括:蝶骨(3例)、额骨(3例,1例为蝶骨+额骨)最常见,其他为上颌骨1例,颅底1例,筛骨+下颌骨1例,枕骨+顶骨1例。病理包括单纯骨囊肿、动脉瘤样骨囊肿、非特异性囊肿退行性变。对于出现压迫症状和影响美观的患者具有手术指征[20]。
综上,FD患者在成年期仍有疾病活动或进展的可能。当局部出现进行性加重的疼痛、肿胀等病情变化时需高度警惕恶变或囊性退变可能。囊性退变可随诊观察,但当出现压迫症状或有美容要求者可行手术。FD恶变发生率低,但目前无较好治疗方法,病死率高。故FD患者无论多大年龄,均应密切随访,早期发现病情变化。
| [1] | Xu D, Luan H, Zhan A, et al. Spontaneous malignant transformation of fibrous dysplasia[J]. Chin Med J (Engl), 1996, 109: 941–945. |
| [2] | Cheng J, Yu H, Wang D, et al. Spontaneous malignant transformation in craniomaxillofacial fibrous dysplasia[J]. J Craniofac Surg, 2013, 24: 141–145. DOI:10.1097/SCS.0b013e3182646126 |
| [3] | Qu N, Yao W, Cui X, et al. Malignant transformation in monostotic fibrous dysplasia[J]. Medicine, 2015, 94: e369. DOI:10.1097/MD.0000000000000369 |
| [4] | Hoshi M, Matsumoto S, Manabe J, et al. Malignant change secondary to fibrous dysplasia[J]. Int J Clin Oncol, 2006, 11: 229–235. DOI:10.1007/s10147-006-0559-4 |
| [5] | Ruggieri P, Sim FH, Bond J R, et al. Malignancies in fibrous dysplasia[J]. Cancer, 1994, 73: 1411–1424. DOI:10.1002/(ISSN)1097-0142 |
| [6] | Lopez-Ben R, Pitt MJ, Jaffe KA, et al. Osteosarcoma in a patient with McCune-Albright syndrome and Mazabraud's syndrome[J]. Skeletal Radiol, 1999, 28: 522–526. DOI:10.1007/s002560050556 |
| [7] | Crawford EA, Brooks JS, Ogilvie CM. Osteosarcoma of the proximal part of the radius in Mazabraud syndrome. A case report[J]. J Bone Joint Surg Am, 2009, 91: 955–960. DOI:10.2106/JBJS.H.00212 |
| [8] | Jhala DN, Eltoum I, Carroll AJ, et al. Osteosarcoma in a patient with Mccune-Albright syndrome and Mazabraud's syndrome-a case report emphasizing the cytological and cytogenetic findings[J]. Hum Pathol, 2003, 34: 1354–1357. DOI:10.1016/j.humpath.2003.08.004 |
| [9] | Tanner HJ, Dahlin DC, Childs DJ. Sarcoma complicating fibrous dysplasia. Probable role of radiation therapy[J]. Oral Surg Oral Med Oral Pathol, 1961, 14: 837–846. DOI:10.1016/S0030-4220(61)80014-5 |
| [10] | Hansen MR, Moffat JC. Osteosarcoma of the skull base after radiation therapy in a patient with McCune-Albright syndrome-case report[J]. Skull Base, 2003, 13: 79–83. DOI:10.1055/s-2003-40597 |
| [11] | Picci P, Sieberova G, Alberghini M, et al. Late sarcoma development after curettage and bone grafting of benign bone tumors[J]. Eur J Radiol, 2011, 77(1): 19–25. DOI:10.1016/j.ejrad.2010.06.053 |
| [12] | Ramasamy R, Lam EW, Soeiro I, et al. Mesenchymal stem cells inhibit proliferation and apoptosis of tumor cells:impact on in vivo tumor growth[J]. Leukemia, 2007, 21: 304–310. DOI:10.1038/sj.leu.2404489 |
| [13] | Kanazawa I, Yamauchi M, Yano S, et al. Osteosarcoma in a pregnant patient with McCune-Albright syndrome[J]. Bone, 2009, 45: 603–608. DOI:10.1016/j.bone.2009.05.018 |
| [14] | Park BY, Cheon YW, Kim YO, et al. Prognosis for craniofacial fibrous dysplasia after incomplete resection-age and serum alkaline phosphatase[J]. Int J Oral Maxillofac Surg, 2010, 39: 221–226. DOI:10.1016/j.ijom.2009.12.008 |
| [15] | Ma J, Liang L, Gu B, et al. A retrospective study on craniofacial fibrous dysplasia_Preoperative serum alkaline phosphatase as a prognostic marker[J]. J Craniomaxillofac Surg, 2013, 41: 644–647. DOI:10.1016/j.jcms.2012.12.007 |
| [16] | Ebata K, Usami T, Tohnai I, et al. Chondrosarcoma and osteosarcoma arising in polyostotic fibrous dysplasia[J]. J Oral Maxillofac Surg, 1992, 50: 761–764. DOI:10.1016/0278-2391(92)90116-H |
| [17] | Beuerlein ME, Schuller DE, Deyoung BR. Maxillary malignant mesenchymoma and massive fibrous dysplasia[J]. Arch Otolaryngol Head Neck Surg, 1997, 123: 106–109. DOI:10.1001/archotol.1997.01900010116019 |
| [18] | Simpson AH, Creasy TS, Williamson DM, et al. Cystic degeneration of fibrous dysplasia masquerading as sarcoma[J]. J Bone Joint Surg Br, 1989, 71: 434–436. |
| [19] | Diah E, Morris DE, Lo LJ, et al. Cyst degeneration in craniofacial fibrous dysplasia:clinical presentation and management[J]. J Neurosurg, 2007, 107: 504–508. DOI:10.3171/JNS-07/09/0504 |
| [20] | Huvos AG, Higinbotham NL, Miller TR. Bone sarcomas arising in fibrous dysplasia[J]. J Bone Joint Surg Am, 1972, 54: 1047–1056. DOI:10.2106/00004623-197254050-00010 |
| (收稿日期:2016-11-16) |

