石蜡切片是组织学常规制片技术中最为广泛应用的方法。组织离开机体后很快就会死亡和产生组织腐败,失去原有正常结构,因此,组织要经固定、石蜡包埋、切片及染色等步骤使得其形态结构在显微镜下能被清晰辨认。既往有大量文献报道4%多聚甲醛固定组织的作用[1-2],传统大鼠骨组织固定采用4%多聚甲醛浸泡24 h[3],包埋常选择截断包埋,但上述处理方法是否就是保存组织结构,维持组织抗原高效检测的最佳方法,一直未见系统的报道。本文旨在探讨不同固定和包埋方法对大鼠骨组织完整性及免疫组化结果的影响。
材料与方法 实验动物8周龄SPF级雌性SD大鼠4只,体质量(180.0±8.5)g,由中南大学湘雅二医院实验动物中心提供。实验动物许可证号:SCXK(湘)2016-0002。
试剂与器材4%多聚甲醛,10% EDTA,均购自湖南帝优生物科技有限公司,兔多克隆OPG抗体购自英国Abcam公司(货号ab183910),即用型免疫组化试剂盒购自基因科技(上海)股份有限公司。
实验方法组织取材:2 %戊巴比妥钠(0.1 mL/100 g体质量)麻醉后,腹主动脉放血处死大鼠。取大鼠双侧股骨、胫骨,仔细分离周围附着的肌肉及结缔组织后,室温下将骨组织置于4%多聚甲醛溶液中固定。
分组:依据固定时间和包埋方法的不同分为:左侧股骨整段包埋组,左侧胫骨整段包埋组,右侧股骨截断包埋组,右侧胫骨截断包埋组;每组4例,分别固定1,2,3和4 d。
组织脱钙:脱钙液为10%乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA),4 ℃条件下脱钙4周,隔天更换1次脱钙液,待组织脱钙变软,以针刺能刺进为脱钙完全标准。
免疫组化:石蜡包埋后切片,切片4 μm厚,常规脱蜡至水,微波抗原修复,免疫组化采用SABC法,检查骨组织中骨保护素(osteoprotegerin, OPG)蛋白的表达。
吸光度值检测:使用激光扫描显微镜Fluoview FV3000(Olmypus公司,日本)及其配套的成像软件采集图像,每组在100倍光镜下随机采集2次免疫组化的结果图像,每次采集10个共计20个不同部位的图像,Meta Morph图像分析软件(Universal Imaging Corporation,美国)测定免疫组化阳性区域的吸光度值。数据结果直接输出至Excel表中,进行统计学处理[4]。
统计学方法采用SPSS 19.0统计软件包进行统计学分析。计量资料以均数±标准差(x±s)表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结果 不同固定和包埋方法对骨组织结构的影响脱钙试验结果显示,整段包埋股骨、胫骨浸泡在10%EDTA脱钙液中27 d至完全软化,针刺能刺进,截断包埋股骨、胫骨浸泡在10% EDTA脱钙液中24±1 d至完全软化,针刺能刺进,整段包埋和截断包埋脱钙时间差异无统计学意义。HE染色显示,整段包埋和截断包埋的股骨和胫骨,骨小梁周边组织结构均较为完整,截断包埋的骨组织细胞结构破坏相对严重;从固定的时间比较,整段包埋的股骨和胫骨固定3 d HE染色的结果较固定1、2和4 d更为清晰(图 1)。
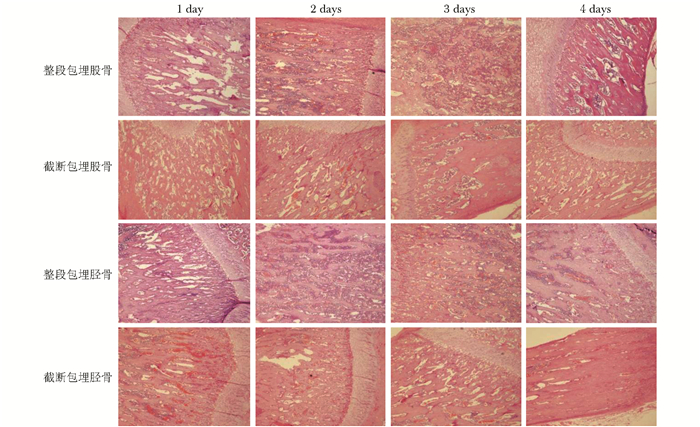
|
| 图 1 各组骨组织HE染色结果(×40) Figure 1 HE staining of all groups (×40) |
免疫组化结果显示,显微镜下OPG染色为深褐色细颗粒状,主要位于成骨细胞和骨髓基质干细胞胞质及细胞间质中(图 2)。软件分析免疫组化染色吸光度值结果显示,整段包埋的股骨和胫骨中的OPG吸光度值,在固定1、2、3和4 d均显著高于相应截断包埋的吸光度值,差异有统计学意义(P<0.05);整段包埋的股骨和胫骨吸光度值均在固定3 d时达到最高峰值,显著高于1、2和4 d的吸光度值,差异有统计学意义(P<0.05);比较固定3 d时整段包埋的股骨吸光度值与整段包埋的胫骨吸光度值,整段包埋的胫骨吸光度值显著高于股骨,差异有统计学意义(P<0.05)(表 1)。
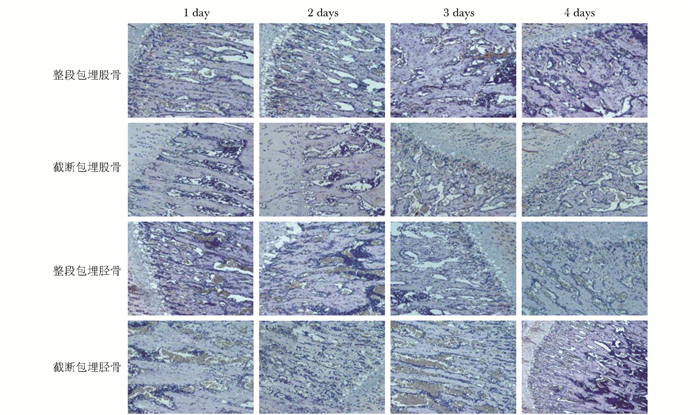
|
| 图 2 各组大鼠骨组织中OPG蛋白免疫组化结果(×100) Figure 2 Immunohistochemical staining of OPG in all groups (×100) OPG:骨保护素 |
| 组别 | 固定1 d | 固定2 d | 固定3 d | 固定4 d |
| 整段包埋股骨 | 4.52±0.30* | 4.42±0.40* | 8.66±0.30# | 0.21±0.10* |
| 截断包埋股骨 | 0.07±0.10* | 0.18±0.20* | 1.67±0.20 | 0.11±0.10* |
| 整段包埋胫骨 | 6.45±0.50* | 6.09±0.20* | 9.66±0.40△ | 0.08±0.10* |
| 截断包埋胫骨 | 0.08±0.10 | 0.06±0.10 | 0.05±0.10 | 0.05±0.10 |
| 同一根骨头与固定3 d相比,*P<0.05;与固定3 d截断包埋股骨组相比,#P<0.05;与固定3 d截断包埋股骨组比,△P<0.05 | ||||
在组织学的常规制片技术中,石蜡切片是应用最广的一种方法[5],该方法不仅能够保存正常细胞组织的结构形态,还能够在病理学中进行定量分析。石蜡切片需要对组织进行固定、包埋、切片等操作,从而能够对组织细胞的结构形态进行清晰的辨别。在制作骨组织切片时,因其钙盐沉积、致密坚硬,在实际操作过程中,常会因固定的溶液浸泡时间或包埋处理方法不当,破坏骨组织的结构[6]。本实验旨在探讨固定时间和包埋方法的不同对大鼠骨组织形态和免疫组化结果的影响。
本实验发现,固定后整段包埋的股骨、胫骨,后期切片质量最好,组织无裂开、破碎现象,HE染色清楚,骨组织结构保持完整。其中股骨和胫骨在固定3 d时免疫组化染色效果最佳,阳性信号定位准确。而截断包埋的骨头,HE染色显示骨小梁周细胞结构破坏严重,免疫组化染色效果欠佳。这可能是由于大鼠骨组织体积较大,传统包埋方式为截断后包埋,但截断过程中的压迫与外力作用常会破坏骨髓腔的正常结构,造成骨髓腔正常结构消失。此外,骨组织含有大量钙盐沉淀而为最坚硬的结缔组织[7-8],短时间内(数小时)4%多聚甲醛固定液常难以透过骨皮质进入骨髓腔,从而影响固定的效果。而长时间的固定,组织蛋白质发生交联,封闭了大量的抗原决定簇从而影响了抗原抗体反应[4, 9],致后续免疫组化检查出现假阴性。
综上所述,整段包埋和截断包埋大鼠股骨和胫骨均能较好的保存骨小梁组织结构和组织抗原性,固定3 d为相对最佳固定时间。相比股骨,胫骨抗原性和组织结构等够得到更好地保存。这为动物骨组织切片实验如何更合理地处理标本,提供了一个较为可靠的选择依据。
| [1] | Hosoya A, Hoshi K, Sahara N, et al. Effects of fixation and decalcification on the immunohistochemical localization of bone matrix proteins in fresh-frozen bone sections[J]. Histochem Cell Biol, 2005, 123: 639–646. DOI:10.1007/s00418-005-0791-4 |
| [2] | Frank JD, Balena R, Masarachia P, et al. The effects of three different demineralization agents on osteopontin localization in adult rat bone using immunohistochem-istry[J]. Histochemistry, 1993, 99: 295–301. DOI:10.1007/BF00269102 |
| [3] | 张大贵, 林小芳, 张普, 等. 三种脱钙液对骨组织免疫组化染色的影响[J]. 中国现代医生, 2012, 50: 101–103. |
| [4] | 崔巍, 王硕仁, 朱陵群, 等. 平均吸光度值分析法和阳性染色面积分析法在免疫组化图像分析中的对比研究[C]. 中华中医药学会内科分会中医内科学科建设研讨会论文集, 2008: 148-151. |
| [5] | 施恩青. 改良与常规石蜡切片方法在切片质量方面的比较[J]. 齐齐哈尔医学院学报, 2014, 35: 2442–2443. |
| [6] | 张明超, 郑春霞, 黄倩, 等. 肾组织石蜡切片免疫荧光染色的新方法[J]. 肾脏病与透析肾移植杂志, 2011, 20: 296–300, 254. DOI:10.3969/j.issn.1006-298X.2011.03.020 |
| [7] | 关凯, 张立仁, 郑永军, 等. 改良非脱钙骨塑料包埋、切片、染色方法[J]. 诊断病理学杂志, 2004, 11: 73–104. |
| [8] | 赵刚, 杨海贤, 白景文, 等. 不脱钙骨组织标本超薄切片的制作方法[J]. 临床与实验病理学杂志, 2005, 20: 360–361. DOI:10.3969/j.issn.1001-7399.2005.03.031 |
| [9] | 许燕云, 姜汉国, 吴艳霞. 不同抗原修复方法对cyclin B1在肿瘤中表达的比较[J]. 诊断病理学杂志, 2004, 11: 78–103. DOI:10.3969/j.issn.1007-8096.2004.02.005 |
| (收稿日期:2017-05-05) |

