2. 200233 上海,上海交通大学附属第六人民医院骨质疏松和骨病专科;
3. 030001 太原,山西医科大学第一医院内分泌科
进行性骨化性纤维结构不良(fibrodysplasia ossificans progressiva,FOP; OMIM135100),亦称进行性骨化性肌炎(myositis ossificans progressiva,MOP),是一种罕见的常染色体显性遗传性、进行性结缔组织病,主要临床特征为先天性双侧拇趾畸形(主要为拇趾短而大且外翻)和全身软组织进行性异位骨化。该病多以散发为主,1982年Connor等[1]提出该病在英国的患病率为1:1 640 000,目前全世界确诊FOP患者约800例[2],中国目前尚无关于该病患病率的报道。FOP是由于ACVR1/ALK2(activin receptor type IA/activin-like kinase 2,MIM102576)基因突变所致,其中甘氨酸-丝氨酸激活区域中c.617G>A(p.R206H)是该病的热点突变位点。
FOP作为罕见病,临床上较少见,常被误诊,患者也因此接受一些可能会加重异位骨化的不必要之创伤性诊断性操作。本文对1例仅3岁的FOP患者进行基因突变分析并进行临床探讨。
对象与方法 对象患者,女,3岁,汉族,四川籍。因“颈背部多发结节伴颈部活动僵硬7个月”于2014年11月就诊于上海交通大学附属第六人民医院骨质疏松与骨病专科。患儿9个月前因患小儿肺炎,静脉点滴7 d治愈后约1个月其颈部出现一圆形结节,约花生粒大小,质硬,不活动,此后肩背部逐渐出现多个类似结节。
7个月前在外院行结节穿刺活检示“少量纤维状细胞及黏液样物质”。患者具有先天性双拇趾轻微缩短伴拇外翻畸形。患儿为第1胎足月剖腹产,发育正常,牙齿毛发无异常,听力无异常。患儿无外伤史。父母健康、非近亲结婚,家族中无类似疾病史。根据先天性双拇趾轻微缩短伴拇外翻畸形和进行性异位骨化这两个经典的临床表现,拟诊:进行性骨化性纤维结构不良症。在检查前家属签署知情同意书。
方法抽取患者及其父母外周静脉血2 ml并用异丙醇沉淀法抽提DNA,检测其吸光光度值及浓度。通过数据库(Gene-Bank accession no.NC_000002)获得ACVR1基因DNA序列。用在线Primer3软件(http://bioinfo.ut.ee/primer3-0.4.0/)设计ACVR1基因全编码外显子引物,共14对(由上海天昊公司提供)。PCR反应体系(共20 μL):1×热启动Taq酶缓冲液(Qiagen公司,德国),每一对引物0.2 μmol/L,模版DNA 1μL。PCR反应条件为:95 ℃预变性2 min,94 ℃变性20 s,57 ℃退火30 s,72 ℃延伸1 min,共35个循环,72 ℃延伸2 min。PCR产物经虾碱酶(shrimp alkaline phosphatase,SAP)(Promega公司,美国)和外切酶Ⅰ(exonuclease,EXO Ⅰ)(Epicentre公司,上海)纯化后用BigDye3.1试剂盒和ABI3730XL测序仪(ABI公司,美国)测序,并用Polyphred软件分析测序结果。
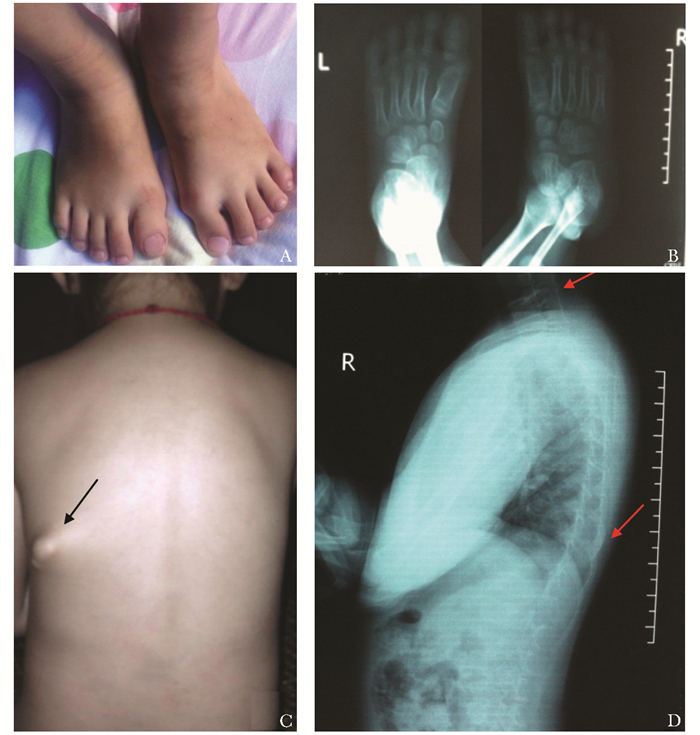
结果 辅助检查结果体格检查:患者身高93 cm,体质量15 kg,双肩及颈部活动僵硬,左肘关节弯曲受限,其颈部、背部、上臂和胸壁可触及多个硬性结节。双侧拇趾轻微缩短,拇外翻畸形(图 1)。胸廓及胸腰椎无畸形。B超示右侧胸锁乳突肌内结节约4.5 cm×1.5 cm;左上臂皮下软组织肌层病变范围约4.4 cm×1.1 cm;右侧胸壁浅肌层内结节约3.2 cm×0.7 cm;背部浅肌层内可见3处病变,范围约3.2 cm×0.8 cm,1.8 cm×0.6 cm,1.1 cm×0.6 cm。颈胸部CT示肿物内散在不规则钙化影。足部X线片提示双足第一趾骨及拇趾近节趾骨畸形(图 1B)。颈胸段X线片提示颈椎融合及胸椎异位骨化形成(图 1D)。实验室检查示血钙、血磷、甲状旁腺激素、碱性磷酸酶、血肌酐和尿素氮均正常。
|
| 图 1 患者的临床表现 Fig 1 Clinical manifestations of patient A: 双足拇指趾轻微缩短并伴踇外翻畸形;B:足部X线示趾骨外翻畸形(箭头所示);C:背部异位骨化(箭头所示);D:X线示颈椎椎间隙变窄,背侧见圆形钙化(箭头所示) |
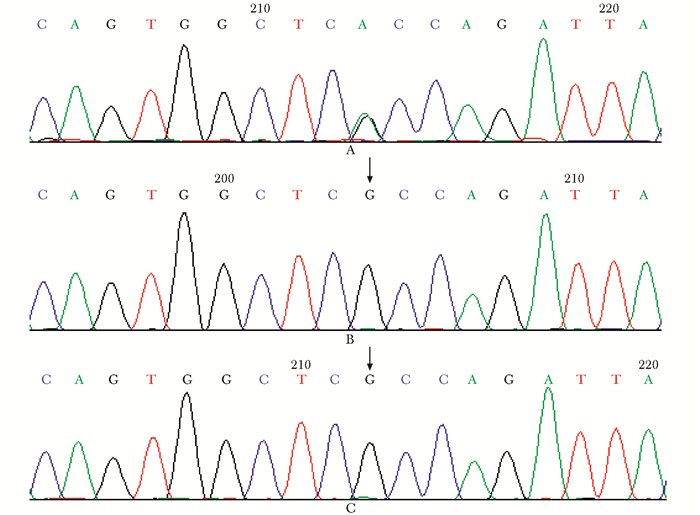
患者ACVR1基因突变检测鉴定出4个单核苷酸多态性(single nucleotide polymorphism,SNP)位点,1个突变位点,在第6外显子c.617G>A(NM_001111067.2)发生杂合错义突变,造成p.Arg206His(NP_001104537.1),并对其父母进行该位点检测,未发现存在该突变(图 2)。
|
| 图 2 患者及父母ACVR1第六外显子基因测序结果 Fig 2 DNA sequencing of the ACVR1 gene in patient and her parents A:先证者;B:先证者父亲;C:先证者母亲;先证者测序结果为ACVR1基因6号外显子上杂合错义突变c.206G>A(箭头所示),患者父母ACVR1基因6号外显子上均未发现突变位点 |
因此据上述临床表现和基因突变结果确诊为经典型进行性骨化性纤维结构不良症。
讨论FOP是一种非常罕见且高度致残的疾病,全世界发病率约1/200万,没有种族、性别和地域差异[1, 3],因此世界范围内多为个案报道。Sun等[4]第一次报道了中国FOP患者ACVR1基因突变,Zhang等[5]曾报道72例FOP患者。
FOP临床表现多样,经典型FOP有两个特征表现:先天性双拇趾畸形和全身软组织进行性异位骨化[6];且异位骨化常呈自发性,按从上至下,从背部到腹部,从中轴到四周发展并呈进行性加重[7]。本病例患者在出生时即有双拇趾轻微缩短伴拇外翻畸形,异位骨化首发于颈部,后逐渐发展为背部和胸腹部,病情呈进展性,肿块发生顺序与经典型FOP相同。非经典型FOP表现为:拇指畸形,股骨颈短而宽,胫骨近端骨软骨瘤,C2~C7颈椎融合,传导性听力损害,白内障等[2, 8]。异位骨化多发于10岁以内,出现炎性软组织肿块可伴疼痛,其后柔软的结缔组织包括肌腱、韧带、筋膜和骨骼肌逐渐变为成熟的骨组织,成为永久存在的网状异位骨,导致关节固定和僵硬,最终丧失活动能力。该患者因感染肺炎诱发炎性肿块,后骨化为第二骨骼,且有颈椎融合、僵硬。患者常在30岁左右因髋关节融合需坐轮椅,常因脊柱侧凸,肺功能不全和右心衰竭死于胸廓机能不全综合症(thoracic insufficiency syndrome,TIS)所致的并发症,死亡年龄中位数约40岁[9]。
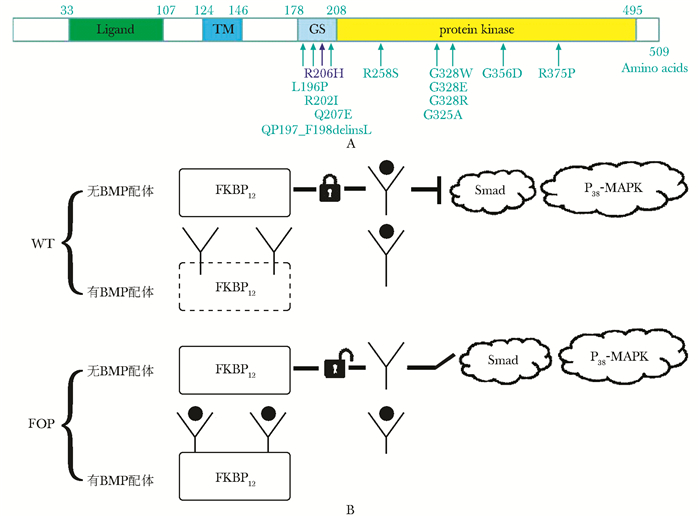
虽然FOP是一种相当古老的疾病,但直到2006年Shore等[6]才将致病基因定位于染色体2q23-q24,此区域中ACVR1基因为FOP的致病基因,且c.617G>A(R206H)突变为热点突变。ACVR1/ALK2是编码转化生长因子β(transforming growth factor-beta,TGF-β)或骨形态发生蛋白(bone morphogenetic protein,BMP)的Ⅰ型丝/苏氨酸跨膜受体,分为4个结构域:BMP配体结合域,单跨膜域(TM),甘氨酸-丝氨酸激活域(glycine-serine,GS)和蛋白激酶域(图 3),而经典突变位点c.617G>A位于GS域。在缺乏BMP配体时,免疫抑制剂FK506结合蛋白12(FKBP12)与ACVR1结合,形成“close”结构,抑制ACVR1与Ⅱ型BMP受体结合;但存在BMP配体时,FKBP12又可促进泛素相关性ACVR1降解,以维持基础状态时ACVR1水平。而FOP患者发生R206H突变,FKBP12不能与突变型ACVR1结合,在无配体时形成“open”结构,BMP信号Smad通路开放,BMP信号的抑制作用被解除;在有配体时与ACVR1结合呈高反应性,导致配体依赖性ACVR1激活(图 3)。有研究表明ACVR1在骨骼肌和软骨中都有表达,持续性激活会诱导C2C12细胞中碱性磷酸酶活性增高,使BMP4表达上调,引起异位软骨形成和持续性关节融合,表明ACVR1参与的BMP信号通路的异常激活会诱导未分化的间充质细胞分化为软骨和骨[6]。
|
|
图 3
ACVR1蛋白结构域和BMP信号激活机制
Fig 3
Schematic of ACVR1 protein and BMP pathway
A:ACVR1蛋白主要4个结构域及所有的突变位点,经典突变位点R206H位于GS激活域,所有已知的突变位点主要位于GS激活域和蛋白激酶域(引自Hüning I |
由于FOP是罕见病,临床医师很难将进行性异位骨化与先天性拇趾畸形联系起来,因此FOP常被误诊为青少年纤维瘤病、神经纤维瘤病、软组织肉瘤等,且在世界范围内FOP的误诊率达达到90%[10],中国报道的病例中误诊率达到92%[5],患者也因此接受不必要的创伤性检查或治疗进而加重异位骨化。同时对已经出现异位骨化的患者,应与进行性骨化性异位增生症(progressive osseous heteroplasia,POH; OMIM 166350)进行鉴别。FOP与POH均为常染色体显性遗传,均有异位骨形成。但POH为膜内成骨,而FOP主要为软骨内成骨;POH无拇趾畸形而FOP有先天性拇趾畸形;POH致病基因为GNAS,FOP致病基因为ACVR1[11]。
目前针对FOP患者尚无有效的预防和治疗手段,主要措施为早期诊断,避免跌倒受伤。本文患者因年龄较小,一般情况良好,应主要避免软组织创伤、组织活检、流感病毒感染、肌注及跌倒等,并定期随诊避免异位骨化的进一步发展。在炎症期可应用非甾体类抗炎药、环氧化酶抑制剂、白三烯抑制剂等,重症者可用糖皮质激素。虽然免疫抑制剂可以抑制异位骨化,但由于其严重的不良反应目前不推荐作为常规用药,而骨髓移植已被证明对治疗FOP无效[11]。虽然手术可以摘除异位骨化,但往往会在手术部位暴发新生骨[9]。虽有研究表明综上所述的干预措施对预防和治疗FOP有一定疗效,但疗效评估都是基于个案或少数病例研究,缺少临床对照研究证明。
综上所述,经典型FOP伴有先天性双拇趾畸形和全身软组织的异位骨化。但对婴幼儿病例诊断尤为困难。对疑似患者应进行基因检测以明确诊断。目前仍无特效治疗,确诊后应避免一切软组织创伤和医源性损害。
| [1] | Connor JM,Evans DA. Genetic aspects of fibrodysplasia ossificans progressiva [J]. J Med Genet,1982,19: 35-39. |
| [2] | Huning I,Gillessen-Kaesbach G. Fibrodysplasia ossificans progressiva: clinical course,genetic mutations and genotype-phenotype correlation [J]. Mol Syndromol,2014,5: 201-211. |
| [3] | Shore E,Feldman G,Xu M,et al. The genetics of fibrodysplasia ossificans progressiva [J]. Clin Rev Bone Miner Metab,2005,3: 201-204. |
| [4] | Sun Y,Xia W,Jiang Y,et al. A recurrent mutation c.617G>A in the ACVR1 gene causes fibrodysplasia ossificans progressiva in two Chinese patients [J]. Calcif Tissue Int,2009,84: 361-365. |
| [5] | Zhang W,Zhang K,Song L,et al. The phenotype and genotype of fibrodysplasia ossificans progressiva in China: a report of 72 cases [J]. Bone,2013,57: 386-391. |
| [6] | Shore EM,Xu M,Feldman GJ,et al. A recurrent mutation in the BMP type I receptor ACVR1 causes inherited and sporadic fibrodysplasia ossificans progressiva [J]. Nat Genet,2006,38: 525-527. |
| [7] | Kaplan FS,Xu M,Glaser DL,et al. Early diagnosis of fibrodysplasia ossificans progressiva [J]. Pediatrics,2008,121: e1295-1300. |
| [8] | Kaplan FS,Xu M,Seemann P,et al. Classic and atypical fibrodysplasia ossificans progressiva (FOP) phenotypes are caused by mutations in the bone morphogenetic protein (BMP) type I receptor ACVR1 [J]. Hum Mutat,2009,30: 379-390. |
| [9] | Kaplan F,Glaser D. Thoracic insufficiency syndrome in patients with fibrodysplasia ossificans progressiva [J]. Clin Rev Bone Miner Metab,2005,3: 213-216. |
| [10] | Pignolo RJ,Shore EM,Kaplan FS. Fibrodysplasia ossificans progressiva: diagnosis,management,and therapeutic horizons [J]. Pediatr Endocrinol Rev,2013,10: 437-448. |
| [11] | Kaplan FS,Shore EM. Progressive osseous heteroplasia [J]. J Bone Miner Res,2000,15: 2084-2094. |
| (收稿日期:2016-01-12) |

