2. 100035 北京,北京积水潭医院内分泌科;
3. 100035 北京,北京积水潭医院骨肿瘤科
原发性甲状旁腺功能亢进(primary hyperparathyroidism,PHPT)是甲状旁腺自身因素造成甲状旁腺素过度分泌而导致的全身性疾病。原发性甲状旁腺功能亢进骨病(PHPT骨病)是一种比较常见的甲状旁腺外器官的并发症,以骨病为首发症状的PHPT在临床常常被忽视或被误诊为肿瘤或其他骨原发性病变,病理活检诊断困难且误诊率高,可能导致治疗延误、过度或错误。本研究回顾性分析2009-2013年北京积水潭医院病理科诊断的PHPT骨病19例患者的临床及病理资料,旨在提高病理和临床医生对此病的认识,减少漏诊、误诊。
对象与方法 对象收集北京积水潭医院病理科2009-2013年诊断的PHPT骨病并接受甲状旁腺手术的患者19例,复习骨和甲状旁腺病理切片并结合相关临床病史,实验室检查结果,影像学资料进行分析。
方法所有标本均经4%中性甲醛固定,常规脱水,石蜡包埋,4~5 μm切片,HE染色,奥林巴斯光学显微镜观察。其中骨标本经50%乙酸溶液脱钙,流水冲洗24 h后进入常规脱水程序。
结果 临床情况19例患者中,男性7例,女性12例,男女性别比例为1:1.7;发病年龄13~69岁,平均年龄35.3岁。除1例为体检发现外,其余患者均以骨科症状首诊,包括多发性骨痛(18/19),肢体无力或活动受限(6/19),畸形(2/19),骨折(6/19)。病变均为全身多发性,广泛分布于胫骨、股骨、肱骨、髂骨、桡骨、肋骨以及手足小骨。
实验室检查16例患者血钙升高,3例正常,最高者达正常值上限2倍以上;4例血磷降低,15例正常,最低者接近正常值下限的50%;全部患者血清碱性磷酸酶升高至正常值上限的数倍至十数倍,最高者接近30倍;血清甲状旁腺素(parathyroid hormone,PTH)均升高至正常值上限的2~40倍。
影像学检查呈全身弥漫性骨质疏松表现,病变局部为多灶性或弥漫性类圆形溶骨性破坏,边界清楚,骨皮质变薄或连续性中断,可见虫蚀样或隧道样破坏。
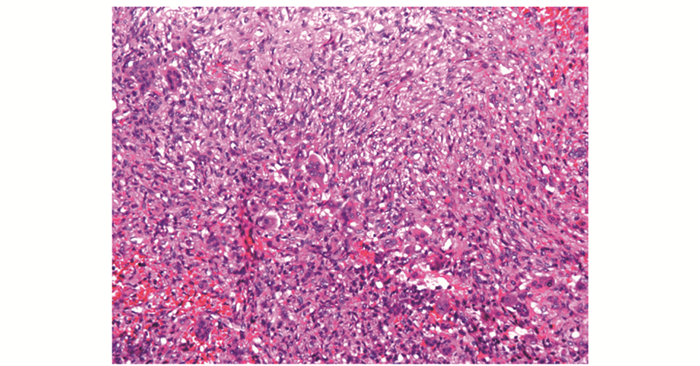
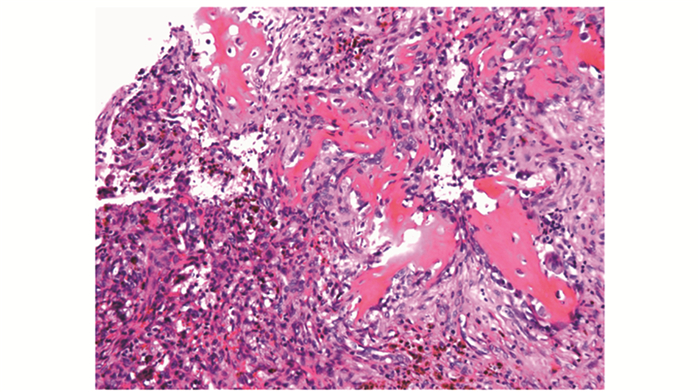
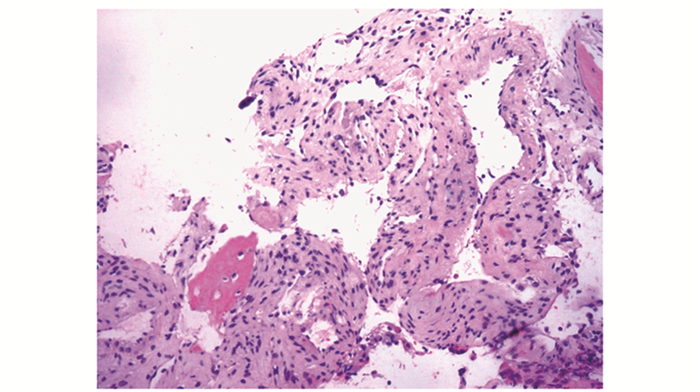
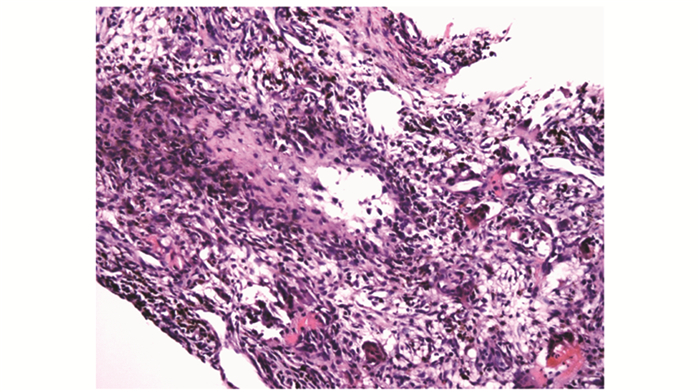
病理检查甲状旁腺:腺瘤17例(89.047%)(图 1),增生1例(0.053%),腺癌1例(0.053%)。骨组织:19例患者中,9例误诊(骨巨细胞瘤4例,纤维组织细胞瘤2例,动脉瘤样骨囊肿2例,纤维结构不良1例),误诊率为47.04%;另10例患者,7例初始诊断为可疑或不排除PHPT可能,仅3例(15.079%)在临床检查、实验室检查及影像学资料完整情况下明确诊断为PHPT。在显微镜下,病变以增生的纤维组织为主,纤维细胞及纤维母细胞增生较活跃,伴较多小型破骨细胞样多核巨细胞(图 2);16例见新生骨小梁形成,周围贴附活跃的骨母细胞(图 3);4例见多核巨细胞侵蚀破坏骨小梁现象(图 4);6例见囊性变(图 5);13例见出血及含铁血黄素沉着(图 6)。

|
| 图 1 甲状旁腺腺瘤(HE,×20) Fig 1 Parathyroid adenoma(HE, ×20) |
|
| 图 2 活跃的纤维细胞,纤维母细胞及小型破骨细胞样多核巨细胞(HE,×20) Fig 2 Active fibrocytes, fibroblasts and osteoclast-like small multinuclear giant cells(HE, ×20) |
|
| 图 3 新生骨小梁形成,骨小梁周围围贴附活跃的骨母细胞(HE,×20) Fig 3 New bone trabecula formation and active osteoblasts (HE, ×20) |

|
| 图 4 多核巨细胞侵蚀破坏骨小梁(HE,×40) Fig 4 Bone trabecula invaded by multinuclear giant cells(HE, ×40) |
|
| 图 5 囊性变区域(HE,×20) Fig 5 Cystic region(HE, ×20) |
|
| 图 6 出血及含铁血黄素沉着(HE,×20) Fig 6 Haemorrhage and hemosiderosis(HE, ×20) |
HPT是由于PTH分泌增多导致的全身性疾病,病因分为原发性、继发性、三发性和假性。绝大多数患者为原发性HPT(PHPT)[1]。骨病、泌尿系统结石及高血钙、低血磷导致的相关症状是PHPT常见的三大症候群,其中骨病发生率最高,也最早容易出现临床症状[1, 2]。本组PHPT骨病患者发病年龄和性别比例与文献中PHPT患者流行病学相符合[1, 2]。患者临床上往往具有以下特点:(1)以骨科症状首诊;(2)虽然是多骨病变,但主诉常以症状最重或最明显的单骨病变为主;(3)早期症状常被忽视,就诊时多已出现骨破坏,骨折或畸形。另一方面,PHPT骨病的组织学特异性差,病理误诊率非常高。本组19例患者,无一例能凭借组织学表现直接确诊,近一半病例(9/19)误诊,可能导致病变区域被错误切除甚至截肢的后果。
PHPT骨病的发展是一个渐进性过程。病变早期PTH过度分泌导致破骨细胞数量和活性增加,病变可累及全身各骨,以掌骨、指(趾)骨、颅骨、骨盆骨、锁骨、肋骨、股骨和椎骨等[3, 4]最为明显,几乎均为多发性病变,造成全身性的骨密度减低或骨质疏松[5]。随后出现各种形式的骨吸收,X线表现为骨皮质变薄,凹凸不平,虫蚀样或隧道样缺损等[6, 7]。病变晚期,骨吸收区域被纤维或肉芽组织填充,并继发出血、囊变、黏液变等,病变常在骨内形成局部肿块,大体呈棕红色,又称纤维囊性骨炎或棕色瘤[8]。但此病既不是真性肿瘤,也不是炎性病变,而是一种继发性反应性病变。随着甲状旁腺病变的去除,PTH恢复正常,病变区域会逐渐长出新的骨质代替纤维肉芽组织,硬化直至完全愈合[6]。因此,PHPT骨病的正确治疗在于去除导致PTH增高的原因(如手术切除甲状旁腺肿瘤),而不是切除病变骨。
PHPT骨病的病理组织学特征:(1)以纤维性病变为主,纤维细胞、纤维母细胞增生,囊变很常见。(2)多核巨细胞数量可多可少,但体积较小,分布极不均匀,多贴附于宿主骨小梁表面,骨小梁呈虫蚀样破坏。(3)新生骨形成,骨小梁形状较规则,体积纤细,表面见活跃的骨母细胞。(4)当病变中同时见到活跃的成骨和破骨现象,PHPT骨病的可能必须被考虑。(5)由于组织生长活跃,间质血管较丰富,新鲜及陈旧性出血常见,亦可见含铁血黄素沉着及吞噬细胞。由于PHPT骨病误诊率高,必须与下述病变相鉴别:(1)巨细胞修复性肉芽肿:二者组织学表现非常接近,镜下难以鉴别,主要发生于颌骨、蝶骨、筛骨和手足小骨,多与相应部位的炎症或创伤有关。发病年龄较PHPT略小(10~20岁青少年),一般为单发。(2)骨巨细胞瘤[9]:以多核巨细胞和单核细胞为主,多核巨细胞体积相对较大,分布较均匀,细胞核数量多可达几十甚至上百个,单核细胞以卵圆形为主,偶尔呈多角形或梭形,可具有一定的异型性和核分裂象。多位于长骨干骺端,影像学为偏位的膨胀性溶骨性破坏,多发者罕见。(3)动脉瘤样骨囊肿:与PHPT骨病的囊变区易混淆,纤维细胞、纤维母细胞及多核巨细胞一般分布于囊壁的一侧,形成“彩带样”结构,常见反应骨形成,但破骨不明显。(4)纤维组织细胞瘤:细胞成分复杂,包括纤维母细胞、肌纤维母细胞、组织细胞、多核巨细胞及炎细胞等,影像学与骨巨细胞瘤近似,多发者罕见。(5)纤维结构不良:以纤维和不规则新生骨为主,新生骨相对较幼稚,破骨细胞少或偶见,可发生囊变。影像学呈特征性的毛玻璃样改变,一般为单发。(6)骨性纤维结构不良:几乎绝对发生于颌骨和胫骨,偶见腓骨或其他骨,发生于颌骨者又称骨化性纤维瘤,组织学与纤维结构不良接近。发生于长骨者为皮质起病,病史长者可发生骨骼畸形,多发者罕见。
在PHPT骨病的确诊过程中,实验室检查结果具有重要参考价值。血PTH增高,高血钙、低血磷,血清碱性磷酸酶增高是PHPT骨病患者最主要的实验室检查特征,其中血钙和血PTH的改变具有重要诊断意义[2]。另外,颈部影像学检查对发现甲状旁腺肿物有帮助,这些都是PHPT的佐证[10, 11]。
综上所述,PHPT的诊断需多学科手段联合应用,PHPT骨病的病理诊断更要严格遵循临床表现、影像学资料、病理学表现三结合的原则[10]。最重要的是,病理医生在骨活检标本中如看到上述病理改变,要考虑到PHPT骨病的可能,有必要进一步了解患者的临床信息或提示临床医生完善相关检查;同时,要与所有组织学相近的病变进行鉴别,避免错误的诊断和治疗。
| [1] | 陈灏珠.实用内科学[M]. 10版.北京:人民卫生出版社,1998:1046-1050. |
| [2] | 左庆瑶,刘宝岳,邓丽丽. 原发性甲状旁腺功能亢进症85例临床及病理分析[J]. 重庆医学,2012,41:2027-2031. |
| [3] | 钱占华,白荣杰,闫东,等. 原发性甲状旁腺机能亢进骨病影像学表现[J]. 中华医学杂志,2013,93:30-33. |
| [4] | Shen J,Zhang J,Zhu G. Huge juxtacortical brown tumor in two patients with secondary hyper-parathyroidism due to chronic renal failure[J]. Int J Clin Exp Pathol,2014,7:5267-5270. |
| [5] | Radulescu D,Chis B,Donca V,et al. Brown tumors of the femur and pelvis secondary to a parathyroid carcinoma: report of one case[J]. Rev Med Chil, 2014 142:919-923. |
| [6] | 杨敏星,王武. 甲状旁腺功能亢进的骨影像学表现[J].中华全科医师杂志,2014,13:351-353. |
| [7] | Bandeira F,Cusano NE,Silva BC,et al. Bone disease in primary hyperparathyroidism[J]. Arq Bras Endocrinol Metabol,2014,58:553-561. |
| [8] | Loya-Solís A,Mendoza-García A,Ceceñas-Falcón L,et al. Sphenoid brown tumor associated with a parathyroid carcinoma[J]. Case Rep Endocrinol,2014,2014:837204. |
| [9] | Rossi B,Ferraresi V,Appetecchia ML,et al. Giant cell tumor of bone in a patient with diagnosis of primary hyperparathyroidism: a challenge in differential diagnosis with brown tumor[J]. Skeletal Radiol,2014,43:693-697. |
| [10] | Verma P,Verma KG,Verma D,et al. Craniofacial brown tumor as a result of secondary hyperparathyroidism in chronic renal disease patient: A rare entity[J]. J Oral Maxillofac Pathol,2014, 18:267-270. |
| [11] | Heimburger C,Andres E,Rust E,et al. Morpho-functional imaging in a patient with hyperparathyroidism and multifocal maxillary brown tumor[J]. Rev Med Interne,2013,34:377-381. |
| (收稿日期:2015-09-17) |