骨质疏松症是一种慢性疾病,其治疗是一个长期过程,目前用于治疗骨质疏松症的常用药物双膦酸盐(阿仑膦酸钠、唑来膦酸等),均能减少骨折发生率。治疗骨质疏松症对减少骨折发生及改善生活质量的重要意义已被普遍认可,但骨质疏松症患者在经过抗骨质疏松药物规范治疗好转后,其停药后的转归及后续监测仍有争议。国外研究发现:骨质疏松症患者经过双膦酸盐治疗3~5年且骨折风险中低等的骨质疏松患者可以停药观察[1],但停药后最佳的评估时间仍需要更多的数据支持[2-3]。我国《2011年原发性骨质疏松指南》建议原发性骨质疏松症患者服用双膦酸盐治疗好转停药后1~2年进行再评估[4-5],但查阅文献未发现有关我国骨质疏松人群停药后最佳评估时间的相关研究。本研究回顾性分析骨质疏松症患者使用双膦酸盐药物治疗好转停药后骨密度和骨转换指标的变化,初步探讨骨质疏松症患者停药后的最佳评估时间。
对象与方法 对象收集2008年8月至2011年10月在上海市第一人民医院骨质疏松门诊初诊确诊为骨质疏松症(T值≤-2.5)并使用抗骨质疏松药物治疗(疗程≥3年)患者的资料。骨质疏松症诊断标准参照世界卫生组织(World Health Organization,WHO)推荐的诊断标准。
纳入标准:所有入选者均签署知情同意书;肝、肾功能正常;骨质疏松患者治疗好转停药后6或12个月按时随访的患者。
排除标准:并发影响骨代谢的其他疾病,如肿瘤、类风湿关节炎、甲状腺疾病、迁延性慢性肝、肾疾病史患者等;未坚持用药或曾中断用药,或服药期间有明显生活方式改变的患者。骨质疏松患者治疗好转停药后6或12个月未按时进行随访的患者。
分组:A组为停药6个月进行评估的患者(n=62);B组为停药12个月进行评估的患者(n=55);C组停药6个月及12个月均进行评估的患者17例(n=17)(图 1)。所有患者均常规补充钙剂(钙尔奇D,600 mg/d)和活性维生素D (阿法骨化醇0.5 g/d或骨化三醇0.25 g/d)。两组钙剂和活性维生素D的摄入量比较,差异无统计学意义(P < 0.05)。
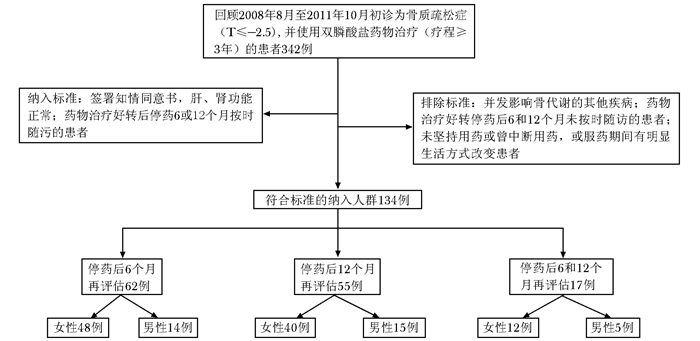
|
| 图 1 对象纳入及分组流程图 Figure 1 Flow chart of subjects selection and grouping |
病史资料收集:记录患者年龄、性别、体质量指数(body mass index,BMI)、血钙、血磷、25羟维生素D (25 hydroxy-vitamin D,25OHD)、双膦酸盐的用药时间、治疗终点和停药后骨密度值(腰椎、股骨颈、全髋)及骨转换标志物及变化率等资料。
血钙、血磷、25OHD和骨转换标志物检测:上午8:00~10:00采集入选者空腹静脉血,血清低温离心分离后置于-80 ℃低温保存。采用电化学发光法(罗氏E170,德国)定量检测。检测指标主要包括血钙(calcium,Ca)、血磷(phosphorus,P)、血清骨钙素(bone gamma-carboxyglutamic-acid-containing proteins,BGP)、Ⅰ型胶原交联羧基末端肽(cross-linked carboxy-terminal telopeptide of typeⅠcollagen,CTX)和25OHD水平。批内变异系数(coefficient of variation,CV)和批间CV均 < 10%。
骨密度测定:采用骨密度双能X线吸收仪(GE-Lunar,Prodigy,美国)测定正位脊柱腰1-4(L1-4)、股骨颈和左侧全髋关节骨密度。测量前均行体模测试,L1-4 CV值为1.5%,全髋CV值为1.2%,股骨颈CV值为1.7%。所有受试者BMD测定均由同一技术员操作。在骨密度测量中进行严格的质量控制以排除测量误差对诊断结果的干扰,并每年进行一次质控试验。
药物及疗程:阿仑膦酸钠(福善美, 70 mg/周,默沙东制药有限公司或固邦10 mg/d,石家庄欧意制药),清晨空腹足量清水(忌用牛奶、咖啡、矿泉水、橙汁)送服。服药后采取坐位或立位,30 min后进早餐。连续服用药物≥3年。
统计学方法采用SPSS 20.0统计软件包,所有临床变量均用均数±标准差(x±s)表示。停药前后数据比较用配对样本t检验,偏态分布的计量资料用中位数表示,转换为正态分布后进行统计学分析,以P < 0.05为差异有统计学意义。
结果 停药后骨密度和骨转换指标的变化停药后6个月(A组)患者,腰椎、股骨颈、全髋骨密度较基线骨密度均有降低趋势(表 1)。全髋骨密度降低0.78%,差异有统计学意义(P < 0.05);腰椎骨密度降低0.75%,差异有统计学意义(P < 0.05);股骨颈骨密度降低0.53%,差异无统计学意义(P > 0.05)(图 2),根据医院骨密度仪器检测结果L1-4骨密度的95%可信区间最小有意义变化值(least significant change,LSC)是0.013 g/cm2,全髋骨密度的LSC是0.014 g/cm2,股骨颈骨密度的LSC是0.012 g/cm2。本研究结果显示停药6个月的患者腰椎和全髋骨密度的变化值差异有统计学意义(P < 0.05),但小于LSC,没有临床意义。停药后6个月,骨转换指标较基线骨转换指标有明显的上升,BGP上升30.25%,CTX上升80.06%,差异均有统计学意义(P < 0.05);与骨转换指标BGP的最小有意义变化率20.4%和CTX最小有意义变化率57.4%比较,停药6个月骨转换指标变化有临床意义(图 3)。
| 项目 | 年龄(岁) | 身高(cm) | 体质量(kg) | 血钙(mmol/L) | 血磷(mmol/L) | 25OHD (nmol/L) | BGP (g/L) | CTX (ng/L) | BMD (g/cm2) | ||
| L1-4 | 股骨颈 | 全髋 | |||||||||
| 停药时 | 61.33±8.89 | 158.71±6.02 | 58.99±6.54 | 2.24±0.13 | 1.14±0.15 | 61.17±22.35 | 10.15±2.45 | 143.11±81.85 | 1.071±0.12 | 0.821±0.07 | 0.903±0.08 |
| 停药6个月 | 61.83±8.89 | 157.34±5.98 | 57.43±6.43 | 2.27±0.11 | 1.13±0.13 | 64.57±22.91 | 13.23±4.14 | 257.68±142.33 | 1.063±0.13 | 0.817±0.08 | 0.896±0.08 |
| P | > 0.05 | > 0.05 | > 0.05 | > 0.05 | > 0.05 | > 0.05 | < 0.01 | < 0.01 | < 0.05 | > 0.05 | < 0.05 |
| 25OHD:25羟基维生素D;BGP:血清骨钙素;CTX:Ⅰ型胶原交联羧基末端肽;BMD:骨密度 | |||||||||||
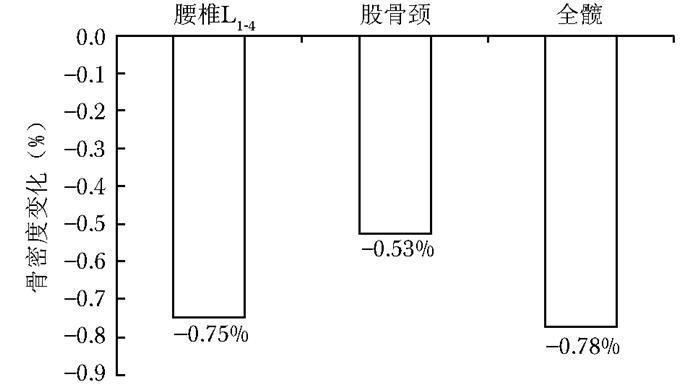
|
| 图 2 停药后6个月患者骨密度变化率 Figure 2 Changes of bone mineral density of patients at 6 months after drug withdrawal |
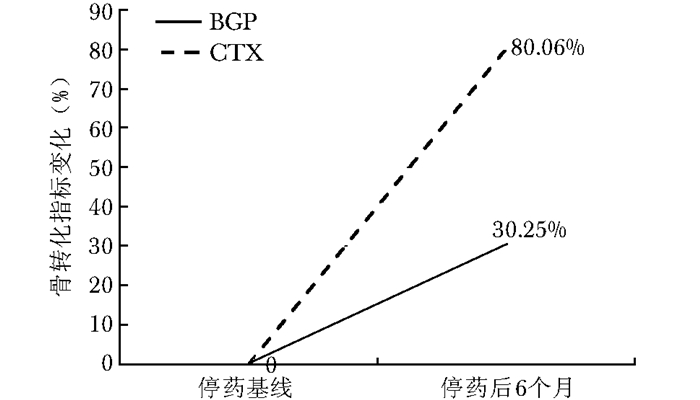
|
| 图 3 停药后6个月患者骨转换指标变化率 Figure 3 Changes of bone turnover markers at 6 months after drug withdrawal BGP:血清骨钙素;CTX:Ⅰ型胶原交联羧基末端肽 |
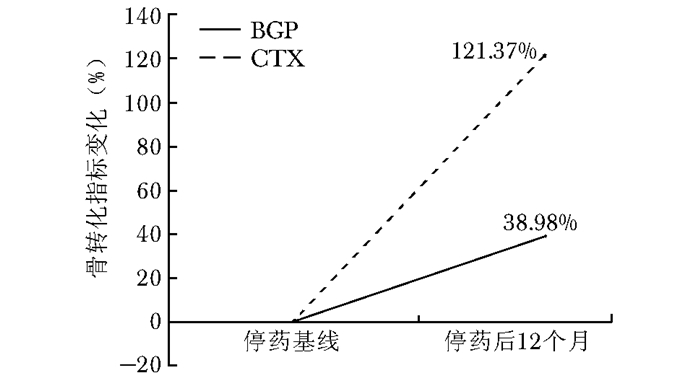
停药后12个月(B组)患者,腰椎、股骨颈、全髋骨密度较基线骨密度有更加明显的降低(表 2)。腰椎骨密度和全髋骨密度分别降低1.31%和1.50%,差异有统计学意义(P < 0.05),而且骨密度变化值大于LSC;股骨颈骨密度降低0.94%,有明显的降低趋势,但差异无统计学意义(P=0.085)(图 4)。停药12个月后,骨转换指标较基线骨转换指标有更加明显的上升,BGP上升38.98%,CTX上升121.37%,差异均有统计学意义(P < 0.05)(图 5)。
| 项目 | 年龄(岁) | 身高(cm) | 体质量(kg) | 血钙(mmol/L) | 血磷(mmol/L) | 25OHD (nmol/L) | BGP (g/L) | CTX (ng/L) | BMD (g/cm2) | |||||
| L1-4 | 股骨颈 | 全髋 | ||||||||||||
| 停药时 | 61.19±8.40 | 159.13±5.47 | 61.78±7.87 | 2.25±0.14 | 1.18±0.14 | 62.55±19.39 | 10.98±3.23 | 145.65±105.98 | 1.085±0.09 | 0.823±0.07 | 0.900±0.07 | |||
| 停药12个月 | 62.19±8.40 | 158.89±5.43 | 61.13±7.84 | 2.28±0.08 | 1.18±0.17 | 59.75±19.07 | 15.26±5.45 | 322.42±152.99 | 1.071±0.09 | 0.815±0.08 | 0.887±0.07 | |||
| P | > 0.05 | > 0.05 | > 0.05 | > 0.05 | > 0.05 | > 0.05 | < 0.01 | < 0.01 | < 0.05 | < 0.05 | < 0.05 | |||
| 25OHD:25羟基维生素D;BGP:血清骨钙素;CTX:Ⅰ型胶原交联羧基末端肽;BMD:骨密度 | ||||||||||||||
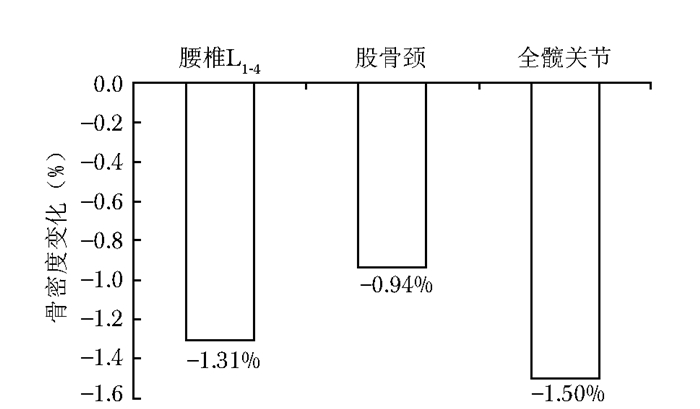
|
| 图 4 停药12个月患者骨密度变化率 Figure 4 Changes of bone mineral density at 12 months after drug withdrawal |
|
| 图 5 停药12个月患者骨转换指标变化率 Figure 5 Changes of bone turnover markers at 12 months after drug withdrawal BGP:血清骨钙素;CTX:Ⅰ型胶原交联羧基末端肽 |
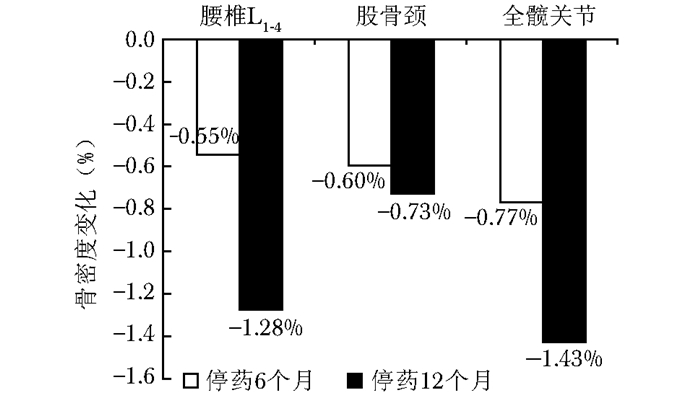
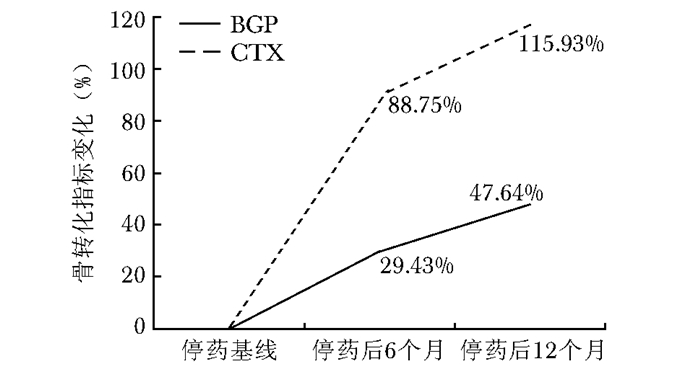
停药6和12个月均评估(C组)患者骨密度随着停药时间延长逐渐降低,骨转换指标逐渐上升(表 3)。停药6个月,腰椎、股骨颈和全髋骨密度较基线骨密度均有降低趋势,但差异无统计学意义(P > 0.05)。停药12个月,腰椎、股骨颈和全髋骨密度较停药6个月时降低更明显(图 6)。停药6个月,骨转换指标较基线骨转换指标有明显的上升,停药12个月,骨转换指标上升更明显(图 7)。
| 项目 | 年龄(岁) | 身高(cm) | 体质量(kg) | 血钙(mmol/L) | 血磷(mmol/L) | 25OHD (nmol/L) | BGP (g/L) | CTX (ng/L) | BMD (g/cm2) | ||
| L1-4 | 股骨颈 | 全髋 | |||||||||
| 停药时 | 58.24±9.34 | 159.40±4.94 | 54.34±8.28 | 2.20±0.16 | 1.17±0.14 | 62.22±20.74 | 10.60±1.68 | 159.86±81.05 | 1.098±0.09 | 0.825±0.06 | 0.907±0.07 |
| 停药6个月 | 58.74±9.40 | 159.12±4.87 | 54.34±8.40 | 2.23±0.10 | 1.18±0.09 | 63.82±21.17 | 13.72±2.58 | 301.74±108.34 | 1.092±0.09 | 0.820±0.06 | 0.900±0.07 |
| 停药12个月 | 59.24±9.40 | 158.96±4.74 | 54.30±8.21 | 2.25±0.08 | 1.19±0.11 | 61.45±10.63 | 15.65±4.99 | 345.19±162.98 | 1.084±0.10 | 0.819±0.06 | 0.894±0.07 |
| 25OHD:25羟基维生素D;BGP:血清骨钙素;CTX:Ⅰ型胶原交联羧基末端肽;BMD:骨密度 | |||||||||||
|
| 图 6 停药6和12个月患者骨密度的变化率 Figure 6 Changes of bone mineral density at 6 months and 12 months after drug withdrawal |
|
| 图 7 停药6和12个月患者骨转换指标变化率 Figure 7 Changes of bone turnover markers at 6 months and 12 months after drug withdrawal BGP:血清骨钙素;CTX:Ⅰ型胶原交联羧基末端肽 |
骨质疏松症患者经规范服用抗骨质疏松药物治疗后,骨密度和骨转换指标均可得到改善,骨折风险明显下降,则可以停药观察,但患者停药期间需要规律随访,以监测停药后骨代谢指标的变化情况[6]。然而骨代谢指标再评估的最佳时限仍需要更多的临床数据支持。
Black等[7]通过观察骨质疏松患者规律服用阿仑膦酸钠5年后停药5年期间患者骨代谢指标的变化情况,发现骨质疏松患者服用阿仑膦酸钠5年停药时的骨代谢指标均有好转,骨密度均有上升,骨转换指标均有下降,但这些患者停药1年后,全髋和股骨颈骨密度重新出现下降(1%~2%),CTX、BALP等骨转换指标均有明显的上升,且停药时间越长,骨密度下降和骨转换指标升高越明显。Watts等[8]研究发现,服用伊班膦酸盐3年骨密度好转后停药1年的患者(停药时腰椎骨密度平均T值为-2.1),腰椎和股骨颈骨密度均有一定程度的降低,其中停药1年时的腰椎骨密度相对于停药时骨密度下降0.83%,股骨颈骨密度下降1.23%;骨转换指标也有明显的增加。以上研究表明骨质疏松患者规律服用双膦酸盐药物后骨密度和骨转换指标均有明显好转,停药1年后,患者骨密度就会出现再次下降,骨转换指标就会再次明显上升。尽管骨密度的下降或骨转换指标的升高并非一定预示着骨折风险的增加,但当相关骨代谢指标出现上述改变时,仍应考虑给予患者继续抗骨质疏松治疗。所以有专家建议骨质疏松患者服用双膦酸盐3~5年骨密度好转停药后大约1年需检测骨密度和/或骨转换指标[9-12]。多个国家的骨质疏松治疗指南[6, 13-14]建议:骨质疏松患者停药期间要规律随访,停药1~2年后进行再评估,评估内容包括临床风险因素(年龄、身高、体质量、新发骨折和其他新的风险因素),骨密度以及骨转换指标等,依评估结果判断是否重新开始治疗。
虽然我国《原发性骨质疏松症诊治指南(2011年)》建议原发性骨质疏松患者规律服用双膦酸盐治疗好转后1~2年进行再评估[4-5],但是查阅相关文献未发现关于我国骨质疏松患者治疗后骨密度达到基本正常(T值≥-1.5)停药后最佳评估时间的相关研究数据报道。Black等[3]相关研究对骨质疏松患者规律服用双膦酸盐药物3~5年骨密度好转停药后骨代谢的变化情况进行观察,但是这些研究的入选人群停药时骨密度T值并未严格达到正常水平;而且不同的人种可能对药物的敏感性和药物代谢动力学的情况有所不同。因此,针对这个问题选取本院骨质疏松专科数据库中符合标准的患者进行了初步的研究结果显示,初诊为骨质疏松症(T值≤-2.5),并使用双膦酸盐药物治疗(疗程≥3年)好转后(T值≥-1.5)停药的患者,停药半年后即开始出现骨密度的降低和骨转换指标的显著上升:全髋骨密度降低0.78%,腰椎骨密度降低0.75%,股骨颈骨密度降低0.53%。但是停药半年时骨密度的变化值小于骨密度仪LSC,即停药半年时骨密度的变化有统计学意义,但无临床意义。骨转换指标较基线骨转换指标有明显的上升,BGP上升30.25%,CTX上升80.06%,差异有统计学意义(P < 0.05)。停药1年后骨密度进一步降低,骨转换指标进一步上升:腰椎、股骨颈、全髋骨密度较基线骨密度有更加明显的降低,腰椎骨密度和全髋骨密度分别降低1.31%和1.50%,差异有统计学意义(P < 0.05),股骨颈骨密度降低0.94%。骨转换指标较基线骨转换指标有更加明显的上升,BGP上升38.98%,CTX上升121.37%,差异有统计学意义(P < 0.05)。本研究建议骨质疏松症患者治疗停药1年即评估骨密度及骨转换指标可早期预测及评估转归。
本研究尚存在局限性:首先,该研究为回顾性研究,存在一定的信息偏倚及混杂偏倚。第二,样本量相对较小。今后可进一步扩大样本量,或行前瞻性队列研究加以证实。第三,抗骨质疏松药物种类繁多,不同的药物可能有不同的停药时间,需要进一步研究。
| [1] | Adami S, Idolazzi L, Fracassi E. Osteoporosis treatment:when to discontinue and when to re-start[J]. Bone Res, 2013, 1 : 323–335. DOI:10.4248/BR201304003 |
| [2] | Diab DL, Watts NB. Bisphosphonate drug holiday:who, when and how long[J]. Ther Adv Musculoskelet Dis, 2013, 5 : 107–111. DOI:10.1177/1759720X13477714 |
| [3] | Black DM, Bauer DC, Schwartz AV, et al. Continuing bisphosphonate treatment for osteoporosis-for whom and for how long?[J]. N Engl J Med, 2012, 366 : 2051–2053. DOI:10.1056/NEJMp1202623 |
| [4] | 中华医学会骨质疏松和骨矿盐疾病分会. 原发性骨质疏松症诊治指南(2011年)[J]. 中华骨质疏松和骨矿盐疾病杂志, 2011, 4 : 2–15. |
| [5] | 陶天遵, 邱贵兴, 朱汉民. 原发性骨质疏松症的治疗与预防[J]. 中华骨与关节外科杂志, 2015, 8 : 378–384. |
| [6] | Briot K, Cortet B, Thomas T, et al. 2012 update of French guidelines for the pharmacological treatment of postmenopausal osteoporosis[J]. Joint Bone Spine, 2012, 79 : 304–313. DOI:10.1016/j.jbspin.2012.02.014 |
| [7] | Black DM, Schwartz AV, Ensrud KE, et al. Effects of continuing or stopping alendronate after 5 years of treatment:the Fracture Intervention Trial Long-term Extension (FLEX):a randomized trial[J]. JAMA, 2006, 296 : 2927–2938. DOI:10.1001/jama.296.24.2927 |
| [8] | Watts NB, Diab DL. Long-term use of bisphosphonates in osteoporosis[J]. J Clin Endocrinol Metab, 2010, 95 : 1555–1565. DOI:10.1210/jc.2009-1947 |
| [9] | Chiha M, Myers LE, Ball CA, et al. Long-term follow-up of patients on drug holiday from bisphosphonates:real-world setting[J]. Endocr Pract, 2013, 19 : 989–994. DOI:10.4158/EP12425.OR |
| [10] | Bauer DC, Schwartz A, Palermo L, et al. Fracture prediction after discontinuation of 4 to 5 years of alendronate therapy the FLEX Study[J]. JAMA Intern Med, 2014, 174 : 1126–1134. DOI:10.1001/jamainternmed.2014.1232 |
| [11] | Lewiecki EM. Bisphosphonates for the treatment of osteoporosis:insights for clinicians[J]. Ther Adv Chronic Dis, 2010, 1 : 115–128. DOI:10.1177/2040622310374783 |
| [12] | McClung M, Harris ST, Miller PD, et al. Bisphosphonate therapy for osteoporosis:benefits, risks, and drug holiday[J]. Am J Med, 2013, 126 : 13–20. DOI:10.1016/j.amjmed.2012.06.023 |
| [13] | Compston J, Bowring C, Cooper A, et al. Diagnosis and management of osteoporosis in postmenopausal women and older men in the UK:National Osteoporosis Guideline Group (NOGG) update 2013[J]. Maturitas, 2013, 75 : 392–396. DOI:10.1016/j.maturitas.2013.05.013 |
| [14] | Cosman F, de Beur SJ, LeBoff MS, et al. Clinician's guide to prevention and treatment of osteoporosis[J]. Osteoporos Int, 2014, 25 : 2359–2381. DOI:10.1007/s00198-014-2794-2 |
| (收稿日期:2016-03-04) |

