2.430022 武汉, 华中科技大学同济医学院附属协和医院中西医结合科
2.Department of Integrated Traditional Chinese and Western Medicine, Union Hospital,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430022,China
2001年美国国立卫生研究院提出骨质疏松(osteoporosis,OP)是以骨强度下降、骨折风险性增加为特征的骨骼系统疾病[1],而骨矿密度可反映骨强度的70%。骨矿化是骨代谢的重要部分之一,参与骨质疏松的病理过程。基质Gla蛋白(matrix Gla protein,MGP)作为骨钙调节蛋白,是体内研究中首次报道的血管和软骨钙化的抑制剂,是矿盐沉积的重要抑制物[2]。长期临床研究发现骨质疏松症与动脉钙化往往并存在同一个患者中,而近年来大量研究表明两者之间有共同的病理生理机制[3],分子研究、动物模型以及临床观察均表明,MGP不但参与血管钙化,也参与骨细胞的分化和矿化[4]。虽然临床与试验研究均揭示MGP与骨质疏松有一定的相关性[5],但尚缺乏MGP与绝经后骨质疏松症关系的临床观察的直接证据,本研究旨在探讨绝经后骨质疏松症女性血清MGP mRNA与骨密度及骨代谢标志物的关系,并为骨质疏松与血管钙化两者的共同防治提供思路。
对象和方法 对象选择2014年10月至2015年5月华中科技大学同济医学院附属协和医院骨质疏松症专病综合门诊就诊的绝经后骨质疏松患者120例为试验组,患者平均年龄(59.68±3.36)岁,平均绝经时间(9.72±3.15)年,体质量指数(23.70±1.64)kg/m2。双能X线骨密度仪检查骨密度(bone mineral density,BMD),均符合原发性骨质疏松诊治指南(2011)诊断标准,腰椎BMD测定T值<-2.5SD;排除12个月内接受降钙素、雌激素、二膦酸盐等药物治疗,并发其他骨代谢疾病,肝、肾功能检测异常者[1]。另选择来自华中科技大学同济医学院附属协和医院体检中心的绝经后健康妇女60名作为对照组,平均年龄(58.98±2.32)岁,平均绝经时间(9.18±2.36)年,体质量指数(23.55±1.74)kg/m2,健康参加者均经过体格检查,排除骨质疏松和其他影响骨代谢的疾病。两组受试者一般资料比较,差异无统计学意义(P>0.05),具有可比性。
方法血生化指标检测:受检者空腹采肘静脉血,送检验科测常规生化指标:血糖、肝肾功能、血脂、血钙、血磷等。另留5 mL血,置于-80 ℃冰箱保存,待提取总RNA;再另留5 mL血,30 min内离心(3000 r/m,10 min)后分离血清,置于-80 ℃冰箱保存待分析。
血清雌二醇(estradiol,E2)、血清甲状旁腺素(parathyroid hormone,PTH)检测:分离的血清送至核医学科通过电化学发光法检测E2、PTH。
骨转换标志物检测:使用罗氏公司提供的β-胶原降解产物Ⅰ型胶原羧基端肽(β-crosslinking telopeptide,β-CTX)试剂盒、血清Ⅰ型前胶原N-端前肽(N-terminal propeptide of type 1 collagen,P1NP)试剂盒及全自动电化学发光仪进行测定。
MGP mRNA检测:离心分离静脉血清,留取沉淀物,参考Trizol说明书,提取总RNA,按照说明书反转录试剂盒合成cDNA。7.5 μmol/L内参引物作为参照标准。取0.2 mL PCR管,配制如下反应体系:2× qPCR Mix 12.5 μL;7.5 μmol/L基因引物2.0 μL;反转录产物2.5 μL;ddH2O 8.0 μL,每个反转录产物配制3管。在PCR扩增仪进行PCR 反应,并使用系统(SDS文件)进行分析。95 ℃变性10 min,60 ℃ 退火60 s,60 ℃延伸5 min,共40个循环。引物序列见表 1。
| 基因 | 引物名称 | 引物序列(5′→3′) | 大小(bp) |
| MGP | H-MGP-S | TGGTTTATGGATACAATGCTGCC | 77 |
| H-MGP-A | TTTCTTCCCTCAGTCTCATTTGG | ||
| ACTIN | H-ACTIN-S | CACCCAGCACAATGAAGATCAAGAT | 317 |
| H-ACTIN-A | CCAGTTTTTAAATCCTGAGTCAAG |
采用2-ΔΔCT方法分析相关基因表达的数。靶基因=2-ΔΔCT×控制,ΔΔCT=治疗组(Ct目的基因-Ct参照基因)-对照组(Ct目的基因-Ct参照基因)。
骨密度检测:所有患者BMD均采用双能X线骨密度仪[(Lunar,Prodigy Madison,WI USA]对腰1~4椎体进行检测并评价。骨密度仪每天进行仿真模型的质控,并由专业人员操作。
统计学方法采用SPSS 20.0统计软件分析数据,持续性变量以均数±标准差($\bar x \pm s$)表示。组间比较采用独立样本t检验。相关检验运用非参数统计分析方法,对血清MGP mRNA水平的影响因素进行Spearman相关系数计算,以P<0.05为差异有统计学意义。
结 果 两组血清MGP mRNA、腰椎骨密度、骨转换标志物水平比较两组间比较,腰椎骨密度、T值、MGP mRNA、P1NP和β-CTX水平,差异均有统计学意义(P=0.000)(表 2)。
| MGP:血清基质Gla蛋白;BMD:骨密度;CTX:Ⅰ型胶原交联末端肽; P1NP:血清Ⅰ型前胶原N-端前肽 | |||||
| 组别 | MGP mRNA | BMD(g/m2) | T-score | β-CTX(mg/L) | PINP(mg/L) |
| 对照组 | 4.524±0.769 | 0.976±0.071 | -1.685±0.572 | 0.383±0.048 | 41.80±4.97 |
| 实验组 | 0.835±0.415 | 0.780±0.075 | -3.353±0.695 | 0.427±0.067 | 48.50±4.43 |
| P | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
两组间雌二醇水平差异有统计学意义(P=0.043),PTH(P=0.053)、Ca(P=0.225)、P(P=0.341)水平差异无统计学意义(表 3)。
| E2:血清雌二醇;PTH:血清甲状旁腺素;Ca:血钙;P:磷 | ||||
| 组别 | E2(nmol/L) | PTH(ng/L) | Ca(mmol/L) | P(mmol/L) |
| 对照组 | 40.25±12.44 | 33.373±6.447 | 2.38±0.08 | 1.14±0.09 |
| 实验组 | 36.23±12.39 | 35.703±9.410 | 2.36±0.14 | 1.13±0.14 |
| P | 0.043 | 0.053 | 0.100 | 0.834 |
绝经后骨质疏松患者血清MGP mRNA水平与腰椎骨密度(r=0.376,P=0.000)、雌激素(r=0.227,P=0.013)呈正相关,与年龄(r=0.088,P=0.341)、体质量指数(r=0.045,P=0.626)、身高(r=0.082,P=0.372)、PTH(r=0.190,P=0.837)、Ca(r=0.170,P=0.064)、P(r=0.009,P=0.926)无明显相关性;绝经后非骨质疏松女性血清MGP mRNA水平与检测变量间均无明显相关性(图 1,2)。
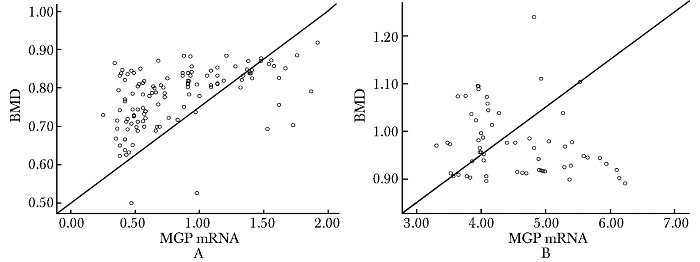
|
| 图 1 两组患者MGP mRNA含量与BMD的相关性 Fig.1 Correlation of MGP mRNA and BMD between two groups A:绝经后骨质疏松患者(r=0.376,P=0.000);B:健康对照组(r=-0.181,P=0.167); MGP:血清基质Gla蛋白;BMD:骨密度 |
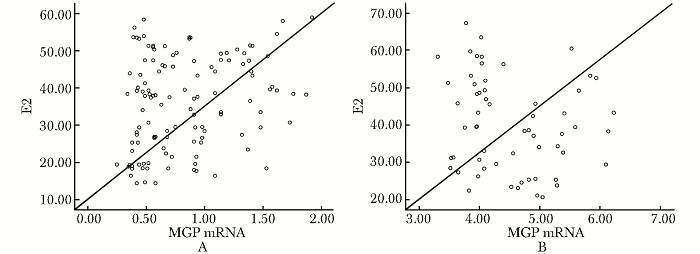
|
| 图 2 两组患者MGP mRNA含量与E2的相关性 Fig.2 Correlation of MGP mRNA and E2 between two groups A:绝经后骨质疏松患者(r=0.227,P=0.013);B:健康对照组(r=-0.179,P=0.170); MGP:血清基质Gla蛋白; E2:血清雌二醇 |
基质Gla蛋白(matrix Gla protein,MGP)是20世纪80年代发现的从牛骨骼中分离出来的一种低分子蛋白,相对分子质量为10 000,共有84个氨基酸。它含有5个维生素K依赖性氨基酸r-羧基谷氨酸(Gla)残基,广泛存在于骨骼、牙质、软骨和心肺等组织中,在血管中基质Gla蛋白主要由血管平滑肌细胞(vascular smooth muscle cell,VSMC)合成[6]。基质Gla蛋白是体内研究中首次报道的血管和软骨钙化的抑制剂,是矿盐沉积的重要抑制物。基质Gla蛋白经维生素K依赖性羧化酶将其Y-赖氨酸羧化成谷氨酸残基后具有抑制血管钙化的作用[7]。临床与实验研究均揭示,MGP与骨质疏松有一定的相关性[5]:骨质疏松的治疗药物如维生素D、维生素K、二膦酸盐、PTH等均能影响并调节血管或成骨细胞内MGP的表达[8];MGP基因的多态性与女性绝经后骨质疏松[9]及男性的骨量流失有关[10];MGP以胎球蛋白-MGP-钙磷矿化复合物(fetuin-A-MGP-calcium phosphate mineral complex,FMC)的形式影响骨矿化的改变,抑制磷灰石前体和矿物质的形成和沉积[11]。近年来,多项临床研究发现维生素K缺乏与绝经后骨质疏松密切相关[12],维生素K摄入量长期低下者,其股骨颈骨折的危险性增高,维生素K是MGP中的谷氨酸羧化所必须的,MGP的谷氨酸羧化异常有可能是维生素K缺乏导致绝经后骨质疏松的发病机制之一[4]。
本研究结果显示PMOP患者血清中MGP mRNA显著低于无骨质疏松组的含量,PMOP患者血清中MGP mRNA与骨密度、雌二醇水平呈正相关。推测可能是因为绝经后骨质疏松女性骨代谢处于高转换状态,破骨细胞功能活跃,骨钙流失,钙离子在骨外沉积形成异位钙化,MGP聚集在异位钙化区抑制钙化进程,消耗MGP导致循环MGP减少[13]。而雌激素可以通过促使未羧化MGP羧化转变为有活性的MGP,增加血清中FMC的量而改善骨重构[14],因此骨质疏松患者雌激素水平下降可能是引起血清MGP表达下降的原因之一。
本研究未发现血清MGP mRNA与P1NP、β-CTX、PTH、血钙、血磷有明显的相关性。可能是因为血清MGP的变化并非完全与骨质疏松的高骨转换状态有关,还可能由于绝经女性机体缺乏维生素D、维生素K,导致MGP生成及活性MGP减少,抗异位钙化能力减弱,钙沉积在血管壁上,促进非活性MGP增加并结合在血管壁,反射性抑制MGP mRNA的表达,使得血循环中的MGP减少[15]。虽然多项实验研究表明PTH能诱导成骨细胞MGP mRNA的表达[16, 17],但骨质疏松时PTH水平升高也会加速骨钙动员入血,使体循环中的钙增加并沉积在血管内膜上,形成异位钙化,消耗MGP导致循环MGP减少,因此在人体内,PTH对MGP的影响可能更为复杂,有待进一步研究。慢性肾疾病(chronic kidney disease,CKD)患者血管钙化的发生与高磷、高钙磷乘积、继发性甲状旁腺功能亢进密切相关[18],MGP与血磷、钙磷乘积存在正相关[19],而本研究对象都是肾功能正常者,因此未发现MGP与血钙、血磷有明显相关性。
在健康对照组人群中未发现血清MGP mRNA与各指标有明显的相关性,说明血清MGP mRNA的含量变化在绝经后骨质疏松中较有意义。在绝经后骨质疏松患者机体内环境与骨代谢的变化(如骨钙丢失、血钙增加、维生素K缺乏等)可以引起MGP的含量变化,MGP的表达又进一步加重了骨质疏松的骨矿化抑制。
本研究提示血清MGP mRNA水平可以作为预测绝经后骨质疏松严重程度的指标之一。但本研究未检测和分析血清MGP含量,有一定缺陷,且临床观察样本量有限,对照组和试验组人群比例1∶2,在总样本量不变的情况下,对照组人数的减少可能会导致统计效能的降低。MGP mRNA在骨组织及血管中的表达未检测。因此,有关MGP与骨质疏松的相关研究还有待进一步完善与深入。
| [1] | 中华医学会骨质疏松和骨矿盐疾病分会.原发性骨质疏松症诊治指南[J]. 中华骨质疏松和骨矿盐疾病杂志,2011,4:2-17. |
| [2] | 刘胜男,张德纯. 与钙化相关的骨基质蛋白研究的现状与展望[J]. 中国微生态学杂志,2012,24:94-95. |
| [3] | 梅艳洁,陈逸青,章秋. 绝经后骨质疏松症与动脉钙化相关性的研究进展[J].安徽医药,2014,18:593-596. |
| [4] | 丁颖,姜醒华. 基质 Gla 蛋白与动脉钙化、骨质疏松关系的研究进展[J]. 实用临床医学,2010,11:129-132. |
| [5] | 杨雅,赖晓阳,王平芳,等. 基质GLA蛋白与绝经后骨质疏松症[J]. 中国骨质疏松杂志,2008,14:839-841. |
| [6] | 王开. 基质Gla蛋白(MGP)[J]. 国外医学泌尿系统分册,2005,25:413-415. |
| [7] | 邱翠婷,吕安林,李寰. 维生素K依赖蛋白抑制血管钙化研究进展[J]. 中华临床医师杂志,2014,8:2499-2501. |
| [8] | 钟文婷,姜醒华. MGP与绝经期妇女动脉硬化和骨质疏松的关系[J]. 中国循环杂志,2013,28:42. |
| [9] | Kinoshita H,Nakagawa K,Narusawa K. A functional single nucleotide polymorphism in the vitamin-K-dependent gammaglutamyl carboxylase gene(Arg325gin) is associated with bone mineral density in elderly Japanese women[J]. Bone,2007,10:451-456. |
| [10] | Tuón-Le Poultel D, Cannata-Andía JB, Román-García P,et al.Association of matrix Gla protein gene functional polymorphisms with loss of bone mineral density and progression of aortic calcification[J]. Osteoporos Int,2014,25:1237-1246. |
| [11] | Price PA,Nguyen TM,Williamson MK. Biochemical characterization of the serum fotuin-mineral complex[J]. Biol Chem,2003,278:22153-22160. |
| [12] | Cees V. Vitamin K:the effect on health beyond coagulation-an overview[J]. Food Nutr Res,2012,56:5329. |
| [13] | 丁颖. 基质GLA蛋白与绝经女性冠状动脉钙化及骨质疏松关系的相关研究[D]. 南昌:南昌大学医学院,2010. |
| [14] | Chen XY,Jiang XH,Lai XY,et al. Effect of estrogen on the expression of matrix GLA protein in ovariectomized SD rats[J]. Zhonghua Fu Chan Ke Za Zhi,2012, 47:833-838. |
| [15] | Schlieper G,Grotemeyer D,Aretz A,et al. Analysis of calcifications in patients with coral reef aorta[J]. Ann Vasc Surg,2010,24:408-414. |
| [16] | Suttamanatwong S,Franceschi RT,Carlson AE,et al. Regulation of matrix Gla protein by parathyroid hormone in MC3T3—elosteoblast-like cells involves protein kinase A and extracellular signal-regulated kinase pathways[J]. Cell Biochem,2007,102:496-505. |
| [17] | Supapom S,Renny T,Anne EC,et al. Sp proteins and Runx2 mediate regulation of matrix Gla protein(MGP) expression by parathyroid hormone[J]. Cell Biochem,2009,107:284-292. |
| [18] | Ossareh S. Vascular calcification in chronic kidney disease: mechanisms and clinical implications [J]. Iran J Kindney Dis,2011,5:285-299. |
| [19] | Zhang K, Cheng G. Malnutrition,a new inducer for arterial calcification in hemodialysis patients[J]. Transl Med,2013,11:66. |
| (收稿日期:2015-06-18) |

