目前国内外应用的铁鳌合剂主要有去铁铵 (deferoxamine,DFO)、去铁酮 (deferiprone,DFP) 及地拉罗司 (deferasirox,DFS)[1],还包括低氧模拟化合物二甲基乙二酰甘氨酸 (dimethyloxalylglycine,DMOG)。
目前常见的铁螯合剂及其相关特性 去铁铵DFO最早应用于临床,目前铁螯合剂实验研究多采用DFO,其主要与Fe3+以1:1比例结合形成铁铵复合物,结合能力强,特异性高。可以有效地降低血清铁水平,并能防治内分泌系统并发症[2]。研究表明,长期应用去铁胺治疗可降低心脏并发症的发生率并延长患者生存期[3]。然而,他的半衰期短,须经肌肉注射或皮下注射,治疗依从性较差。
去铁酮DFP是第一个上市的口服祛铁剂,他与Fe3+以3:1比例结合形成复合物。DFP是一个亲脂小分子,可以进入肌细胞,因而对去除心脏铁沉积尤为有效。回顾性研究发现,去铁酮较去铁胺更能降低心脏病的发病率和病死率,降低心肌铁沉积[4]。
地拉罗司DFS亦是一种口服铁螯合剂,其与Fe3+以2:1比例结合,从粪便排泄,降低铁的贮存。DFS半衰期长,在血浆中持续存在,可使血浆非转铁蛋白结合铁持续减少,直接清除体内形成的铁,其降低体内铁的的疗效与DFO相当[5]。
低氧模拟化合物二甲基乙二酰甘氨酸DMOG是一种新型铁螯合剂,能够竞争铁离子结合位点与铁结合。DMOG、DFO等在常氧条件下能激活低氧诱导因子 (hypoxia-inducible factor-α,HIF-α) 信号通路,这一类化合物被称为“低氧模拟化合物”,他们对雌激素缺乏型骨质疏松有防治作用,并对骨质疏松骨缺损修复具有促进作用[6]。
铁螯合剂对骨血管形成的影响骨发育及骨折的愈合需要良好的血供及血管生成能力。骨发育中,软骨内成骨在时间、空间上总是伴随着血管侵入,血管形成和骨形成是相互偶联的过程[7]。在骨折愈合中,血流能够带来骨质需要的营养、氧气、细胞 (包括炎性反应细胞、间质干细胞、内皮祖细胞等) 和生长因子等。外骨痂的膜内化骨和内骨痂的软骨内成骨均需要血管的入侵才能实现[8]。临床上常见的一种骨折不愈合就是由于骨折端血供较差导致的以骨形成障碍为表现的萎缩性骨不愈合[9]。近年来铁螯合剂对骨血管形成的影响被关注的很多。在长骨干牵张性成骨实验中,证实DFO能增加骨血管生成及骨质再生,促进骨折修复及骨愈合[10]。Farberg等[11]亦在鼠下颌骨牵张成骨模型实验中,表明DFO在下颌骨再生过程中,不但能阻止放射诱导的骨血流减少,相反增加血管形成,减轻放射带来的骨质损伤。
HIF-α信号通路在骨血管形成方面的作用目前认为骨生长过程中启动血管形成的一个关键因素就是“缺氧”,因此调节氧张力HIF-α信号通路即为核心调控通路。2007年,Wang等[12]利用Cre-Flox重组酶技术,成骨细胞水平特异性敲除肿瘤抑制基因 (von Hippel-Lindau/VHL) 的小鼠 (△VHL),从而使小鼠成骨细胞HIF-α持续性高表达。实验结果表明△VHL小鼠骨塑形速率及股骨骨量明显高于对照组。另一方面,△VHL小鼠在发育过程中股骨血管体积、血管密度、血管数量均明显大于对应野生型小鼠,同时股骨松质骨中VEGF含量增高,血清中VEGF含量没有明显变化,因此股骨血管增多主要与骨组织中VEGF的升高有关。与之相反的是在成骨细胞水平敲除HIF-1α获得的小鼠 (△HIF-1α) 的骨量与血管量与△VHL小鼠相比明显减少[12]。Rankin等[13]在前成骨细胞水平敲除VHL使HIF-α过表达。与上述研究结果类似,△VHL小鼠股骨干髓端和骨干充满松质骨,且成骨细胞数量增多,反映成骨分化的Ⅰ型胶原表达增强。CD31染色提示骨骼内富含大量血管。上述两项研究表明,通过对HIF-α的调控,可以获得对长骨发育过程中骨量及血管含量的调节,而骨量的改变与血管量的变化有关[12-13]。
鉴于上述HIF-α信号通路在骨形成和血管形成方面的作用,多位研究者提出了通过激活HIF-α信号通路来促进骨血管形成的构想并在实验中得以证实。Shen等[14]建立了小鼠股骨中段横行骨折模型,并在骨折间隙内局部应用铁螯合剂DFO及DMOG,可引起HIF-1α的表达,进而刺激VEGF及下游的血管生长因子的产生,最终骨血管形成较对照组增多,骨量也较对照组增多。Alexis等[15]在小鼠病理性骨折模型接受放射性治疗中,使用DFO局部注射,刺激HIF-1α及VEGF表达,促进局部骨血管形成。Mori等[16]在牵张性成骨模型中动态压缩对膜内成骨的刺激作用亦证实主要与HIF-1α产生的VEGF有关。Wan等[17]分别利用野生型小鼠、△VHL小鼠、△HIF-1α小鼠制作牵张性成骨模型,结果提示△VHL小鼠骨折愈合的骨痂及血管量明显高于野生型小鼠,而△HIF-1α的骨痂和血管含量明显低于野生型小鼠,在野生型牵张性成骨模型小鼠骨折间隙内分别应用HIF-α信号通路激活剂DFO,含羞草素 (L-mimosine, L-mim) 后骨折端形成的骨痂和血管明显多于对照组。Jia等[18]建立卵巢切除 (ovariectomy,OVX) 小鼠骨质疏松模型,表明DMOG能激活对小鼠间充质干细胞C3H10T1/2上的HIF-α信号通路,促进血管内皮生长因子 (vascular endothelial growth factor,VEGF) 分泌;DMOG干预组小鼠的骨密度、骨量、骨强度、血管含量,骨骼中HIF-1α、VEGF的蛋白表达要高于OVX组,表明DMOG能部分阻止OVX小鼠骨质疏松形成,机制在于促进血管及促进骨形成。在建立骨质疏松大鼠股骨远端骨缺损模型中,植入含有DFO的poly (lactic-co-glycolic acid)/PLGA支架材料的骨缺损处血管量,骨量明显多于对照组。
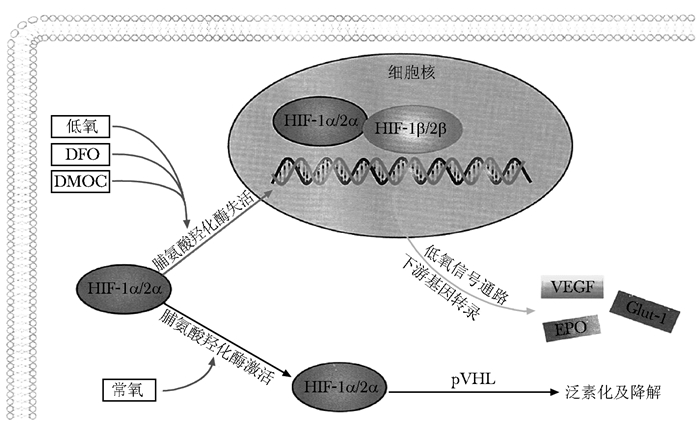
HIF-α信号通路介导铁螯合剂与血管形成HIF-α是HIFs转录因子α亚基,含有3种亚型 (HIF-1α、HIF-2α、HIF-3α)[19],HIFs的另一β亚基恒定表达于常氧条件下,因此,对HIFs信号通路的调节主要是对HIF-α的调节[20]。在α亚基激活区域的N末端有一个氧依赖的降解区域 (ODD),该区域内含有特异性的脯氨酸残基。在常氧条件下,脯氨酸羟化酶识别并羟化的ODD内脯氨酸残基。羟化的α亚基与具有E3泛素连接酶活性的Von Hippel-Lindau (VHL) 蛋白形成复合物,引导HIF-α被蛋白水解酶降解[21]。在此过程中,脯氨酸羟化酶需要氧气、抗坏血酸、α-酮戊二酸及铁离子才可发挥酶的作用[22]。对HIF-α的调控还存在另一种HIF抑制因子 (factor-inhibiting HIF,FIH),阻止HIF-α与转录激活因子结合。这一过程同样需要铁离子及α-酮戊二酸的存在才能发挥酶的作用[23]。铁离子螯合剂DFO或DMOG能通过螯合铁离子、竞争铁离子结合位点而降低脯氨酸羟化酶及FIH活性,阻止HIF-α被羟化降解。在缺氧或DFO、DMOG存在的条件下,HIF-α聚积在细胞质,α亚基转位至细胞核与β亚基形成异二聚体,从而启动下游基因的转录[22]。HIF-α信号通路调控机制如图 1[24]。
HIF-α信号通路在下游低氧状态下调控的重要方面是触发血管形成,通过调控下游其他生长因子的表达,而直接参与血管形成的全部过程[25-26]:(1) 血管发生阶段:通过调控一氧化氮合酶使血管扩张,增强VEGF及血管内皮生长因子受体-1(vascular endothelial growth factor receptor-1,VEGFR-1) 的表达增加血管通透性。(2) 进展阶段:通过上调基质金属蛋白酶降解细胞外基质,上调VEGF诱导血管内皮细胞增生和迁移,同时在血管生成素-2(angiogenin-2,Ang-2) 的参与下,形成血管芽。(3) 形成阶段:在VEGF、Ang-1和整合素的作用下,单个血管芽形成血管腔,并与邻近的血管相互吻合成血管网。(4) 改建阶段:通过血小板源性生长因子 (platelet-derived growth factor,PDGF),Ang-1等使血管平滑肌或其他细胞迁移包绕新生血管,产生外基质,从而完成血管壁结构。
综上所述,铁螯合剂与机体血管形成关系密切,特别是促进骨血管形成方面,在最近的动物模型试验上也得到证实[10-13]。这为骨折愈合及骨缺损修复、雌激素缺乏性及老年性骨质疏松症的研究和治疗提供新的方法和思路。Weinberg[27]提出,应用铁鳌合剂降低铁过载可能是防治铁过载型骨质疏松症的一种有效方法。铁螯合剂均为化合物,比VEGF、PDGF等生物学制剂更稳定,价格更便宜,并且DFO作为一种上市药物早已在血液病领域广泛应用,为此铁螯合剂在骨质疏松症的防治中有一定的临床应用前景。
| [1] | Cohen AR. New advarces in iron chelation therapy[J]. Hematology Am Soc Hematol Educ Program, 2006, 1 : 42–47. |
| [2] | De Sanctis V, Eleftheriou A, Malaventura C. Prevalence of endocrine complications and short stature in patients with thalassaemia major: a multicenter study by the Thalassaemia International Federation (TIF)[J]. Pediatr Endocrinol Rev, 2004, 2 : 249–255. |
| [3] | Borgna-Pignatti C, Rugolotto S, De stefano P, et al. Survival and complications in patients with thalassemia major treated with transfusion and deferoxamine[J]. Haematologica, 2004, 89 : 1187–1193. |
| [4] | Piga A, Gaglioti C, Fogliacco E, et al. Comparative effects of deferiprone and defemxamine on survival and cardiac disease in patients with thalassemia major: a retrospective analysis[J]. Haematologica, 2003, 88 : 489–496. |
| [5] | Cappellini MD, Cohen A, Piga A, et al. A phase 3 study of deferasirox (ICL670), a once-daily oral iron chelator, in patients with beta-thalassemia[J]. Blood, 2006, 107 : 3455–3462. |
| [6] | Zhao Q, Shen X, Zhang W, et al. Mice with increased angiogenesis and osteogenesis due to conditional activation of HIF pathway in osteoblasts are protected from ovariectomy induced bone loss[J]. Bone, 2012, 50 : 763–770. DOI:10.1016/j.bone.2011.12.003 |
| [7] | Maes C. Role and regulation of vascularization processes in endochondral bone[J]. Calcif Tissue Int, 2013, 92 : 307–323. DOI:10.1007/s00223-012-9689-z |
| [8] | Hankenson KD, Dishowitz M, Gray C, et al. Angiogenesis in bone regeneration[J]. Injury, 2011, 42 : 556–561. DOI:10.1016/j.injury.2011.03.035 |
| [9] | Garcia P, Pieruschka A, Klein M, et al. Temporal and spatial vascularization patterns of unions and nonunions: role of vascular endothelial growth factor and bone morphogenetic proteins[J]. J Bone Joint Surg Am, 2012, 94 : 49–58. |
| [10] | Wan C, Gilbert S, Wang Y, et al. Role of hypoxia inducible factor-1 pathway in bone regeneration[J]. J Musculoskelet Neuronal Interact, 2008, 8 : 323–324. |
| [11] | Farberg AS, Jing XL, Monson LA, et al. Deferoxamine reverses radiation induced hypovascularity during bone regeneration and repair in the murine mandible[J]. Bone, 2012, 50 : 1184–1187. DOI:10.1016/j.bone.2012.01.019 |
| [12] | Wang Y, Wan C, Deng L, et al. The hypoxia-inducible factor a pathway couples angiogenesis to osteogenesis during skeletal development[J]. J Clin Invest, 2007, 117 : 1616–1626. DOI:10.1172/JCI31581 |
| [13] | Rankin EB, Wu C, Khatri R, et al. The HIF signaling pathway in osteoblasts directly modulates erythropoiesis through the production of EPO[J]. Cell, 2012, 149 : 63–74. |
| [14] | Shen X, Wan C, Ramaswamy G, et al. Prolyl hydroxylase inhibitors increase neoangiogenesis and callus formation following femur fracture in mice[J]. J Orthopaedic Res, 2009, 27 : 1298–1305. DOI:10.1002/jor.v27:10 |
| [15] | Alexis D, Daniela M, Sagar S, et al. Localized deferoxamine injection augments vascularity and improves bony union in pathologic fracture healing after radiotherapy[J]. Bone, 2013, 52 : 318–325. |
| [16] | Mori S, Akagi M, Kikuyama A, et al. Axial shortening during distraction osteogenesis leads to enhanced bone formation in a rabbit model through the HIF-la/vascular endothelial growth factor system[J]. J Orthop Res, 2006, 24 : 653–663. DOI:10.1002/(ISSN)1554-527X |
| [17] | Wan C, Gilbert SR, Wang Y, et al. Activation of the hypoxia-inducible factor-la pathway accelerates bone regeneration[J]. Proc Natl Acad Sci, 2008, 105 : 686–691. DOI:10.1073/pnas.0708474105 |
| [18] | Jia P, Deng LF, Zuo GL. Dimethyloxalylglycine prevents bone loss in ovariectomized C57BL/6J mice through enhanced angiogenesis and osteogenesis[J]. PLoS One, 2015, 10 : e0112744. |
| [19] | Min JH, Yang H, Ivan M, et al. Structure of an HIF-1ɑ-pVHL complex: hydroxyproline recognition in signaling[J]. Science, 2002, 296 : 1886–1889. DOI:10.1126/science.1073440 |
| [20] | Zagorska A, Dulak J. HIF-1: the knowns and unknowns of hypoxia sensing[J]. Acta Biochim Pol, 2004, 51 : 563–585. |
| [21] | Ohh M, Park CW, Ivan M, et al. Ubiquitination of hypoxia-inducible factor requires direct binding to the beta-domain of the von Hippel-Lindau protein[J]. Nat Cell Biol, 2000, 2 : 423–427. DOI:10.1038/35017054 |
| [22] | Jaakkola P, Mole DR, Tian YM, et al. Targeting of HIF-a to the von Hippel-Lindau ubiquitylation complex by O2-regulated prolyl hydroxylation[J]. Science, 2001, 292 : 468–472. |
| [23] | Lando D, Peet DJ, Gorman JJ, et al. FIH-1 is an asparaginyl hydroxylase enzyme that regulates the transcriptional activity of hypoxia-inducible factor[J]. Genes Dev, 2002, 16 : 1466–1471. DOI:10.1101/gad.991402 |
| [24] | 贾鹏, 邓廉夫. 低氧诱导因子-α信号通路与骨形成[J]. 中华骨科杂志, 2015, 35 : 676–680. |
| [25] | 任步方, 邓廉夫. 低氧诱导因子-1在软骨代谢中的作用及其机制[J]. 中华骨科杂志, 2006, 26 : 630–632. |
| [26] | Andrikopoulou E, Zhang X, Sebastian R, et al. Current insights into the role of HIF-I in cutaneous wound healing[J]. Curr Mol Med, 2011, 11 : 218–235. |
| [27] | Weinberg ED. Iron loading: a risk factor for osteoporosis[J]. Biometals, 2006, 19 : 633–655. |
| (收稿日期:2016-09-13) |