成骨不全症(osteogenesis imperfecta,OI)又名脆骨病,是最常见的单基因遗传性骨病,以骨量低下、骨骼脆性增加和反复骨折为主要特征,由重要的骨基质蛋白Ⅰ型胶原(type Ⅰ collagen)编码基因及其代谢相关基因突变所致[1-2]。新生儿患病率约为1/15 000~20 000[3]。青少年型和家族性骨质疏松症患者中,有相当一部分是未确诊的OI[4]。OI常常幼年起病,轻微创伤后反复发生骨折,病情严重者可能在宫内或出生时即骨折,导致脊柱侧凸、胸廓塌陷、四肢弯曲等畸形,甚至可因肺部感染、胸廓畸形引发心、肺衰竭而死亡。患者还可伴有听力下降、关节韧带松弛和心脏瓣膜病变等骨骼外表现[5-6]。OI危害大,具有较高的致残率,疾病的诊治水平亟待提高。
中华医学会骨质疏松和骨矿盐疾病分会组织相关学科专家撰写此指南,以期提高对OI发病机制、诊断及治疗等的认识,使患者得到及时、恰当的诊疗,以改善患者的生活质量,减少疾病的致残率,减轻疾病给家庭和社会带来的负担。
成骨不全症的发病机制骨组织主要由有机质和无机质组成。Ⅰ型胶原蛋白占骨有机质成分的90%以上,对于维持骨骼结构的完整性和生物力学性能至关重要。OI的发病机制是由Ⅰ型胶原蛋白编码基因或其代谢相关调控基因突变,导致Ⅰ型胶原蛋白数量减少或质量异常,引起骨皮质变薄、骨小梁纤细或形态异常,使骨密度显著降低、骨微结构损害、骨强度下降,反复发生骨折和进行性骨骼畸形(图 1),其遗传模式主要呈常染色体显性遗传,少数呈常染色体隐性遗传,罕有X染色体伴性遗传。

|
| 图 1 OI发病机制示意图 |
OI可由多种致病基因突变所致,目前已报道的致病基因至少有21种(表 1)[3, 7]。Ⅰ型胶原由两条α1链和一条α2链构成有序的三螺旋结构,其编码基因COL1A1或COL1A2突变是导致OI的最主要原因,所致OI呈常染色体显性遗传。如COL1A1/COL1A2基因突变导致Ⅰ型胶原数量减少,常常引起轻型OI;而COL1A1/COL1A2基因突变导致Ⅰ型胶原三螺旋分子结构异常,往往引起中、重型OI[8]。由干扰素诱导跨膜蛋白5基因(IFITM5)突变所致具有独特临床表现的Ⅴ型OI也呈常染色体显性遗传[9]。少数OI呈常染色体隐性遗传或X染色体伴性遗传,其相关基因突变影响Ⅰ型胶原分子的修饰、组装、运输等过程,或影响骨骼矿化、成骨细胞分化等导致OI。
| 类型 | 致病基因/OMIM编号 | 蛋白功能 | 遗传方式 | 临床特点 |
| Ⅰ型 | COL1A1,COL1A2/120150,120160 | 合成Ⅰ型胶原 | AD | 轻型,多无骨畸形表现, 患者身高无明显变矮[10-12] |
| Ⅱ型 | COL1A1,COL1A2/120150,120160 | 合成Ⅰ型胶原 | AD | 围生期致死型,常围生期有多发骨折、严重骨骼畸形,引发心肺功能衰竭而致死[10] |
| CRTAP,P3H1,PPIB/605497, 610339,123841 |
α1和α2链脯氨酸羟基化 | AR | ||
| Ⅲ型 | COL1A1,COL1A2/120150,120160 | 合成Ⅰ型胶原 | AD | 重型,常有多发骨折、进行性骨骼畸形及身材矮小[10-12] |
| CRTAP,P3H1,PPIB/605497, 610339,123841 |
α1和α2链脯氨酸羟基化 | AR | ||
| SERPINH1/600943 | 装配和稳定三重螺旋的胶原蛋白 | AR | ||
| BMP1/112264 | 裂解前胶原蛋白羧基端 | AR | ||
| FKBP10,PLOD2/607063, 601865 | 胶原链交联 | AR | ||
| SERPINF1/172860 | 骨矿化 | AR | ||
| SP7/606633 | 成骨细胞分化 | AR | ||
| WNT1/164820 | 成骨细胞分化和功能 | AR | ||
| TMEM38B/611236 | 细胞内钙释放 | AR | ||
| CREB3L1/616215 | 调节Ⅰ型胶原蛋白表达 | AR | ||
| SEC24D/607186 | 调节蛋白基质分泌 | AR | ||
| Ⅳ型 | COL1A1,COL1A2/120150,120160 | 合成Ⅰ型胶原 | AD | 中型,病情介于Ⅰ型和Ⅲ型之间[10-12] |
| CRTAP,PPIB/605497,123841 | α1和α2链脯氨酸羟基化 | AR | ||
| FKBP10/607063 | 胶原链交联 | AR | ||
| SERPINF1/172860 | 骨矿化 | AR | ||
| SP7/606633 | 成骨细胞分化 | AR | ||
| WNT1/164820 | 成骨细胞分化和功能 | AR或AD | ||
| Ⅴ型 | IFITM5/614757 | 参与骨骼矿化 | AD | 有肥厚性骨痂、桡骨头脱位、前臂骨间膜钙化等特征性表现[13-15] |
| Ⅵ型 | SERPINF1/172860 | 参与骨骼矿化 | AR | 骨组织具有鱼鳞状类骨质堆积,血清色素上皮衍生生长因子水平极低[16-19] |
| Ⅶ型 | CRTAP/605497 | α1和α2链脯氨酸羟基化 | AR | 中重型,早发骨折,股骨有爆米花样骨骺[20-21] |
| Ⅷ型 | P3H1/610339 | α1和α2链脯氨酸羟基化 | AR | 病情与Ⅶ型接近[22] |
| Ⅸ型 | PPIB/123841 | α1和α2链脯氨酸羟基化 | AR | 病情与Ⅶ型接近[23] |
| Ⅹ型 | SERPINH1/600943 | 维持Ⅰ型胶原三螺旋结构稳定性 | AR | 致死型,常有三角脸、面中部发育不良、肌力下降、脑积水等表现[24] |
| Ⅺ型 | FKBP10/607063 | 维持Ⅰ型胶原三螺旋结构稳定性 | AR | 中重型,可伴有Bruck综合征,即脆性骨折、关节挛缩、脊柱侧凸[25-26] |
| Ⅻ型 | SP7/606633 | 促进成骨细胞分化,参与Ⅰ型胶原表达调控 | AR | 中型,可有牙齿晚萌,面中部发育不良,前额与眉弓突出、听力下降等表现[27-28] |
| ⅩⅢ型 | BMP1/112264 | Ⅰ型前胶原羧基末端剪切 | AR | 中重型,反复骨折伴骨畸形,多数患者BMD升高,骨脆性增加[29-30] |
| ⅩⅣ型 | TMEM38B/611236 | 编码钙离子通道,参与Ⅰ型胶原修饰和分泌 | AR | 轻重不一,无牙本质发育不全及听力受损[31-32] |
| ⅩⅤ型 | WNT1/164820 | 促进成骨细胞分化,参与Ⅰ型胶原表达调控 | AR或AD | 纯合突变者表型严重,可有眼睑下垂或高腭弓、脑部畸形或神经发育迟滞[33-34];AD遗传者常表现早发性骨质疏松[35] |
| ⅩⅥ型 | CREB3L1/616215 | 促进成骨细胞分化,参与Ⅰ型胶原表达调控 | AR | 纯合突变者表型严重,围产期致死型;杂合突变携带者或复合杂合突变者表型较轻[36-37] |
| ⅩⅦ型 | SPARC/182120 | 维持Ⅰ型胶原三螺旋结构稳定性 | AR | 中重型,可伴语言或运动发育迟缓、下肢肌力下降等[38] |
| ⅩⅧ型 | MBTPS2/300294 | 参与Ⅰ型胶原交联 | XL | 中重型,可有蓝巩膜、脊柱侧凸、胸廓畸形,可伴有皮肤相关综合征[39] |
| 未分型 | PLOD2/601865 | 参与Ⅰ型胶原交联 | AR | 严重度不一,可伴有Bruck综合征[40] |
| P4HB/176790 | 参与Ⅰ型前胶原修饰 | AD | 可致Cole-Carpenter综合征:多次骨折、颅缝早闭、眼球突出、脑积水、小颌畸形、长骨干骺端呈爆米花样改变等[41] | |
| SEC24D/607186 | 调节蛋白基质的分泌 | AR | 颅骨缺损是主要特征,可伴有额部隆起、小颌及耳发育不良等[42-43] | |
| PLS3/300131 | 肌动蛋白结合,参与Ⅰ型胶原矿化 | XL | 轻型,多无蓝巩膜、牙本质发育不全,男性患者居多[44] | |
| OI:成骨不全症;AD:常染色体显性遗传,AR:常染色体隐性遗传,XL:X染色体伴性遗传 | ||||
OI的主要临床表现是自幼起病的轻微外力下反复骨折,进行性骨骼畸形,不同程度活动受限。骨骼外表现可以有蓝巩膜、牙本质发育不全、听力下降、韧带松弛、心脏瓣膜病变等(图 2)。骨骼X线影像学特征主要包括:全身多部位骨质稀疏;颅板薄,囟门和颅缝宽,枕骨缝间骨,颅底扁平;椎体变形,多椎体压缩性骨折,脊柱侧凸或后凸畸形;胸廓扭曲、变形,甚至塌陷;四肢长骨纤细、皮质菲薄,骨髓腔相对较大,干骺端增宽,多发长骨骨折,长骨弯曲畸形等(图 2)。
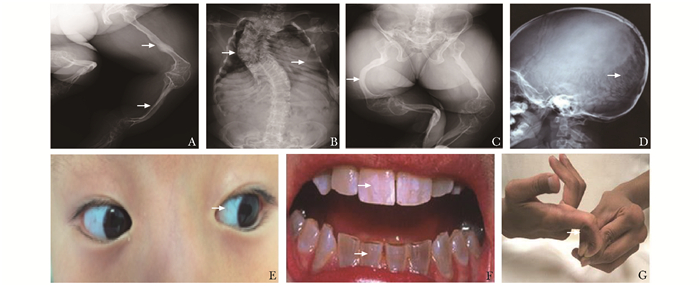
|
| 图 2 OI患者典型X线表现及常见体征 如箭头所示,A:长骨纤细,皮质菲薄,多发陈旧性骨折;B:脊柱侧凸畸形,胸郭塌陷;C:骨盆畸形,长骨弯曲畸形;D:颅板薄,枕骨缝间骨;E:蓝巩膜;F:牙本质发育不全;G:指间关节韧带松驰;OI:成骨不全症 |
根据临床表型,Sillence等[10]将OI分成Ⅰ至Ⅳ型:Ⅰ型病情最轻,最常见;Ⅱ最重,通常围生期致死;Ⅲ型是存活者中最严重的,常常身材矮小,呈进行性骨骼畸形;Ⅳ型严重度介于Ⅰ型与Ⅲ型之间。可依据骨折和骨骼畸形严重程度、发病时间、是否有蓝巩膜等临床特征判断分型[11-12]。近期发现的Ⅴ型OI具有肥厚性骨痂、桡骨头脱位、前臂骨间膜钙化、桡骨干骺端下密集骺线等独特临床表现[13-15](图 3)。OI可由多种致病基因突变所致,因此其有多种类型,OI的遗传方式、致病基因及其临床特点如表 1所示。

|
| 图 3 Ⅴ型OI独特临床表现 如箭头所示,A:肥厚性骨痂;B:脊柱畸形;C:骨间膜钙化;D:桡骨小头脱位; OI:成骨不全症 |
OI致病基因及其突变谱复杂多样,故疾病表型多样、轻重不一。遗传外显性差异较大,相同基因突变可能导致不同表型,这既可见于不同家系间,也可见于同一家系内[45-47]。
成骨不全症的临床诊断OI的临床诊断主要依据疾病的临床表现和影像学特点,包括自幼发病,反复脆性骨折史;蓝巩膜;听力下降;阳性骨折家族史;骨骼X线影像特征。此外,应注意排除多种遗传性及代谢性骨骼疾病,如软骨发育不全、低血磷性佝偻病、维生素D依赖性佝偻病、Fanconi综合征、骨纤维异样增殖症、低磷酸酶血症、肿瘤相关骨病和关节活动过度综合征等。
建议完成骨代谢生化指标、骨骼X线及骨密度等检查,以评估疾病的严重程度,并帮助鉴别诊断。OI患者的血清钙、磷、碱性磷酸酶水平通常正常,骨转换生化指标(包括骨吸收指标和骨形成指标等)也在儿童相应的正常范围内,骨折后可有骨转换生化指标的一过性轻度升高。Ⅵ型OI具有独特的生化指标异常,即血清色素上皮衍生生长因子(pigment epithelium-derived factor,PEDF)水平显著降低[18-19]。OI患者骨骼X线影像如临床表现所述。
OI患者的骨密度可以采用双能X线骨密度仪(dual-energy X-ray absorptiometry, DXA)进行测量,绝大多数OI患者的腰椎、髋部及全身骨密度值显著低于同龄、同性别正常人,骨密度Z评分往往<-2.0。然而,由BMP1基因突变所致的罕见类型OI患者的骨密度常升高,但骨强度下降,患者仍然会在轻微外力下反复发生骨折,其机制尚不清楚,可能DXA主要测量的是骨矿盐含量,不能充分反映骨基质蛋白的改变[29]。
如患者出现明显生化指标异常或临床表现、骨骼X线片等具有OI难以解释的特点,应进行鉴别诊断,明确有无其他骨骼疾病的可能。
成骨不全症的基因诊断基因诊断对发现OI的病因、做好遗传咨询和优生优育具有积极意义。由于尚未发现OI的所有致病基因,因此基因诊断不能代替临床诊断,基因检测阴性者不能完全排除罹患OI的可能。
建议行OI致病基因检测者:(1)临床表现高度疑似OI的重型患者,建议行基因诊断,以了解致病原因,明确疾病诊断和分型,帮助判断疾病预后;(2)先证者(家系中首个被诊断为OI的患者)的一级亲属(父母、子女和同胞)建议行基因诊断,有助于明确OI的遗传方式,并分析基因突变的致病性;(3)有生育需求的OI患者,或已育有OI患儿的夫妇拟再生育者,建议行基因诊断,为遗传咨询和产前基因诊断做准备。
OI基因诊断的常用方法:(1)COL1A1和COL1A2基因突变检测:由于85%~90%的OI患者由COL1A1或COL1A2突变所致,呈常染色体显性遗传,针对临床表现典型的OI患者或呈常染色体显性遗传的OI患者,可采用PCR-Sanger DNA测序法直接对COL1A1和COL1A2基因的编码区进行序列分析[46]。此方法快速、价廉。如COL1A1/COL1A2测序未能明确致病突变,可采用其他方法检测COL1A1/COL1A2基因是否有大片段缺失或重复突变[47],或对其他OI候选基因进行突变检测。(2)其他较常见OI致病基因突变分析:COL1A1和COL1A2基因未发现致病突变时,可根据OI先证者的临床分型及其遗传方式,对重要的OI候选致病基因进行PCR-Sanger测序分析[48]。如具有Ⅴ型OI独特临床表现者,可对IFITM5基因进行突变检测。根据中国人群OI致病基因突变谱[12],可对较常见的WNT1、SERPINF1和FKBP10基因进行PCR-Sanger测序分析。(3)二代测序技术在OI基因诊断中的应用:二代测序技术(next generation sequencing, NGS)包括靶向捕获高通量测序技术、全外显子组测序和全基因组测序等,具有通量高和效率高的特点[12, 49-50]。NGS技术适合对大样本OI患者的多种致病基因突变进行检测,其筛查到的候选致病基因变异,需应用PCR-Sanger测序等方法进行突变验证和家系其他成员的突变分析。
OI产前诊断:有效的遗传咨询和产前诊断有益于OI家庭的优生优育。部分OI患儿在胎儿期有四肢短小和股骨成角等异常征象,妊娠中、晚期B超检查有可能发现。基因诊断对于OI产前诊断具有重要价值,建议注意以下几点:(1)建议行产前基因诊断的人群:曾经育有OI患儿的夫妇,或夫妻一方或双方为OI患者,建议行产前基因诊断。(2)产前基因诊断的前提:行产前诊断需先明确致病基因突变。建议对有生育OI胎儿的高风险孕妇,行产前诊断与遗传咨询,明确其家系的OI致病基因突变后再备孕为宜;对尚未明确致病基因突变且已妊娠的夫妇,紧急情况下可先对最常见的OI致病基因COL1A1和COL1A2进行直接测序,筛选致病突变。(3)产前基因诊断的时机:建议在妊娠早期对胎儿行基因鉴定。目前OI的产前诊断需通过羊膜穿刺获得胎儿基因组DNA样本。羊膜穿刺有3个时机:妊娠第11~13周取绒毛组织;或妊娠第16~24周取羊水细胞;或妊娠第23周后取脐血。建议患者选择有条件的医院妇产科行羊膜穿刺,尽早获得胎儿基因组DNA样本,进行基因诊断。
成骨不全症的治疗目前尚无针对OI致病基因突变的有效治疗方法,现有治疗仅为对症治疗,旨在增加患者的骨密度、降低骨折率、改善骨畸形、提高生活质量[51]。
生活方式干预
跌倒容易诱发骨折,因此OI患者日常生活中应注意避免跌倒。患者反复骨折,活动受限,可能引起肌肉萎缩,因此应加强功能锻炼,以提高肌肉强度,改善身体协调能力,避免废用性骨质疏松的发生。进食含钙丰富的食物,加强户外阳光照射,促进皮肤合成维生素D,也有益于患者的骨骼健康。
药物治疗
儿童OI患者,如存在椎体压缩性骨折,或10岁前发生两次以上长骨骨折,或18岁前发生3次以上长骨骨折,建议药物治疗;成人OI患者,发生椎体压缩性骨折或长骨骨折,建议药物治疗;绝经后和50岁以上男性OI患者,如骨密度符合骨质疏松(即骨密度T评分≤-2.5),也建议药物治疗[52]。
适量的钙剂与维生素D有助于提供骨骼所需营养,可作为OI的基础治疗,但仅给予钙剂与维生素D制剂,不足以降低OI患者的骨折率。可根据患儿体质量,选择给予不同剂量的钙剂与维生素D:患儿体质量<15 kg,予元素钙500 mg/d;体质量≥15 kg,予元素钙1 000 mg/d;患儿体质量≤30 kg,予普通维生素D 500 IU/d;体质量>30 kg,予普通维生素D 1 000 IU/d[53]。成人OI患者的钙剂与维生素D的补充剂量,可参照骨质疏松症患者的处理原则。
目前广泛使用的对OI较有效的药物是双膦酸盐类(bisphosphonates,BPs)。甲状旁腺素类似物(parathyroid hormone,PTH1-34)、RANKL单克隆抗体等药物也可能有一定疗效[51]。
BPs类似物:BPs类药物属于骨吸收抑制剂,能够与骨骼羟基磷灰石结合,有效抑制破骨细胞活性,减少骨吸收,从而增加骨密度、降低骨折风险[52]。由于BPs类药物治疗OI的适应证尚未获得批准,目前属于超适应证用药,需患者或其法定监护人签署知情同意书后方能使用。治疗OI的BPs主要包括第二代BPs(阿仑膦酸钠和帕米膦酸钠)和第三代BPs(唑来膦酸、伊班膦酸钠和利塞膦酸钠)[54-60]。
治疗OI的BPs剂量、使用频率、药物疗程尚未达成共识。目前治疗OI较常使用的静脉BPs剂量为:帕米膦酸钠每年9~12 mg/kg体质量,分为3~4次给药;唑来膦酸每6个月静脉输注1次,每次0.05 mg/kg体质量[51]。由于OI病情较原发性骨质疏松症严重,也可采用唑来膦酸每年静脉输注1次,每次5 mg,治疗OI患儿,其安全性也较好[60]。由于口服BPs生物利用度较低,可给予每周70 mg阿仑膦酸钠治疗中重度OI患儿[59]。关于BPs对于OI患者的治疗疗程:由于药物治疗的前2~4年疗效最明显,建议患者至少接受两年的BPs治疗,后续治疗取决于骨折次数、骨痛和骨密度的改变情况[52]。病情较轻的OI患者BPs治疗4年左右,有望骨密度达峰值骨量而停药,随访观察,而病情较重的OI患者则需要接受BPs治疗更长时间[61]。对于重型OI患者,BPs能够增加患者骨密度,但其降低骨折率的疗效尚需进一步观察。
BPs主要通过肾脏排泄,肌酐清除率<35 mL/min的OI患者禁用。口服BPs治疗,需注意患者是否有反酸、烧心、上腹不适等胃肠道不良反应,具有食道狭窄、食道裂孔疝、反流性食管炎、消化性溃疡等胃肠道疾病者慎用[59]。OI患儿静脉输注BPs的常见不良反应包括:首次静脉输液后可能出现明显的急性期反应,如发热、头痛、恶心、肌痛、关节痛等,多在输液后1 d内出现,持续3 d左右缓解,发热明显者可予非甾体类抗炎药对症处理。再次输注BPs时,患者的急性期反应较少发生,且程度明显减轻[60, 62]。OI患儿输注BPs后也可能出现一过性低钙血症、低磷血症等不良反应,应给予补充钙剂及维生素D制剂,以减轻此不良反应[60]。BPs的罕见不良反应包括:虹膜炎、黏膜炎、皮疹、肝损害、非典型性骨折等。虽然BPs相关的下颌骨坏死极其罕见,但建议OI患者在BPs治疗期间避免拔牙、种植牙等有创口腔治疗[63]。
PTH类似物:PTH类似物属于骨形成促进剂。小剂量、间断PTH1-34治疗可增加成骨细胞活性,促进骨形成、增加骨密度,可能对OI患者有益。小样本成年OI患者接受PTH1-34 20 μg/d皮下注射,治疗18个月,腰椎、股骨颈及全髋骨密度显著增加,但其对患者骨折率的影响,尚需大样本研究评估[64]。目前该药尚无用于儿童的安全性资料,不推荐使用。
狄诺塞麦(denosumab):狄诺塞麦属于骨吸收抑制剂,是RANKL的单克隆抗体,能够减少破骨细胞的生成与活性,从而抑制骨吸收、增加骨密度、降低骨折风险。有小样本OI患儿接受狄诺塞麦治疗,每12周皮下注射1 mg/kg体质量狄诺塞麦1次,治疗2年,患者骨密度升高、骨折次数下降,椎体出现再塑形,且耐受性较好,少数患者出现低钙血症、感染、皮炎、湿疹等不良反应。狄诺塞麦对OI患者的远期疗效和安全性,尚需评估[53, 65]。
手术治疗
对于发生不稳定骨折、骨折延迟愈合或不愈合,出现严重骨骼畸形、严重或反复关节内骨折造成创伤性关节炎,引起OI患者活动受限,明显影响生活质量时,需行手术治疗。
骨折固定手术:OI患者常见骨折部位包括四肢长骨干、椎体、髋部等,手术治疗需充分评估风险与获益。术前获取受累骨的完整影像学资料对于选择手术方式至关重要。手术常见并发症包括骨折延迟愈合或不愈合、畸形愈合、内固定松动等。OI不影响骨折愈合时间,术后制动时间无需延长[66-67]。
四肢骨折。最常见的骨折为轻微外力下四肢长骨横断性骨干骨折[68]。通常情况下,稳定骨折首选非手术治疗[69]。如骨折造成肢体力线不良或骨折端不稳定,需手术复位及固定。OI患者的尺骨鹰嘴骨折及髌骨骨折发生率较正常人群明显增高,这两种骨折均属于关节内骨折且不愈合可能性大,多需手术治疗,以恢复正常解剖结构及肢体功能[67-68]。大多数四肢骨折手术选择内固定治疗。与接骨板相比,髓内钉可避免应力集中,内固定物周围骨折发生率更低[70-71]。由于OI患者常有骨解剖结构异常,如非线性髓腔或髓腔闭锁、肢体超生理弯曲或短缩,骨折可能导致解剖结构变化,这些情况都会增加手术难度,导致术中置入髓内钉困难[67]。髓内固定困难时,也可考虑选择锁定接骨板或单臂多功能外固定器行外固定[72]。OI患者骨折不愈合率高于正常人,骨折不愈合或延迟愈合可导致再骨折或成角畸形[69, 73]。如四肢骨折术后出现畸形加重、再骨折或骨折不愈合,可考虑翻修和矫形手术。
脊柱骨折。OI患者骨密度较低,常并发韧带松弛,发生脊柱骨折的风险较高。成年OI患者发生椎体压缩性骨折后,椎体成形术可明显缓解疼痛,但需注意手术并发症的可能。后凸成形术中球囊扩张形成的腔隙有利于骨水泥稳定填充,减少渗漏[74]。椎体爆裂性骨折、脊柱不稳定或形成严重后凸或侧凸畸形者,需在充分术前评估下,酌情采用内固定及脊柱融合术[75]。
关节置换手术:OI患者,发生严重或反复的关节内骨折,可能导致创伤性关节炎,骨骼疾病本身也可进一步加重创伤性关节炎。成年OI患者的创伤性关节炎常选择保守治疗,对于保守治疗不能缓解疼痛、日常生活明显受影响及需要用助行器辅助行走者,可考虑关节置换手术[76]。术前须充分评估骨骼的强度、肢体的力线,选择合适的关节假体。OI患者关节置换术后松动风险较大,翻修率较高,建议选用骨水泥假体[76-77]。未见大样本OI患者行关节置换手术的报道,因此手术效果尚不确定,选择关节置换手术应慎重考虑。
值得注意的是,由于儿童患者行椎体成形术、脊柱内固定及脊柱融合术、关节置换术的临床资料很少,须根据临床情况谨慎判断手术指征,尤其对低龄儿童一般不建议手术治疗。
肢体及脊柱矫形手术:四肢矫形手术适合于肢体反复发生骨折、骨折不愈合、形成假关节或肢体畸形严重影响生活质量的OI患者。重度畸形明显增加再骨折的风险,也可能使新发骨折难以愈合[69, 71]。下肢矫形手术可以减轻患儿的疼痛,帮助患儿尽快学习站立和行走[78]。手术方案常选择截骨矫形联合髓内钉内固定术,可根据下肢畸形的严重程度及骨骼形态选用开放截骨或经皮微创截骨。手术时机建议选择患儿开始尝试站立且学习走路之前[67];同时患儿长骨的髓腔直径达到能够放置弹性髓内钉或可延长髓内钉的标准[79-81]。手术最主要并发症为截骨后骨愈合不良,治疗方法包括植骨及接骨板辅助髓内钉内固定。
骨骺已闭合的成年患者,可使用常规髓内钉。术中根据患者的髓腔宽度进行适当扩髓,尽量植入大直径髓内钉并行远近端交锁,以增加内固定系统的稳定性[80]。截骨后断端可行自体骨或同种异体骨植骨[82]。对于骨骺未闭合的儿童患者,应注意保护骨骺、保持患肢生长潜能,此时弹性髓内钉具有优势[80-81, 83]。但弹性髓内钉易发生退钉、髓内钉末端刺激局部软组织、突出部位穿破皮肤引发感染、肢体短缩、内外翻畸形等并发症。为保护关节、减少髓内钉移位、降低手术创伤,可使用可延长髓内钉[84]。
上肢畸形矫治的主要适应证为反复骨折导致肢体活动严重受限。上肢畸形严重影响患者生活质量时,可通过手术恢复患肢功能,提升自理能力[85]。由于上肢长骨髓腔较细,可使用直径较小的克氏针,其放置方法简单,与可延长髓内钉相似[85]。术后无需延长制动时间,建议佩戴支具,尽早开始康复训练。
OI患者具有骨质疏松、韧带松弛的特点,并发脊柱侧凸或后凸发生率较高, 可能明显影响患者肺功能[86]。OI患者脊柱侧凸角度超过45°时,建议手术治疗,以保护肺功能及改善身体外形,手术时机建议选择在青春期开始后[87-90]。但仍应谨慎对OI儿童患者行脊柱融合手术,以保留脊柱的活动度及生长潜能[91]。脊柱矫形手术并发症发生率较高,主要包括术中出血及内固定松动等,建议应用椎弓根螺钉辅以骨水泥强化[92]。术中应进行脊髓监测,以减少神经损伤的风险。
康复治疗
康复训练有助于增强OI患者的肌肉力量,改善活动能力[93]。下列情况康复训练尤为重要:婴幼儿期出现生长发育延迟,创伤、骨折或手术后因畏惧疼痛而影响肢体活动功能。康复训练包括:特定关节的伸展及肌肉力量训练;适当负重训练;水疗;应用适当辅助工具弥补身材短缩、畸形所致生活不便;佩戴合适的下肢支具,弥补关节松弛和肌肉无力对下肢功能的影响;选择合适的助行工具,行走训练等[93]。
分子治疗
OI分子治疗策略包括自体骨髓干细胞基因改良后回输、反义寡核苷酸抑制技术、病毒介导的基因添加技术等[94-97],目前处于研究阶段,尚未应用于OI患者的临床治疗。
OI诊疗流程如图 4所示。

|
| 图 4 成骨不全症诊疗流程图 PCR:聚合酶链反应;AD:常染色体显性;AR:常染色体隐性;NGS:二代测序技术;OI:成骨不全症;25OHD:25羟维生素D;β-CTX:Ⅰ型胶原羧基端肽交联;P1NP:Ⅰ型原胶原氨基端肽 |
综上所述,OI主要是多种致病基因突变,导致骨骼Ⅰ型胶原数量减少或质量异常,引起以骨质疏松、反复骨折和进行性骨骼畸形为主要表现的最常见单基因遗传性疾病,致病基因突变谱和疾病表型谱复杂多样。尽早进行临床诊断和给予双膦酸盐等药物治疗,有助于增加患者的骨密度、降低骨折风险,改善疾病预后。必要时,完成疾病的分子诊断,有助于了解疾病发生机制、疾病分型和遗传咨询。对于并发不稳定性骨折、明显影响患者生活质量的严重骨骼畸形或重度创伤性关节炎的OI患者,恰当的手术治疗和康复治疗有助于改善患者的活动能力、提高其生活质量。
《成骨不全症临床诊疗指南》编写组顾 问:廖二元 孟迅吾 徐 苓 张抒扬 张学
组 长:夏维波
副 组 长:章振林 林 华 金小岚 余 卫 付 勤
执行组长:李 梅
秘 书:王 鸥 袁凌青
成 员(按姓氏笔划排序):
丁 悦 王以朋 王 鸥 王 强 付 勤 朱 梅 刘建民 李 梅 李玉坤 李明全
吴 文 余 卫 沈 霖 孟迅吾 陈 林 陈德才 张 学 张抒扬 张 浩 张 嘉
林 华 林建华 金小岚 岳 华 郑丽丽 赵秀丽 侯建明 徐 苓 夏维波 袁凌青
徐又佳 唐 海 高 鹏 盛志峰 章振林 谢忠建 程晓光 廖二元
执 笔 人:李 梅 张 浩 张 嘉 赵秀丽
成员单位:
北京协和医院(孟迅吾、徐苓、张抒扬、夏维波、余卫、王以朋、李梅、张嘉、王鸥、高鹏);中国医学科学院北京协和医学院基础医学研究所医学遗传学系(张学、赵秀丽);上海交通大学附属第六人民医院(章振林、岳华、张浩);南京大学医学院附属鼓楼医院(林华);成都军区总医院(金小岚);中国医科大学附属盛京医院(付勤);中南大学湘雅第二医院(廖二元、谢忠建、袁凌青、盛志峰);第三军医大学大坪医院(陈林);福建省立医院(侯建明);北京积水潭医院(程晓光);天津医科大学总医院(朱梅);郑州大学第一附属医院(郑丽丽);河北医科大学第三医院(李玉坤);上海交通大学医学院附属瑞金医院(刘建民);解放军第323医院脊柱外科(李明全);广东省人民医院(吴文);华中科技大学附属协和医院(沈霖);四川大学华西医院(陈德才);苏州大学附属第二医院(徐又佳);北京友谊医院(唐海);福建医科大学附属第一医院(林建华);广州中山大学孙逸仙纪念医院(丁悦);首都医科大学北京儿童医院(王强)
| [1] | Forlino A, Cabral WA, Barnes AM, et al. New perspectives on osteogenesis imperfecta[J]. Nat Rev Endocrinol, 2011, 7: 540–557. DOI:10.1038/nrendo.2011.81 |
| [2] | Cundy T. Recent advances in osteogenesis imperfecta[J]. Calcif Tissue Int, 2012, 90: 439–449. DOI:10.1007/s00223-012-9588-3 |
| [3] | Forlino A, Marini JC. Osteogenesis imperfecta[J]. Lancet, 2016, 387: 1657–1671. DOI:10.1016/S0140-6736(15)00728-X |
| [4] | Saraff V, Högler W. Endocrinology and adolescence: Osteoporosis in children: diagnosis and management[J]. Eur J Endocrinol, 2015, 173: 185–197. DOI:10.1530/EJE-15-0148 |
| [5] | Van Dijk FS, Sillence DO. Osteogenesis imperfecta: clinical diagnosis, nomenclature and severity assess-ment[J]. Am J Med Genet A, 2014, 164A: 1470–1481. |
| [6] | Tournis S, Dede AD. Osteogenesis imperfecta-a clini-cal update[J]. Metabolism, 2018, 80: 27–37. DOI:10.1016/j.metabol.2017.06.001 |
| [7] | Marini JC, Forlino A, Bachinger HP, et al. Osteogenesis imperfecta[J]. Nat Rev Dis Primers, 2017, 3: 17052. DOI:10.1038/nrdp.2017.52 |
| [8] | Sato A, Ouellet J, Muneta T, et al. Scoliosis in osteogenesis imperfecta caused by COL1A1/COL1A2 mutations—genotype-phenotype correlations and effect of bisphosphonate treatment[J]. Bone, 2016, 86: 53–57. DOI:10.1016/j.bone.2016.02.018 |
| [9] | Grover M, Campeau PM, Lietman CD, et al. Osteogenesis imperfecta without features of type Ⅴ caused by a mutation in the IFITM5 gene[J]. J Bone Miner Res, 2013, 28: 2333–2337. DOI:10.1002/jbmr.1983 |
| [10] | Sillence DO, Rimoin DL. Classification of osteogenesis imperfect[J]. Lancet, 1978, 1: 1041–1042. |
| [11] | Zhang ZL, Zhang H, Ke YH, et al. The identification of novel mutations in COL1A1, COL1A2, and LEPRE1 genes in Chinese patients with osteogenesis imperfecta[J]. J Bone Miner Metab, 2012, 30: 69–77. DOI:10.1007/s00774-011-0284-6 |
| [12] | Liu Y, Song LJ, Lv F, et al. Gene mutation spectrum and genotype-phenotype correlation in Chinese osteogenesis imperfecta patients revealed by targeted next generation sequencing[J]. Osteoporos Int, 2017, 28: 2985–2995. DOI:10.1007/s00198-017-4143-8 |
| [13] | Glorieux FH, Rauch F, Plotkin H, et al. Type Ⅴ osteogenesis imperfecta: a new form of brittle bone disease[J]. J Bone Miner Res, 2000, 15: 1650–1658. DOI:10.1359/jbmr.2000.15.9.1650 |
| [14] | Zhang Z, Li M, He JW, et al. Phenotype and genotype analysis of Chinese patients with osteogenesis imperfecta type Ⅴ[J]. PLoS One, 2013, 8: e72337. DOI:10.1371/journal.pone.0072337 |
| [15] | Liu Y, Wang J, Ma D, et al. Osteogenesis imperfecta type Ⅴ: genetic and clinical findings in eleven Chinese patients[J]. Clin Chim Acta, 2016, 462: 201–209. DOI:10.1016/j.cca.2016.09.019 |
| [16] | Glorieux FH, Ward LM, Rauch F, et al. Osteogenesis imperfecta type Ⅵ: a form of brittle bone disease with a mineralization defect[J]. J Bone Miner Res, 2002, 17: 30–38. DOI:10.1359/jbmr.2002.17.1.30 |
| [17] | Becker J, Semler O, Gilissen C, et al. Exome sequencing identifies truncating mutations in human SERPINF1 in autosomal-recessive osteogenesis imperfecta[J]. Am J Hum Genet, 2011, 88: 362–371. DOI:10.1016/j.ajhg.2011.01.015 |
| [18] | Wang JY, Liu Y, Song LJ, et al. Novel mutations in SERPINF1 result in rare osteogenesis imperfecta type Ⅵ[J]. Calcif Tissue Int, 2017, 100: 55–66. DOI:10.1007/s00223-016-0201-z |
| [19] | Rauch F, Husseini A, Roughley P, Glorieux FH, et al. Lack of circulating pigment epithelium-derived factor is a marker of osteogenesis imperfecta type Ⅵ[J]. J Clin Endocrinol Metab, 2012, 97: E1550–E1556. DOI:10.1210/jc.2012-1827 |
| [20] | Chang W, Barnes AM, Cabral WA, et al. Prolyl 3-hydroxylase 1 and CRTAP are mutually stabilizing in the endoplasmic reticulum collagen prolyl 3-hydroxyla-tion complex[J]. Hum Mol Genet, 2010, 19: 223–234. DOI:10.1093/hmg/ddp481 |
| [21] | Ward LM, Rauch F, Travers R, et al. Osteogenesis imperfecta type Ⅶ: an autosomal recessive form of brittle bone disease[J]. Bone, 2002, 31: 12–18. DOI:10.1016/S8756-3282(02)00790-1 |
| [22] | Cabral WA, Chang W, Barnes AM, et al. Prolyl 3-hydroxylase 1 deficiency causes a recessive metabolic bone disorder resembling lethal/severe osteogenesis imperfecta[J]. Nat Genet, 2007, 39: 359–365. DOI:10.1038/ng1968 |
| [23] | van Dijk FS, Nesbitt IM, Zwikstra EH, et al. PPIB mutations cause severe osteogenesis imperfecta[J]. Am J Hum Genet, 2009, 85: 521–527. DOI:10.1016/j.ajhg.2009.09.001 |
| [24] | Christiansen HE, Schwarze U, Pyott SM, et al. Homozygosity for a missense mutation in SERPINH1, which encodes the collagen chaperone protein HSP47, results in severe recessive osteogenesis imperfecta[J]. Am J Hum Genet, 2010, 86: 389–398. DOI:10.1016/j.ajhg.2010.01.034 |
| [25] | Zhou P, Liu Y, Lv F, et al. Novel mutations in FKBP10 and PLOD2 cause rare Bruck syndrome in Chinese patients[J]. PLoS One, 2014, 9: e107594. DOI:10.1371/journal.pone.0107594 |
| [26] | Alanay Y, Avaygan H, Camacho N, et al. Mutations in the gene encoding the RER protein FKBP65 cause autosomal-recessive osteogenesis imperfecta[J]. Am J Hum Genet, 2010, 86: 551–559. DOI:10.1016/j.ajhg.2010.02.022 |
| [27] | Lapunzina P, Aglan M, Temtamy S, et al. Identification of a frameshift mutation in Osterix in a patient with recessive osteogenesis imperfecta[J]. Am J Hum Genet, 2010, 87: 110–114. DOI:10.1016/j.ajhg.2010.05.016 |
| [28] | Fiscaletti M, Biggin A, Bennetts B, et al. Novel variant in Sp7/Osx associated with recessive osteogene-sis imperfecta with bone fragility and hearing impair-ment[J]. Bone, 2018, 110: 66–75. DOI:10.1016/j.bone.2018.01.031 |
| [29] | Cho SY, Asharani PV, Kim OH, et al. Identification and in vivo functional characterization of novel compound heterozygous BMP1 variants in osteogenesis imperfecta[J]. Hum Mutat, 2015, 36: 191–195. DOI:10.1002/humu.2015.36.issue-2 |
| [30] | Martinez-Glez V, Valencia M, Caparros-Martin JA, et al. Identification of a mutation causing deficient BMP1/mTLD proteolytic activity in autosomal recessive osteogenesis imperfecta[J]. Hum Mutat, 2012, 33: 343–350. DOI:10.1002/humu.21647 |
| [31] | Lv F, Xu XJ, Wang JY, et al. Two novel mutations in TMEM38B result in rare autosomal recessive osteogenesis imperfecta[J]. J Hum Genet, 2016, 61: 539–545. DOI:10.1038/jhg.2016.11 |
| [32] | Shaheen R, Alazami AM, Alshammari MJ, et al. Study of autosomal recessive osteogenesis imperfecta in Arabia reveals a novel locus defined by TMEM38B mutation[J]. J Med Genet, 2012, 49: 630–635. DOI:10.1136/jmedgenet-2012-101142 |
| [33] | Liu Y, Song L, Ma D, et al. Genotype-phenotype analysis of a rare type of osteogenesis imperfecta in four Chinese families with WNT1 mutations[J]. Clin Chim Acta, 2016, 461: 172–180. DOI:10.1016/j.cca.2016.07.012 |
| [34] | Fahiminiya S, Majewski J, Mort J, et al. Mutations in WNT1 are a cause of osteogenesis imperfecta[J]. J Med Genet, 2013, 50: 345–348. DOI:10.1136/jmedgenet-2013-101567 |
| [35] | Laine CM, Joeng KS, Campeau PM, et al. WNT1 mutations in early-onset osteoporosis and osteogenesis imperfecta[J]. N Engl J Med, 2013, 368: 1809–1816. DOI:10.1056/NEJMoa1215458 |
| [36] | Keller RB, Tran TT, Pyott SM, et al. Monoallelic and biallelic CREB3L1 variant causes mild and severe osteogenesis imperfecta, respectively[J]. Genet Med, 2018, 20: 411–419. DOI:10.1038/gim.2017.115 |
| [37] | Symoens S, Malfait F, D'Hondt S, et al. Deficiency for the ER-stress transducer OASIS causes severe recessive osteogenesis imperfecta in humans[J]. Orphanet J Rare Dis, 2013, 8: 154. DOI:10.1186/1750-1172-8-154 |
| [38] | Mendoza-Londono R, Fahiminiya S, Majewski J, et al. Recessive osteogenesis imperfecta caused by missense mutations in SPARC[J]. Am J Hum Genet, 2015, 96: 979–985. DOI:10.1016/j.ajhg.2015.04.021 |
| [39] | Oeffner F, Fischer G, Happle R, et al. IFAP syndrome is caused by deficiency in MBTPS2, an intramembrane zinc metalloprotease essential for choles-terol homeostasis and ER stress response[J]. Am J Hum Genet, 2009, 84: 459–467. DOI:10.1016/j.ajhg.2009.03.014 |
| [40] | Lv F, Xu X, Song Y, et al. Novel Mutations in PLOD2 Cause Rare Bruck Syndrome[J]. Calcif Tissue Int, 2018, 102: 296–309. DOI:10.1007/s00223-017-0360-6 |
| [41] | Rauch F, Fahiminiya S, Majewski J, et al. Cole-Carpenter syndrome is caused by a heterozygous missense mutation in P4HB[J]. Am J Hum Genet, 2015, 96: 425–431. DOI:10.1016/j.ajhg.2014.12.027 |
| [42] | Garbes L, Kim K, Riess A, et al. Mutations in SEC24D, encoding a component of the COPⅡ machinery, cause a syndromic form of osteogenesis imperfecta[J]. Am J Hum Genet, 2015, 96: 432–439. DOI:10.1016/j.ajhg.2015.01.002 |
| [43] | Zhang H, Yue H, Wang C, et al. Novel mutations in the SEC24D gene in Chinese families with autosomal recessive osteogenesis imperfecta[J]. Osteoporos Int, 2017, 28: 1473–1480. DOI:10.1007/s00198-016-3866-2 |
| [44] | Lv F, Ma M, Liu W, et al. A novel large fragment deletion in PLS3 causes rare X-linked early-onset osteoporosis and response to zoledronic acid[J]. Osteoporos Int, 2017, 28: 2691–2700. DOI:10.1007/s00198-017-4094-0 |
| [45] | Pyott SM, Pepin MG, Schwarze U, et al. Recurrence of perinatal lethal osteogenesis imperfecta in sibships: parsing the risk between parental mosaicism for dominant mutations and autosomal recessive inheritance[J]. Genet Med, 2011, 13: 125–130. DOI:10.1097/GIM.0b013e318202e0f6 |
| [46] | 赵秀丽, 肖继芳, 汪涵, 等. 成骨不全症患者COL1A1/2致病突变谱和基因诊断研究[J]. 中华医学杂志, 2015, 95: 3484–3489. DOI:10.3760/cma.j.issn.0376-2491.2015.43.002 |
| [47] | van Dijk FS, Huizer M, Kariminejad A, et al. Com-plete COL1A1 allele deletions in osteogenesis imperfecta[J]. Genet Med, 2010, 12: 736–741. DOI:10.1097/GIM.0b013e3181f01617 |
| [48] | van Dijk FS, Byers PH, Dalgleish R, et al. EMQN best practice guidelines for the laboratory diagnosis of osteogenesis imperfecta[J]. Eur J Hum Genet, 2012, 20: 11–19. DOI:10.1038/ejhg.2011.141 |
| [49] | McInerney-Leo AM, Marshall MS, Gardiner B, et al. Whole exome sequencing is an efficient, sensitive and specific method of mutation detection in osteogenesis imperfecta and Marfan syndrome[J]. Bonekey Rep, 2013, 2: 456. |
| [50] | Belkadi A, Bolze A, Itan Y, et al. Whole-genome sequencing is more powerful than whole-exome sequencing for detecting exome variants[J]. Proc Natl Acad Sci USA, 2015, 112: 5473–5478. DOI:10.1073/pnas.1418631112 |
| [51] | Trejo P, Rauch F. Osteogenesis imperfecta in children and adolescents-new developments in diagnosis and treatment[J]. Osteoporos Int, 2016, 27: 3427–3437. DOI:10.1007/s00198-016-3723-3 |
| [52] | Dwan K, Phillipi CA, Steiner RD, et al. Bisphosphonate therapy for osteogenesis imperfecta[J]. Cochrane Database Syst Rev, 2016, 10: CD005088. |
| [53] | Hoyer-Kuhn H, Netzer C, Koerber F, et al. Two years' experience with denosumab for children with osteogenesis imperfecta type Ⅵ[J]. Orphanet J Rare Dis, 2014, 26, 9: 145. |
| [54] | Ward LM, Rauch F, Whyte MP, et al. Alendronate for the treatment of pediatric osteogenesis imperfecta: a randomized placebo-controlled study[J]. J Clin Endocrinol Metab, 2011, 96: 355–364. DOI:10.1210/jc.2010-0636 |
| [55] | Bishop N, Adami S, Ahmed SF, et al. Risedronate in children with osteogenesis imperfecta: a randomised, double-blind, placebo-controlled trial[J]. Lancet, 2013, 382: 1424–1432. DOI:10.1016/S0140-6736(13)61091-0 |
| [56] | Rauch F, Travers R, Plotkin H, et al. The effects of intravenous pamidronate on the bone tissue of children and adolescents with osteogenesis imperfecta[J]. J Clin Invest, 2002, 110: 1293–1299. DOI:10.1172/JCI0215952 |
| [57] | Palomo T, Fassier F, Ouellet J, et al. Intravenous bisphosphonate therapy of young children with osteogenesis imperfecta: skeletal findings during follow up throughout the growing years[J]. J Bone Miner Res, 2015, 30: 2150–2157. DOI:10.1002/jbmr.2567 |
| [58] | Li M, Xia WB, Xing XP, et al. Benefit of infusions with ibandronate treatment in children with osteogenesis imperfecta[J]. Chin Med J (Engl), 2011, 124: 3049–3053. |
| [59] | Lv F, Liu Y, Xu X, et al. Effects of long term alendronate treatment on a large sample of children or adolescents with osteogenesis imperfecta[J]. Endocr Pract, 2016, 22: 1369–1376. DOI:10.4158/EP161322.OR |
| [60] | Lv F, Liu Y, Xu X, et al. Zoledronic acid versus alendronate in the treatment of children with osteogen-esis imperfecta: a 2-year clinical study[J]. Endocr Pract, 2018, 24: 179–188. DOI:10.4158/EP171910.OR |
| [61] | 宋玉文, 吕芳, 李路娇, 等. 双膦酸盐治疗成骨不全症达药物假期时患者临床特点分析[J]. 中华骨质疏松和骨矿盐疾病杂志, 2018, 11: 113–119. DOI:10.3969/j.issn.1674-2591.2018.02.002 |
| [62] | Munns CF, Rajab MH, Hong J, et al. Acute phase response and mineral status following low dose intravenous zoledronic acid in children[J]. Bone, 2007, 41: 366–370. DOI:10.1016/j.bone.2007.05.002 |
| [63] | Bhatt RN, Hibbert SA, Munns CF. The use of bisphosphonates in children: review of the literature and guidelines for dental management[J]. Aust Dent J, 2014, 59: 9–19. DOI:10.1111/adj.12140 |
| [64] | Orwoll ES, Shapiro J, Veith S, et al. Evaluation of teriparatide treatment in adults with osteogenesis imperfecta[J]. J Clin Invest, 2014, 124: 491–498. DOI:10.1172/JCI71101 |
| [65] | Hoyer-Kuhn H, Stark C, Franklin J, et al. Correlation of bone mineral density on quality of life in patients with osteogenesis imperfecta during treatment with denosumab[J]. Pediatr Endocrinol Rev, 2017, 15: 123–129. |
| [66] | Chiarello E, Donati D, Tedesco G, et al. Conservative versus surgical treatment of osteogenesis imperfecta: A retrospective analysis of 29 patients[J]. Clin Cases Miner Bone Metab, 2012, 9: 191–194. |
| [67] | Shapiro JR, Sponsellor PD. Osteogenesis imperfecta: questions and answers[J]. Curr Opin Pediatr, 2009, 21: 709–716. DOI:10.1097/MOP.0b013e328332c68f |
| [68] | Peddada KV, Sullivan BT, Margalit A, et al. Fracture patterns differ between osteogenesis imperfecta and routine pediatric fractures[J]. J Pediatr Orthop, 2018, 38: e207–e212. DOI:10.1097/BPO.0000000000001137 |
| [69] | Roberts TT, Cepela DJ, Uhl RL, et al. Orthopaedic considerations for the adult with osteogenesis imper-fecta[J]. J Am Acad Orthop Surg, 2016, 24: 298–308. DOI:10.5435/JAAOS-D-15-00275 |
| [70] | Cho TJ, Lee K, Oh CW, et al. Locking plate placement with unicortical screw fixation adjunctive to intramedullary rodding in long bones of patients with osteogenesis imperfecta[J]. J Bone Joint Surg Am, 2015, 97: 733–737. DOI:10.2106/JBJS.N.01185 |
| [71] | Cole WG. Early surgical management of severe forms of osteogenesis imperfecta[J]. Am J Med Genet, 1993, 15, 45: 270–274. |
| [72] | 文玉伟, 王强, 宋宝健, 等. 应用单臂多功能外固定器治疗儿童病理性骨折[J]. 临床小儿外科杂志, 2018, 17: 117–121. |
| [73] | Munns CF, Rauch F, Zeitlin L, et al. Delayed osteotomy but not fracture healing in pediatric osteogenesis imperfecta patients receiving pamidronate[J]. J Bone Miner Res, 2004, 19: 1779–1786. DOI:10.1359/JBMR.040814 |
| [74] | Fürstenberg CH, Grieser T, Wiedenhöfer B, et al. The role of kyphoplasty in the management of osteogenesis imperfecta: Risk or benefit?[J]. Eur Spine J, 2010, 19(Suppl 2): S144–148. |
| [75] | Jones M, Breakwell L, Cole A, et al. Type Ⅴ osteogenesis imperfecta undergoing surgical correction for scoliosis[J]. Eur Spine J, 2018, 27: 2079–2084. DOI:10.1007/s00586-018-5465-8 |
| [76] | Krishnan H, Patel NK, Skinner JA, et al. Primary and revision total hip arthroplasty in osteogenesis imperfecta[J]. Hip Int, 2013, 23: 303–309. DOI:10.5301/hipint.5000014 |
| [77] | Nishimura A, Hasegawa M, Kato K, et al. Total knee arthroplasty in osteogenesis imperfecta: case report[J]. Knee, 2008, 15: 494–496. DOI:10.1016/j.knee.2008.07.005 |
| [78] | Esposito P, Plotkin H. Surgical treatment of osteogen-esis imperfecta: current concepts[J]. Curr Opin Pediatr, 2008, 20: 52–57. DOI:10.1097/MOP.0b013e3282f35f03 |
| [79] | Ashby E, Montpetit K, Hamdy RC, Fassier F. Functional outcome of humeral rodding in children with osteogenesis imperfecta[J]. J Pediatr Orthop, 2018, 38: 49–53. DOI:10.1097/BPO.0000000000000729 |
| [80] | Wall EJ, Jain V, Vora V, et al. Complications of titanium and stainless steel elastic nail fixation of pediatric femoral fractures[J]. J Bone Joint Surg Am, 2008, 90: 1305–1313. DOI:10.2106/JBJS.G.00328 |
| [81] | Ruck J, Dahan-Oliel N, Montpetit K, et al. Fassier-Duval femoral rodding in children with osteogenesis imperfecta receiving bisphosphonates: functional outco-mes at one year[J]. J Child Orthop, 2011, 5: 217–224. DOI:10.1007/s11832-011-0341-7 |
| [82] | Pinder E, Fok J, Crossman P. Scaphoid non-union in osteogenesis imperfecta[J]. BMJ Case Rep, 2016, 11: 2016. |
| [83] | 高鹏, 李梅, 范彧, 等. 多段截骨矫形治疗成骨不全性下肢多骨畸形的临床研究[J]. 中华骨与关节外科杂志, 2018, 11: 426–431. DOI:10.3969/j.issn.2095-9958.2018.06.006 |
| [84] | Lang-Stevenson AI, Sharrard WJ. Intramedullary rodding with Bailey-Dubow extensible rods in osteogenesis imperfecta. An interim report of results and complications[J]. J Bone Joint Surg Br, 1984, 66: 227–232. |
| [85] | Cole WG. Orthopaedic treatment of osteogenesis imperfecta[J]. Ann N Y Acad Sci, 1988, 543: 157–166. DOI:10.1111/nyas.1988.543.issue-1 |
| [86] | Wekre LL, Kjensli A, Aasand K, et al. Spinal deformities and lung function in adults with osteogenesis imperfecta[J]. Clin Respir J, 2014, 8: 437–443. DOI:10.1111/crj.2014.8.issue-4 |
| [87] | Song D, Maher CO. Spinal disorders associated with skeletal dysplasias and syndromes[J]. Neurosurg Clin N Am, 2007, 18: 499–514. DOI:10.1016/j.nec.2007.05.004 |
| [88] | Janus GJ, Finidori G, Engelbert RH, et al. Operative treatment of severe scoliosis in osteogenesis imperfecta: results of 20 patients after halo traction and posterior spondylodesis with instrumentation[J]. Eur Spine J, 2000, 9: 486–491. DOI:10.1007/s005860000165 |
| [89] | Widmann RF, Bitan FD, Laplaza FJ, et al. Spinal deformity, pulmonary compromise, and quality of life in osteogenesis imperfecta[J]. Spine, 1999, 24: 1673–1678. DOI:10.1097/00007632-199908150-00008 |
| [90] | Kocher MS, Shapiro F. Osteogenesis imperfecta[J]. J Am Acad Orthop Surg, 1998, 6: 225–236. DOI:10.5435/00124635-199807000-00004 |
| [91] | Wallace MJ, Kruse RW, Shah SA. The spine in patients with osteogenesis imperfecta[J]. J Am Acad Orthop Surg, 2017, 2: 100–109. |
| [92] | Engelbert RH, Uiterwaal CS, van derHulst A, et al. Scoliosis in children with osteogenesis imperfecta: Influence of severity of disease and age of reaching motor milestones[J]. Eur Spine J, 2003, 12: 130–134. |
| [93] | Hoyer-Kuhn H, Semler O, Stark C, et al. A specialized rehabilitation approach improves mobility in children with osteogenesis imperfecta[J]. J Musculoskelet Neuronal Interact, 2014, 14: 445–453. |
| [94] | Mehrotra M, Rosol M, Ogawa M, et al. Amelioration of a mouse model of osteogenesis imperfecta with hematopoietic stem cell transplantation: microcomputed tomography studies[J]. Exp Hematol, 2010, 38: 593–602. DOI:10.1016/j.exphem.2010.04.008 |
| [95] | Dawson PA, Marini JC. Hammerhead ribozymes selectively suppress mutant type Ⅰ collagen mRNA in osteogenesis imperfecta fibroblasts[J]. Nucleic Acids Res, 2000, 28: 4013–4020. DOI:10.1093/nar/28.20.4013 |
| [96] | Chamberlain JR, Schwarze U, Wang PR, et al. Gene targeting in stem cells from individuals with osteogen-esis imperfecta[J]. Science, 2004, 303: 1198–1201. DOI:10.1126/science.1088757 |
| [97] | Lindahl K, Rubin CJ, Kindmark A, et al. Allele dependent silencing of COL1A2 using small interfering RNAs[J]. Int J Med Sci, 2008, 5: 361–365. |
| (收稿日期:2019-01-12) |