骨质疏松症(osteoporosis,OP)是一种全身性骨骼疾病,其特征在于骨量低和微观结构的破坏,且容易发生骨折[1]。废用性骨质疏松症(disuse osteoporosis,DOP)属继发性OP的一种,是由于机械应力刺激减少而引起局部或全身骨量丢失所致的OP[2]。近年来因各种老年性疾病、突发状况而长期卧床所导致的骨功能失用,以及宇航员DOP的高发生率,已引起了重视。目前防治DOP药物价格普遍比较昂贵,治疗效果不持久且不良反应较大。因此,寻找价格便宜、治疗效果持久且不良反应小的药物很有必要。
葛根作为传统中医药,在我国具有分布广泛,价格低廉的优势[3-4],其主要成分是葛根素[5],葛根素属于异黄酮类化合物[6],具有雌激素样活性[7-8],与具有抗OP作用的大豆异黄酮在化学结构上相似。有文献报道葛根素能通过促进成骨细胞分化和增生[9-11]、抑制骨吸收调控骨代谢[12-14]。研究发现其在去卵巢雌性大鼠[15]、老龄化以及糖皮质激素[16]等诱导的OP模型中抗OP效果稳定。本实验以大鼠尾吊模型即后肢悬浮模型为DOP模型,探讨葛根素防治尾吊大鼠发生DOP的效果,对于探究中医药发挥防治OP效果以及开发葛根类新药有重要的意义。
材料与方法仪器与试剂
双能X线骨密度仪(Prodigy,GE公司,美国),AG-X系列台式电子万能试验机(岛津公司,日本),硬组织切片机(SP1600,LEICA公司,德国),酶标仪(BioTeK公司,美国),BX53型正置显微镜(奥林巴斯公司,日本),4A型数显多头磁力恒温搅拌器(金坛区西城新瑞仪器厂),水合氯醛(天津大茂化学试剂公司,中国),ELISA骨形成指标P1NP试剂盒(IDS公司,英国),ELISA骨吸收指标CTX-1试剂盒(IDS公司,英国)。
药品
葛根素购自于宝鸡市辰光生物科技有限公司,批号:20160711,由豆科植物野葛干燥根中提取,分离得到的8-β-D-葡萄吡喃糖-4′,7-二羟基异黄酮,化学式为C21H20O9,具有抗氧化、改善微循环等多种药理活性,本品呈干燥白色结晶性粉末,贮存2~8 ℃,纯度>98%。
实验动物
2月龄Wistar雌性大鼠30只,体质量160~180 g,购自甘肃中医药大学实验动物中心, 实验动物许可证号:SCXK(甘)2015-0002,在SPF级实验中心动物房饲养,饮食、饮水无限制。
分组
将实验动物采用数字表法进行完全随机化分组:对照组(Control组),尾吊组(HLS组),尾吊+葛根素组(HLS+Pur组),每组10只。
尾吊造模
用75%乙醇涂搽大鼠尾巴的表面,去除不洁净的油脂和皮屑,防止感染。将大小适中的医用透气橡皮膏粘贴于需尾吊大鼠远离尾尖部4~5 cm处,附着上制作好的钢丝环,加绕橡皮膏2~3圈固定。尾吊笼子里面的钢环挂钩和钢丝环锁定在一起,通过调节锁链的长短,保持大鼠头低尾高,身体纵轴倾斜与水平轴呈30°左右的夹角,此夹角是尾吊比较适宜的角度[17-18],使大鼠的双后肢在伸直状态下与笼子底部半分离,不能自由活动,前肢着地可自由活动和饮食饮水,即大鼠整体处于废用性状态。
配药及给药
将葛根素粉末少量多次倒入研钵中,一边加蒸馏水一边反复研磨,使葛根素能够充分的溶解于蒸馏水中,配制成1.54 g/L的混悬液,HLS+Pur组以每只大鼠15.4 mg/(kg·d)给药,Control组和HLS组灌同等体积的蒸馏水,每周测一次体质量,根据体质量调整给药剂量。葛根素剂量来源于前期课题组葸慧荣等[19]验证应用的有效葛根素给药剂量,即15.4 mg/(kg·d)。
组织病理学检测
剥离实验大鼠的肝、脾、肺、肾、肾上腺等脏器,使用甲醛溶液浸泡固定,经石蜡包埋HE染色,显微镜下观察组织病理学结果。
骨密度测定
实验大鼠干预4周后,水合氯醛腹腔麻醉,采用腹主动脉采血处死,剥离大鼠的股骨、椎骨,用0.9%氯化钠注射液浸润过的纱布包裹冻存于-20 ℃冰箱,骨密度(bone mineral density,BMD)测定时,自然解冻,置于双能X线BMD检测仪下,检测左侧股骨和椎骨的BMD。
骨生物力学测定
将检测完离体BMD的左侧股骨,放于AG-X生物力学万能机上,以跨距15 mm,加载速度10 mm/min进行三点弯曲实验,记录最大载荷和弹性模量,改换压缩模具,第5腰椎(L5)用砂纸反复打磨至两头平滑之后,置于万能机的不锈钢平台上,以2 mm/min的速度持续行进施加压力,记录最大载荷和弹性模量。
血清生化指标检测
用动脉取血法抽取大鼠血样,5 000 r/min离心15 min,将上层血清冻存于-80℃的冰箱,ELISA试剂盒测定骨形成指标P1NP和骨吸收指标CTX-1,于酶标仪在450 nm检测并运用标准曲线计算出样品中含量,单位为μg/L,试剂盒均来自于IDS公司。酶标仪检测血清的长期变异系数(coefficient of vatiation, CV)为 < ±0.15%,注液精度CV为≤2%(每孔注液300 μL时)。
骨形态计量学检测
在实验进行到13、14 d时,以30 mg/kg剂量给予颈部皮下注射盐酸四环素;23、24 d时,以8 mg/kg剂量给予颈部皮下注射钙黄绿素。分离出的左侧胫骨固定后,经70%乙醇、80%乙醇、90%乙醇,正丁醇,无水乙醇Ⅰ、Ⅱ,二甲苯Ⅰ、Ⅱ各两小时,1号试剂(甲基丙烯酸甲酯200 mL,邻苯二甲酸二丁酯50 mL,二甲苯250 mL)、2号试剂(甲基丙烯酸甲酯400 mL,邻苯二甲酸二丁酯100 mL)、3号试剂(甲基丙烯酸甲酯400 mL,过氧化苯乙酰10 g在37 ℃烘箱干燥24 h,邻苯二甲酸二丁酯100 mL)各5 d脱水浸泡,4号试剂(甲基丙烯酸甲酯400 mL,过氧化苯乙酰30 g在37 ℃烘箱干燥24 h,邻苯二甲酸二丁酯100 mL)60 ℃水浴凝固不脱钙塑料包埋法进行包埋,包埋体置于SP1 600硬组织切片机切片,厚度为610 μm,每个标本切取两张,用1200目的砂纸打磨成形,1500目砂纸精细打磨至几乎与塑脂载玻片同一水平线,一张镜下观察荧光标记及进行荧光量化,另一张经过VG染色,显微镜下观察染色结果,并采用IPP6.0软件进行量化分析。1~4号试剂均需磁力珠搅拌12 h充分混合所配成。
统计学方法
采用SPSS21.0软件进行数据统计分析,用均值±标准差(x±s)表示,不同组间差异用单因素方差分析,符合正态分布且方差齐性用LSD,不符合方差齐性用Games-Howell,进行两两比较,P < 0.05为差异有统计学意义。
结果组织病理学检测
病理学镜下观察发现各脏器均未表现出明显损伤,尾吊模型对脏器损伤较小,实验所采用的葛根素剂量对大鼠组织无不良损伤,无任何不良反应(图 1)。
|
| 图 1 不同干预组大鼠脏器HE染色病理学比较(×10) Figure 1 Comparison of HE staining organ pathology among different intervention group(×10) Control:对照组;HLS:尾吊组;HLS+Pur:尾吊+葛根素组 |
BMD检测结果
与对照组相比,HLS组左侧股骨和椎骨的离体BMD均明显降低(P < 0.01);与HLS组相比,HLS+Pur组左侧股骨和椎骨的离体BMD均有不同程度升高(P < 0.01)(图 2)。
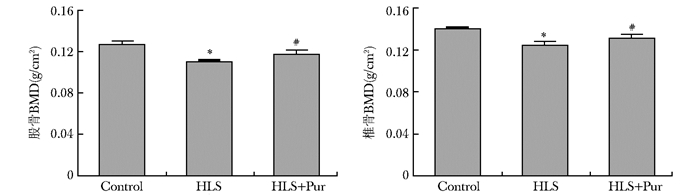
|
| 图 2 不同干预组大鼠股骨和椎骨BMD比较(n=10) Figure 2 Comparison of femoral and vertebral bone mineral density among different intervention group(n=10) Control:对照组;HLS:尾吊组;HLS+Pur:尾吊+葛根素组;BMD:骨密度;与Control组比较,*P < 0.01;与HLS组比较,#P < 0.01 |
骨生物力学检测结果
与对照组相比,HLS组左侧股骨和椎骨的最大载荷和弹性模量均显著下降(P < 0.01);与HLS组相比,HLS+Pur组左侧股骨和椎骨的最大载荷和弹性模量均有上升(P < 0.01)(图 3)。
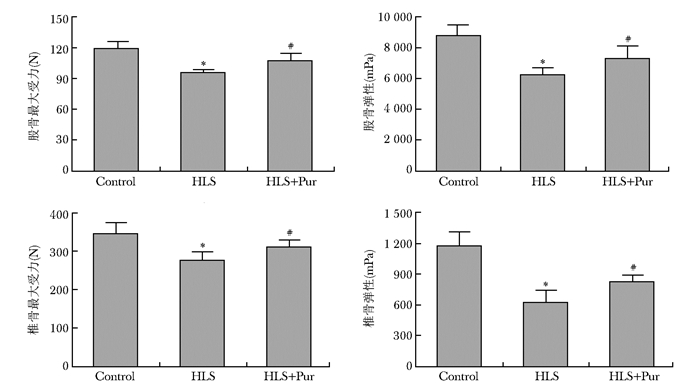
|
| 图 3 不同干预组大鼠股骨三点弯曲试验和椎骨压缩试验参数比较(n=10) Figure 3 Comparison of femoral three point bending test parameters and vertebral compression test parameters among different intervention groups(n=10) Control:对照组;HLS:尾吊组;HLS+Pur:尾吊+葛根素组;与Control组比较,*P < 0.01;与HLS组比较,#P < 0.01 |
血清生化指标检测结果
与对照组相比,HLS组骨形成指标P1NP含量显著减少(P < 0.05),骨吸收指标CTX-1含量显著增加(P < 0.01);与HLS组相比,HLS+Pur组骨形成指标P1NP含量有显著增加(P < 0.01)、骨吸收指标CTX-1含量显著减少(P < 0.01)(图 4)。
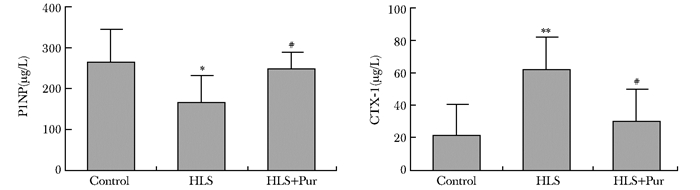
|
| 图 4 不同干预组大鼠血清生化指标比较(n=10) Figure 4 Comparison of serum biochemical markers among different intervention groups(n=10) Control:对照组;HLS:尾吊组;HLS+Pur:尾吊+葛根素组;P1NP:1型前胶原氨基末端肽; CTX-1:1型胶原C端肽; 与Control组比较,*P < 0.05,**P < 0.01;与HLS组比较,#P < 0.01 |
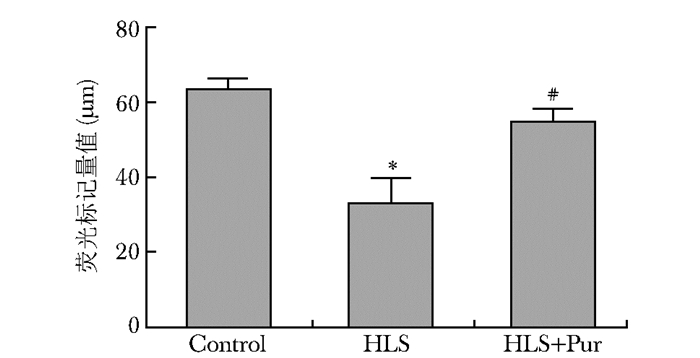
荧光标记结果
在20倍物镜下,可见不同组荧光素之间的距离存在差距(图 5)。与对照组相比,HLS组四环素与钙黄绿素之间的距离显著变小(P < 0.01),而HLS+Pur组四环素与钙黄绿素之间的距离较HLS组显著变大(P < 0.01)(图 6)。

|
| 图 5 不同干预组大鼠胫骨中段皮质骨荧光标记结果比较(×20) Figure 5 Comparison of fluorescence labeling of cortical bone in the middle tibia among different intervention groups(×20) Control:对照组;HLS:尾吊组;HLS+Pur:尾吊+葛根素组; 黄色为四环素,绿色为钙黄绿素 |
|
| 图 6 不同干预组大鼠荧光标记量值比较(n=10) Figure 6 Comparison of fluorescent marker quantification value among different intervention groups(n=10) Control:对照组;HLS:尾吊组;HLS+Pur:尾吊+葛根素组; 与对照组比较,*P < 0.01;与HLS组比较,#P < 0.01 |
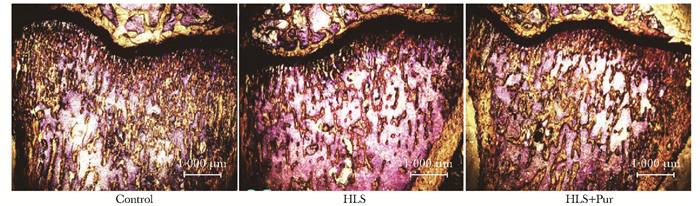
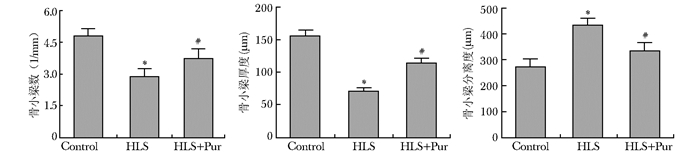
VG染色结果
在4倍物镜下,可见尾吊之后骨小梁比较稀疏,与对照组相比,HLS组的骨小梁数目明显减少、骨小梁的厚度明显变薄、骨小梁分离度明显变大,差异均有统计学意义(P < 0.01)(图 7);而对于葛根素灌胃防治组,骨微结构得到了一定改善,与HLS组相比,HLS+Pur组的骨小梁数目明显增加、骨小梁厚度增加、骨小梁分离度明显变小,差异均有统计学意义(P < 0.01)(图 8)。
|
| 图 7 不同干预组大鼠胫骨近心干骺端VG染色结果比较(×4) Figure 7 Comparison of VG staining in proximal tibial metaphysis among different intervention(×4) Control:对照组;HLS:尾吊组;HLS+Pur:尾吊+葛根素组 |
|
| 图 8 不同干预组大鼠VG染色量化值比较(n=10) Figure 8 Comparison of VG staining quantification value among different intervention(n=10) Control:对照组;HLS:尾吊组;HLS+Pur:尾吊+葛根素组;与Control组比较,*P < 0.01;与HLS组比较,#P < 0.01 |
我国人口老龄化进程的加速、交通事故的意外频发导致逐年增长的DOP发病率已经严重危害了人民的身体健康,而载人航天时宇航员的失重等也可引起DOP,阻碍了我国航天事业的步伐。中医药治疗DOP有着悠久的历史和丰富的经验,越来越得到国内外各界的关注。
中医学中无“废用性骨质疏松”病名,根据其病因病机以及症状,可归属于“骨痿”的范畴。此前,中医临床上常采用具有补肝肾、强筋骨的淫羊藿、骨碎补、菟丝子、蛇床子以及活血化瘀的丹参等药物治疗。葛根甘、辛、凉,归脾胃经,具有解肌退热、透疹、生津止渴、升阳止泻等功效,常被用于颈椎病和心脑血管病的治疗[20-21]。葛根素作为葛根的主要活性成分,现代药理学研究认为其在抵抗心率失常、降血压、保护心肌结构、扩张脑血管、改善微循环、降血糖等多方面都有效果。近年来研究发现葛根素对多种OP有非常好的防治作用,其在预防与治疗DOP方面的作用尚未见报道。本实验初步探究并明确其对DOP模型的防治作用及其机制。
尾吊模型由美国宇航局建立并经Wronski等[22-23]提出和发展,能很好地模拟因患者卧床和航天员失重等引发的DOP。BMD作为OP的诊断标准,早在1994年已经被世界卫生组织(World Health Organization,WHO)所采纳[24]。
BMD越低、骨强度越弱,越容易发生骨折。本实验大鼠尾吊4周以后,与对照组相比,显示股骨和椎骨的BMD明显降低,而经葛根素灌胃后,BMD显著上升,骨量明显增加,表明葛根素可能通过提高BMD预防OP。骨生物力学和骨形态计量学是检测骨质量的重要指标,骨生物力学能够准确测量骨受力与骨韧性的表现情况,骨受力越弱弹性模量越小、OP发生可能性越高。骨形态计量学作为骨微观的反映,能够确切描述骨小梁的情况,骨小梁数目越少、厚度越薄、分离度越大,证明骨质越稀疏。尾吊模型大鼠应用葛根素以后,骨受力明显变大,骨韧性明显上升,骨小梁数目也显著增加,骨小梁厚度明显增加、分离度明显变小,骨骼的机械强度增加且骨微结构得到改善,表明葛根素可以通过提高骨生物力学指标和改善骨形态计量学参数,防治DOP的发生。血清生化指标能客观测定骨形成和骨吸收状态,从本研究血清生化指标的改变可以看出,葛根素防治组P1NP含量活性显著增加,CTX-1活性含量显著减少,葛根素促进了骨形成因子的表达、降低了骨吸收因子的表达,揭示葛根素同时参与了骨形成和骨吸收过程,能促进骨形成、抑制骨吸收。
综上所述,葛根素可以通过提高BMD,提升骨生物力学参数和改善骨微结构,并参与骨形成和骨吸收,对尾吊大鼠发生DOP起到良好的防治作用,为葛根素进一步应用于临床提供了依据。
| [1] | Li B, Bi J, Li W, et al. Effects of pulsed electromagnetic fields on histomorphometry and osteocalcin in disuse osteoporosis rats[J]. Technol Health Care, 2016, 25: 1–8. |
| [2] | 徐晓杰, 李梅. 废用性骨质疏松症诊治进展[J]. 中华骨质疏松和骨矿盐疾病杂志, 2015, 1: 69–73. DOI:10.3969/j.issn.1674-2591.2015.01.16 |
| [3] | 李悦, 李艳菊. 国内外葛根功能食品研究进展[J]. 食品研究与开发, 2007, 28: 174–177. |
| [4] | 刘云, 张瑶, 和润喜. 葛根及葛根食品的研究与开发现状[J]. 中国林副特产, 2010, 1: 94–97. |
| [5] | Wu L, Qiao H, Li Y, et al. Protective roles of puerarin and Danshensu on acute ischemic myocardial injury in rats[J]. Phytomedicine, 2007, 14: 652–658. DOI:10.1016/j.phymed.2007.07.060 |
| [6] | Wei W. Progress of research on puerarin pharmacol-ogical action[J]. Heilongjiang Med J, 2014, 12: 407–414. |
| [7] | Suchinda M, Duangjai T, Sarocha G, et al. Puerarin exhibits weak estrogenic activity in female rats[J]. Fitoterapia, 2010, 81: 569–576. DOI:10.1016/j.fitote.2010.01.019 |
| [8] | Zheng G, Zhang X, Zheng J, et al. Estrogen-like effects of puerarin and total isoflavones from pueraria lobata[J]. J Chin Med Mater, 2002, 25: 566. |
| [9] | Li B, Liu H, Jia S. Puerarin enhances bone mass by promoting osteoblastogenesis and slightly lowering bone marrow adiposity in ovariectomized rats[J]. Biol Pharmaceut Bull, 2014, 37: 1919–1925. DOI:10.1248/bpb.b14-00513 |
| [10] | Wang PP, Zhu XF, Yang L, et al. Puerarin stimulates osteoblasts differentiation and bone formation through estrogen receptor, p38 MAPK, and Wnt/β-catenin pathways[J]. J Asian Nat Prod Res, 2012, 14: 897–905. DOI:10.1080/10286020.2012.702757 |
| [11] | Tiyasatkulkovit W, Charoenphandhu N, Wongdee K, et al. Upregulation of osteoblastic differentiation marker mRNA expression in osteoblast-like UMR106 cells by puerarin and phytoestrogens from pueraria mirifica[J]. Phytomedicine, 2012, 19: 1147–1155. DOI:10.1016/j.phymed.2012.07.010 |
| [12] | Zhang Y, Yan M, Yu QF, et al. Puerarin prevents lps-induced osteoclast formation and bone loss via inhibition of Akt activation[J]. Biol Pharmaceut Bull, 2016, 39: 2028. DOI:10.1248/bpb.b16-00522 |
| [13] | Moriarty K, Kim KH, Bender JR. Minireview: estro-gen receptor-mediated rapid signaling[J]. Endocrinology, 2006, 147: 5557–5563. DOI:10.1210/en.2006-0729 |
| [14] | Binbin L, Shifeng Y. Effect of puerarin on the bone metabolism in vitro[J]. J Beijing Med Univ, 2003, 35: 74. |
| [15] | Suthon S, Jaroenporn S, Charoenphandhu N, et al. Anti-osteoporotic effects of Pueraria candollei var. mirifica on bone mineral density and histomorphometry in estrogen-deficient rats[J]. J Nat Med, 2016, 70: 225–233. DOI:10.1007/s11418-016-0965-5 |
| [16] | Dongdong YU, Shuai MU, Zhao D, et al. Puerarin attenuates glucocorticoid-induced apoptosis of hFOB1.19 cells through the JNK-and Akt-mediated mitochondrial apoptotic pathways[J]. Int J Mol Med, 2015, 36: 345–354. DOI:10.3892/ijmm.2015.2258 |
| [17] | Hargens AR, Steskal J, Johansson C, et al. Tissue fluid shift, forelimb loading and tail tension in tailsuspended rats[J]. Physiologist, 1984, 27: 537–542. |
| [18] | Morey-Holton ER, Globus RK. Hindlimb unloading rodent model: technical aspects[J]. J Appl Physiol, 2012, 92: 1367–1377. |
| [19] | 葸慧荣, 李文苑, 杨芳芳, 等. 中药葛根素对青年大鼠峰值骨量的影响研究[J]. 中国骨质疏松杂志, 2018, 24: 514–519. DOI:10.3969/j.issn.1006-7108.2018.04.019 |
| [20] | 许金海, 莫文. 中药治疗椎动脉型颈椎病用药频次的归纳分析[J]. 中国中医骨伤科杂志, 2010, 10: 16–19. |
| [21] | 张颖, 殷惠军. 植物雌激素的心血管保护作用研究进展[J]. 中华老年心脑血管病杂志, 2012, 14: 991–994. DOI:10.3969/j.issn.1009-0126.2012.09.029 |
| [22] | Wronski TJ, Moreyholton ER. Skeletal response to simulated weightlessness: a comparison of suspension techniques[J]. Aviat Space and Envir Med, 1987, 58: 63–68. |
| [23] | Moreyholton ER, Halloran BP, Garetto LP, et al. Animal housing influences the response of bone to spaceflight in juvenile rats[J]. J Appl Physiol, 2000, 88: 1303. DOI:10.1152/jappl.2000.88.4.1303 |
| [24] | Kanis JA. Assessment of fracture risk and its application to screening for postmenopausal osteoporosis: synopsis of a WHO report. WHO Study Group[J]. Osteoporos Int, 1994, 4: 368–381. DOI:10.1007/BF01622200 |
| (收稿日期:2018-06-08) |

