雌激素是调节骨代谢的主要激素之一,雌激素的缺乏会增加骨细胞介导的骨重构,减少骨量,损害骨微结构,导致骨质疏松[1]。雌激素在防止骨质疏松的同时也能预防血管钙化的发生[2],基质GLA蛋白(matrix GLA protein,MGP)是一个相对分子质量为10 000的维生素K依赖性循环蛋白,是软骨和血管钙化的重要的抑制蛋白[3]。近年来研究发现,基质Gla蛋白与血管钙化密切相关[4]。本课题组前期研究发现雌二醇能上调去卵巢大鼠MGP的表达,但具体机制仍不清楚[5, 6]。Wnt/β-catenin经典信号通路已被证实在成骨细胞的增生、分化、及骨形成过程中起关键作用[7]且该信号通路参与了骨质疏松的发病机制[8]。然而Wnt/β-catenin是否参与了MGP相关的骨质疏松发病机制仍不清楚。本研究在前期动物模型研究的基础上进一步通过体外研究观察17β-E2对人成骨肉瘤细胞株MGP表达的影响,及Wnt/β-catenin信号通路在其中的作用,旨在更深入探讨MGP在骨质疏松症发病机制中的作用。
材料与方法 材料人成骨肉瘤MG63细胞株购自美国培养保存中心(ATCC号:CRL-1427)。无酚红的MEM (minimum essential medium)培养基,胰酶、胎牛血清(fetal bovine serum,FBS)购自美国Hyclone公司,牛血清白蛋白(bull serum albumin,BSA)购自美国Sigma公司,17β-E2购自美国Sigma公司,ICI182780购自美国Sigma公司,DKK-1购自美国PeproTech公司,华法林购自美国LKT公司,兔抗MGP多克隆抗体、鼠抗β-catenin多克隆抗体、鼠抗Runx2单克隆抗体、山羊抗LRP5多克隆抗体均购自美国Abcom公司,鼠抗β-actin单克隆抗体购自美国Anbo公司,蛋白抽提试剂盒购自北京普利莱公司,Trizol购自北京全式金公司,反转录试剂盒购自日本TaKaRa公司,荧光定量试剂盒购自上海Invitrogen公司。
方法细胞培养:取10代人成骨肉瘤细胞MG63细胞株复苏,于含5% CO2、37 ℃培养箱中培养,培养液为含有10% FBS的无酚红MEM。细胞达汇片后按5×105细胞/瓶接种于25 cm2培养瓶,细胞培养液每2天换1次。
干预实验:药物干预:MG63细胞体积达到90%左右时,改用含0.1% BSA的无血清MEM培养液培养2 d,然后分别用17β-E2 10-10、10-8、10-6 mol/L、ICI 10-7 mol/L、ICI 10-7 mol/L+17β-E2 10-8 mol/L干预48 h;17β-E2 10-8 mol/L、DKK-1 200 ng/mL、17β-E2 10-8 mol/L+DKK-1 200 ng/mL干预48 h,17β-E2 10-8 mol/L、华法林10-5 mol/mL、17β-E2 10-8 mol/L+华法林10-5 mol/mL干预48 h,均以0.1% BSA的无血清MEM培养液作为对照组,干预后提取RNA及蛋白。
荧光定量PCR:按Trizol操作步骤提取总RNA。
反转录合成cDNA:按照试剂盒(PrimeScript RT reagent kit,TaKaRa)要求操作,取9 μL RNA样本做反转录反应,反应体系20 μL,反应条件:37 ℃ 15 min,85 ℃ 5 s,1个循环,结束。
荧光定量PCR反应:管家基因GAPDH作为内参基因,引物均由上海Invitrogen公司设计合成,引物序列见表 1,优化反应体系,PCR反应条件:95 ℃预变性3 s,进入循环,95 ℃变性5 s,60 ℃退火34 s,40个循环。每次试验均设置复孔,重复2次。Ct值代表每个样本2次重复的平均Ct值。比较目的基因与GAPDH基因的扩增效率的斜率差异有无统计学意义(P>0.05),以GAPDH基因作为内参照,利用Ct值,应用比较阈值法,即2- △△CT,(2-△△CT所得结果即表示目的基因相对于对照组的倍数,公式为△△Ct=(CtMGP-CtGAPDH)实验组-(CtMGP-CtGAPDH)对照组。如果差异有统计学意义,按Rasmussen计算出相对表达差异。
| 基因 | 引物系列(5′→3′) | 产物长度(bp) |
| MGP | 正向: AGCGCCGAGGGACCAAATGA | 160 |
| 反向:AGGGGTGCAGCCAGACAAGAGA | ||
| β-catenin | 正向:TTTGCGTGAGCAGGGTGCCA | 100 |
| 反向:TTGCTGCTGTGTCCCACCCA | ||
| LRP5 | 正向:AGTTTTCCAAGGGAGCCGTG | 185 |
| 反向:GATGCGGTTGGTCTCTGAGT | ||
| Runx2 | 正向:CACAAGTGCGGTGCAAACTT | 104 |
| 反向:GACTCTGTTGGTCTCGGTGG | ||
| GAHDH | 正向:CAGGGCTGCTTTTAACTCTGGT | 199 |
| 反向:GATTTTGGAGGGATCTCGCT |
Western blotting杂交:按照蛋白抽提试剂盒操作要求抽提总细胞蛋白,测蛋白浓度,取60 μg细胞总蛋白于SDS-PAGE胶中电泳,电湿转至PVDF膜上,5%脱脂奶封闭2 h,孵育一抗过夜,辣根过氧化物酶标记的二抗孵育2 h,化学发光增强试剂自显影,洗片显带,杂交信号用Image master VDS成像分析系统行吸光度检测。
统计学方法采用SPSS17.0统计软件处理实验数据,所有结果均以均数±标准差(x±s)表示,组间比较用单因素方差分析,以P<0.05为差异有统计学意义。
结果 不同浓度17β-E2对MG63细胞MGP表达的影响实时荧光定量PCR及Western blotting杂交结果显示,17β-E2能上调MGP的表达,10-10、10-8、10-6 mol/L 17β-E2干预后、MGP mRNA的表达是对照组的4.63、7.16、2.95倍,MGP蛋白的表达分别是对照组的1.17、1.58、1.28倍,以10-8 mol/L浓度作用最明显。ICI182780是雌激素受体抑制剂,ICI182780浓度为10-7 mol/L组与阴性对照组相比MGP表达差异无统计学意义(P>0.05),而与17β-E2 10-8mol/L联合作用时可阻断17β-E2的作用,与17β-E2 10-8 mol/L的阳性对照组相比,差异有统计学意义(P<0.05)(图 1、2,表 2)。
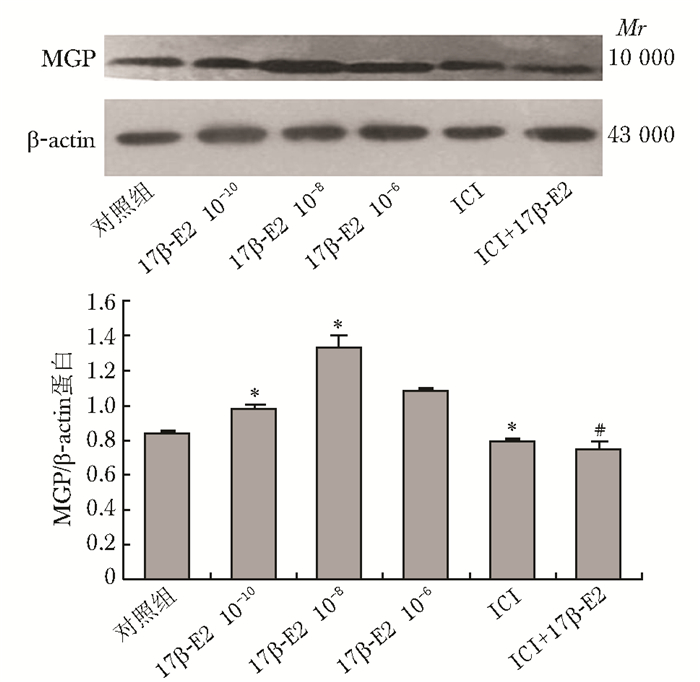
|
| 图 1 17β-E2及其受体抑制剂对MGP蛋白表达的影响 Fig 1 Effects of 17β-E2 and its receptor inhibitor on the MGP expression in MG63 cells MGP:基质GLP蛋白;与对照组比较,*P<0.05;与10-8 mmol/L 17β-E2组比较,#P<0.05 |
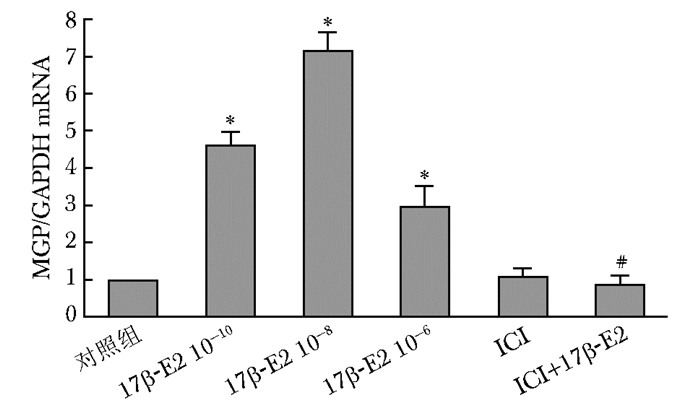
|
| 图2 17β-E2及其受体抑制剂对MGP mRNA表达的影响 Fig 2 Effect of 17β-E2 and its receptor inhibitor on the MGP mRNA expression MGP:基质GLP蛋白;与对照组比较,*P<0.05;与10-8 mmol/L 17β-E2组比较,#P<0.05 |
| 组别 | 样本数 | MGP/β-actin |
| 对照组 | 3 | 0.84±0.015 |
| 17β-E2 10-10 mmol/L | 3 | 0.98±0.021* |
| 10-8 mmol/L | 3 | 1.33±0.074* |
| 10-6 mmol/L | 3 | 1.08±0.010* |
| ICI 10-7mol/L | 3 | 0.79±0.020 |
| ICI10-7mol/L+17β-E2 10-8mol/L | 3 | 0.75±0.044# |
| MGP:基质GLP蛋白;与对照组比较,* P<0.05;与10-8 mmol/L 17β-E2组比较,# P<0.05 | ||
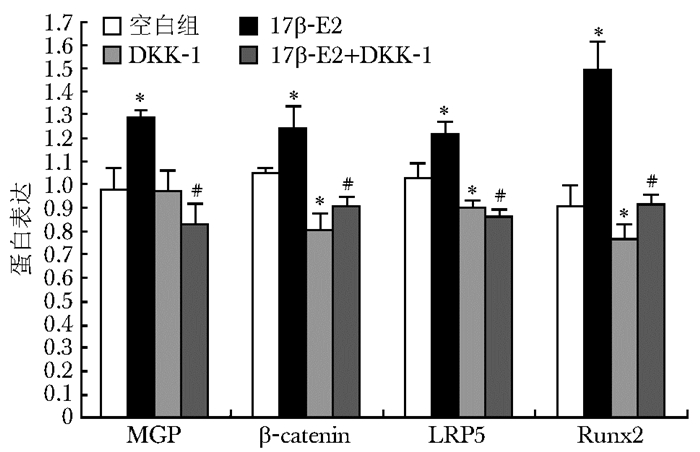
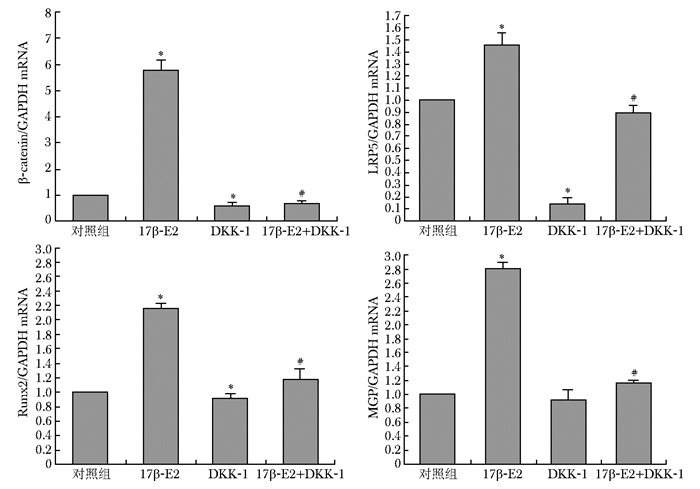
10-8 mol/L 17β-E2作用于MG63细胞以后,能明显提高β-catenin、Runx2、LRP5的表达。其中β-catenin mRNA及蛋白的表达分别是对照组的6.15倍、1.18倍,Runx2 mRNA及蛋白的表达分别是对照组的2.23倍、1.64倍,LRP5 mRNA及蛋白的表达分别是对照组的1.35倍、1.18倍,DKK-1 200 ng/mL作用于细胞以后,能明显下调β-catenin、Runx2、LRP5的表达,但与对照组相比,MGP表达差异无统计学意义(P>0.05)。DKK-1与17β-E2联用能阻断17β-E2的作用,
MGP、β-catenin、Runx2、LRP5的表达下调,差异有统计学意义(P<0.05)(图 3~5,表 3)。
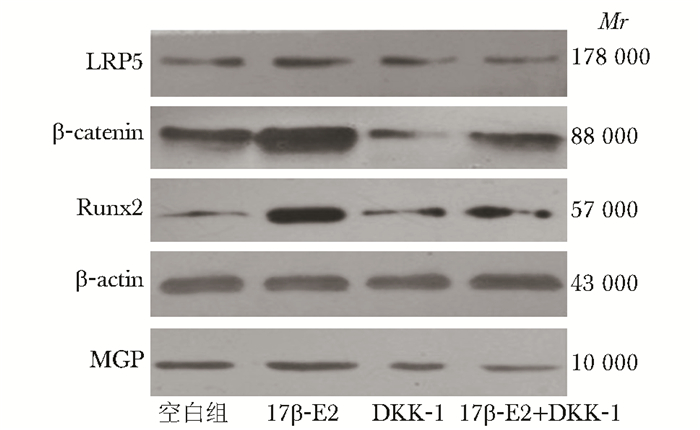
|
| 图 3 17β-E2及DKK-1对MG63细胞Wnt/ β-catenin信号通路中相关蛋白β-catenin、 Runx2、LRP5及MGP表达的影响 Fig 3 Effect of 17β-E2 and DKK-1 on the expression of β-catenin, Runx2, LRP5 and MGP in MG63 cells MGP:基质GLP蛋白 |
|
| 图 4 17β-E2及DKK-1对MG63细胞Wnt/β-catenin 信号通路中相关蛋白β-catenin、Runx2、 LRP5及MGP表达的影响 Fig 4 Effect of 17β-E2 and DKK-1 on the expression of β-catenin、Runx2、LRP5 and MGP in MG63 cells MGP:基质GLP蛋白;与对照组比较,*P<0.05;与10-8 mmol/L 17β-E2组比较,#P<0.05 |
|
| 图 5 17β-E2及DKK-1对MG63细胞Wnt/β-catenin信号通路中相关蛋白β-catenin、Runx2、LRP5 及MGP mRNA表达的影响 Fig 5 Effect of 17β-E2 and DKK-1 on the expression of β-catenin, Runx2, LRP5 and MGP mRNA in MG63 cells MGP:基质GLP蛋白;与对照组比较,*P<0.05;与10-8 mmol/L 17β-E2组比较,#P<0.05 |
| 组别 | 样本数 | MGP/β-actin | β-catenin/β-actin | LRP5/β-actin | Runx2/β-actin |
| 对照组 | 3 | 0.98±0.087 | 1.05±0.02 | 1.03±0.06 | 0.91±0.087 |
| 17β-E2 10-8mmol/L | 3 | 1.29±0.032* | 1.24±0.096* | 1.22±0.043* | 1.49±0.12* |
| DKK-1 200ng/mL | 3 | 0.97±0.09 | 0.81±0.064* | 0.90±0.025* | 0.77±0.061* |
| 17β-E2+DKK-1 | 3 | 0.83±0.09# | 0.91±0.037# | 0.86±0.03# | 0.92±0.04# |
| MGP:基质GLP蛋白;与对照组比较,* P<0.05;与10-8 mmol/L 17β-E2组比较,# P<0.05 | |||||
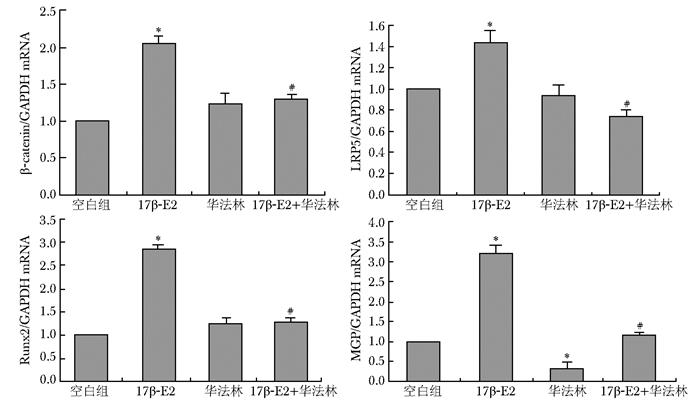
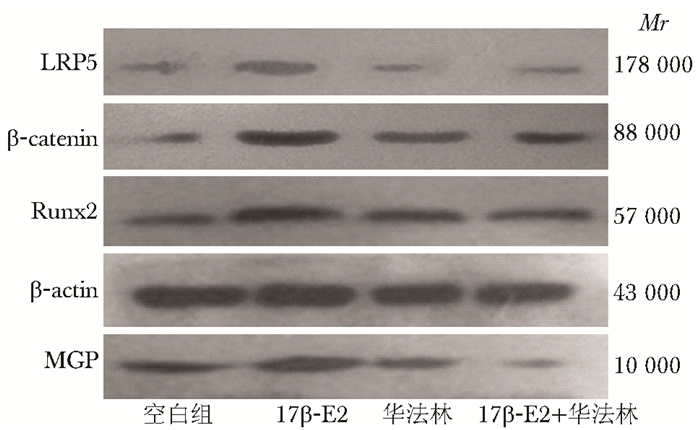
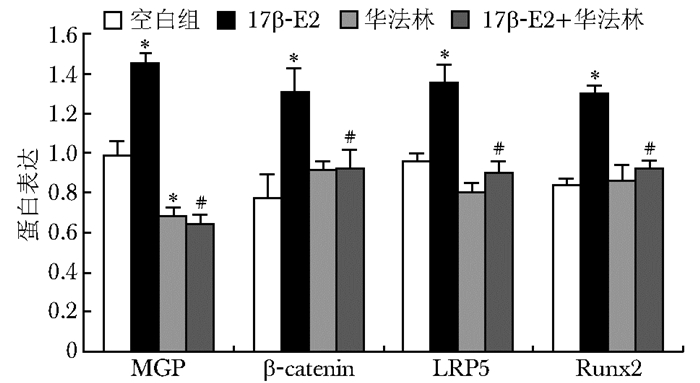
10-8mol/L 17β-E2作用于MG63细胞以后,能明显提高β-catenin、Runx2、LRP5的表达。华法林作用于细胞以后,明显下调MGP的表达,但与对照组相比β-catenin、Runx2、LRP5表达差异无统计学意义(P>0.05)。华法林与17β-E2联用能阻断17β-E2的作用,MGP、β-catenin、Runx2、LRP5的表达下调,差异有统计学意义(P<0.05)(图 6~8,表 4)。
|
| 图 6 17β-E2及华法林对MG63细胞Wnt/β-catenin信号通路中相关蛋白β-catenin、Runx2、LRP5及MGP mRNA表达的影响 Fig 6 Effect of 17β-E2 and warfarin on the mRNA expression of β-catenin,Runx2,LRP5 and MGP protein in MG63 cells MGP:基质GLP蛋白;与对照组比较,*P<0.05;与10-8 mmol/L 17β-E2组比较,#P<0.05 |
|
| 图 7 17β-E2及华法林对MG63细胞Wnt/β-catenin 信号通路中相关蛋白 β-catenin、Runx2、LRP5 及MGP表达的影响 Fig 7 Effect of 17β-E2 and warfarin on the expression of β-catenin,Runx2,LRP5 and MGP protein in MG63 cells MGP:基质GLP蛋白;与对照组比较,*P<0.05; 与10-8 mmol/L 17β-E2组比较,#P<0.05 |
|
| 图 8 17β-E2及华法林对MG63细胞Wnt/β-catenin 信号通路中相关蛋白β-catenin、Runx2、 LRP5及MGP表达的影响 Fig 8 Effect of 17β-E2 and warfarin on the expression of β-catenin,Runx2,LRP5 and MGP mRNA in MG63 cells,detected by real time RT-PCR MGP:基质GLP蛋白;与对照组比较,*P<0.05;与10-8 mmol/L 17β-E2组比较,#P<0.05 |
| 组别 | 样本数 | MGP/β-actin | β-catenin/β-actin | LRP5/β-actin | Runx2/β-actin |
| 对照组 | 3 | 0.99±0.075 | 0.77±0.12 | 0.96±0.038 | 0.84±0.03 |
| 17β-E2 10-8 mmol/L | 3 | 1.45±0.052* | 1.31±0.12* | 1.35±0.093* | 1.30±0.038* |
| DKK-1 200 ng/mL | 3 | 0.68±0.047* | 0.91±0.047 | 0.80±0.042 | 0.86±0.08 |
| 17β-E2+DKK-1 | 3 | 0.64±0.047# | 0.92±0.095# | 0.90±0.058# | 0.92±0.038# |
| MGP:基质GLP蛋白;与对照组比较,* P<0.05;与10-8 mmol/L 17β-E2组比较,# P<0.05 | |||||
雌激素在体内通过抑制骨吸收,促进骨形成,减少骨细胞的凋亡来发挥其骨保护作用[9],但详细的发病机制仍不是十分清楚。同时,许多研究者在研究过程中发现,骨质疏松症患者的同时还常伴有血管钙化,认为两者存在密切的联系[10]。两者是否有必然的联系,是否存在以前没有发现的潜在机制同时影响骨质疏松症和血管钙化,目前还不十分明确。近年来,关于骨质疏松和血管钙化相关性研究热点是MGP[11, 12]。MGP是相对分子质量为10 000的维生素K依赖性蛋白,是骨代谢和异常钙化的重要调节蛋白。诸多研究资料显示,许多影响骨代谢的物质,如雌激素及雌激素受体激动剂、雷洛昔芬、维生素D、维生素K、甲状旁腺激素(parathyroid hormone,PTH)及二磷酸盐均能调节成骨细胞MGP的表达[2, 13, 14, 15, 16]。
骨质疏松药物雌激素能提高MGP的表达。Sheikh等[17]的研究发现,雌激素作用于人乳腺癌细胞48 h以后,MGP的表达提高了3.9倍。Osako等[2]发现,雌激素能明显提高动脉内皮细胞及血管平滑肌细胞中MGP的表达。给予雌激素受体抑制剂后能消除雌激素的这种效应。Osako等[2]通过对去卵巢的同时患有骨质疏松及动脉粥样硬化的小鼠的研究发现,雌激素替代后,通过减少Smad-1、5、8磷酸化及增加MGP的表达抑制骨质疏松及骨形成蛋白的表达及动脉成骨途径。本课题组的前期研究发现,去卵巢SD大鼠用雌激素干预12周以后,血清MGP水平明显升高,骨密度升高,明显高于单纯去卵巢SD大鼠及对照组[5]。这些结果提示MGP在血管钙化及绝经后骨质疏松发病机制中可能起到的作用。本研究观察了3种不同浓度的雌激素及雌激素受体抑制剂对MG63成骨肉瘤细胞MGP表达的影响。本研究发现17β-E2上调MG63细胞MGP mRNA及蛋白的表达。17β-E2浓度分别为10-10 、10-8、10-6 mol/L MGP mRNA的表达是对照组的4.63、7.16、2.95倍,MGP蛋白的表达分别是对照组的1.17倍、1.58倍、1.28倍,以10-8 mol/L的浓度的作用最明显。ICI 182780是雌激素受体抑制剂,ICI182780浓度为10-7mol/L组与对照组相比MGP表达差异无统计学意义,而与17β-E2联合作用时可阻断17β-E2的作用(P<0.05),说明17β-E2是通过雌激素受体发挥对MGP的调节作用。本研究从细胞水平研究了雌激素对MG63细胞MGP表达的影响,提示MGP可能在雌激素相关性骨质疏松过程中发挥重要作用。
诸多研究发现,经典Wnt/β-catenin信号通路在骨形成过程中起重要作用[11, 18]。Wnt属于原癌基因,富含L-半胱氨酸,起编码的Wnt蛋白相对分子质量约39 000~46 000的分泌性糖蛋白。Wnt/β-catenin途径是通过Wnt sb组蛋白与脂蛋白受体相关蛋白(lipoprotein receptor-related protein,LRP)卷曲蛋白(frizzled,FZD),相互结合,经过一系列胞质蛋白(Dsh)的相互作用,使β-catenin在胞内积聚,进而入核与转录因子FCF/LEF-1相互作用,来调节其下游基因的转录。β-catenin是经典Wnt信号通路的关键因子,β-catenin功能的缺失将会影响成骨细胞的增生、分化与成熟。Chen等[19]在用Co12a1-ICAT转基因鼠观察β-catenin的作用时发现,β-catenin的功能缺失后会导致软骨细胞在骨关节面和在关节软骨的表达减少,同时降低软骨细胞的增生与分化,促进软骨细胞的凋亡。LRP5即低密度脂蛋白受体相关蛋白,是经典Wnt信号通路的共受体,能调节成骨细胞的增生与凋亡,调节骨量[20]。RUNX2是一类转录因子蛋白的统称,RUNX2能够激活与启动间充质干细胞(mesenchyma stem cells,MSCS)向成骨细胞系分化并调节MG63成骨肉瘤细胞的成熟,而雌激素能对抗RUNX2相关的破骨细胞形成[21, 22]。Wnt/β-catenin信号通路能够影响RUNX2的活性或者表达水平[23, 24, 25]。由此可见Wnt/β-catenin信号通路中的各相关蛋白均调控成骨细胞的分化及骨形成。本研究对Wnt/β-catenin信号通路相关蛋白研究结果显示10-8 mol/L 17β-E2能提高MGP的表达,同时也能够提高Wnt/β-catenin信号通路相关蛋白β-catenin、LRP5及Runx2的表达,而该通路的抑制剂DKK-1则明显抑制β-catenin、LRP5及Runx2的表达同时阻断17β-E2促MGP表达的作用,从中可以推测,MGP的表达与Wnt/β-catenin信号通路有关。MGP对骨形成的调控的影响有一部分是通过Wnt/β-catenin信号通路起作用。
MGP是维生素K依赖性蛋白,维生素K的补充能上调MGP的表达,抑制血管的钙化[26]。而近期大样本临床研究,维生素K2的补充能很好地防治绝经后骨质疏松[27],而华法林能够通过抗维生素K的作用从而导致MGP的谷氨酸羧化异常,从而影响MGP的合成。Fusaro 等[28]的研究证实华法林能使小鼠骨小梁的变小、数目减少、骨转换增加、骨矿化减少。而本研究体外细胞试验发现华法林干预以后,成骨肉瘤细胞MGP的表达下降,提示华法林对骨微结构和骨矿化的影响可能是通过抑制成骨肉瘤细胞MGP的形成来实现的。华法林与10-8mol/L 17β-E2联用后抑制MGP表达的同时也阻断17β-E2促β-catenin、Runx2、LRP5表达的作用,进一步证实MGP可能参与了Wnt/β-catenin信号通路调控成骨细胞的形成和分化的过程。MGP与Wnt/β-catenin信号通路之间有着密切的关系,但详细的机制有待进一步研究。
由此可见,MGP以及经典Wnt/β-catenin信号通路在雌激素相关的骨质疏松骨代谢中起重要作用。雌激素水平降低,加速骨质疏松的发生与发展,MGP可能通过调节Wnt/β-catenin信号通路中相关蛋白表达来抑制骨重构。本研究观察了成骨肉瘤细胞中MGP与Wnt/β-catenin信号通路之间的关系。今后应进一步验证其他骨质疏松药物如:维生素D、二磷酸盐、PTH、维生素K等作用于成骨细胞以后MGP及经典Wnt/β-catenin信号通路之间的关系,以及MGP基因沉默以后Wnt/β-catenin信号通路活性的变化,为进一步深入研究MGP在骨质疏松症发病机制中的作用奠定基础。
| [1] | Klein-Nulend J,van Oers RF,Bakker AD,et al. Bone cell mechanosensitivity,estrogen deficiency,and osteoporosis[J]. J Biomech,2015,48:855-865. |
| [2] | Osako MK,Nakagami H,Koibuchi N,et al. Estrogen inhibits vascular calcification via vascular RANKL system: common mechanism of osteoporosis and vascular calcification[J]. Circ Res,2010,107:466-475. |
| [3] | Vassalle C,Iervasi G. New insights for matrix Gla protein,vascular calcification and cardiovascular risk and outcome[J]. Atherosclerosis,2014,235:236-238. |
| [4] | Guanghong JR,Deepak MG,Devendra KA. Role of matrix Gla protein in angiotensin II-induced exacerbation of vascular calcificatio[J]. Am J Physiol Heart Circ Physio,2012,303:523-532. |
| [5] | 杨雅,陈姜赖方. 雌二醇对去卵巢大鼠基质GLA蛋白表达的影响[J]. 中华妇产科杂志,2012,47:833-838. |
| [6] | Chen XY,Jiang XH,Lai XY,et al. Effect of estrogen on the expression of matrix GLA protein in ovariectomized SD rats[J]. Zhonghua Fuchanke Zazhi,2012,47:833-838. |
| [7] | Yuan Z,Li Q,Luo S,et al. PPARgamma and Wnt signaling in adipogenic and osteogenic differentiation of mesenchymal stem cells[J]. Curr Stem Cell Res Ther,2016,11:216-225. |
| [8] | Tian J,Xu XJ,Shen L,et al. Association of serum DKK-1 levels with beta-catenin in patients with postmenopausal osteoporosis[J]. J Huazhong Univ Sci Technol Med,2015,35:212-218. |
| [9] | Imai Y,Kondoh S,Kouzmenko A,et al. Minireview: osteoprotective action of estrogens is mediated by osteoclastic estrogen receptor-alpha[J]. Mol Endocrinol, 2010,24:877-885. |
| [10] | Lampropoulos CE,Papaioannou I,D'Cruz DP. Osteoporosis-a risk factor for cardiovascular disease?[J]. Nat Rev Rheumatol,2012,8:587-598. |
| [11] | Yavropoulou MP,Yovos JG. The role of the Wnt signaling pathway in osteoblast commitment and differentiation[J]. Hormones,2007,6:279-294. |
| [12] | Tunon-Le Poultel D,Cannata-Andia JB,Roman-Garcia P,et al. Association of matrix Gla protein gene functional polymorphisms with loss of bone mineral density and progression of aortic calcification[J]. Osteoporosis Int,2014,25:1237-1246. |
| [13] | Gopalakrishnan R,Suttamanatwong S,Carlson AE,et al.Role of matrix Gla protein in parathyroid hormone inhibition of osteoblast mineralization[J]. Cell Tissues Organs, 2005,181:166-175. |
| [14] | Fusaro M,Giannini S,Gallieni M,et al. Calcimimetic and vitamin D analog use in hemodialyzed patients is associated with increased levels of vitamin K dependent proteins[J]. Endocrine,2016,51:333-341. |
| [15] | Rzewuska-Lech E,Jayachandran M,Fitzpatrick LA,et al. Differential effects of 17beta-estradiol and raloxifene on VSMC phenotype and expression of osteoblast-associated proteins[J]. Am J Physiol Endocrinol Metab,2005,289:E105-E112. |
| [16] | Price PA,Faus SA,Williamson MK. Bisphosphonates alendronate and ibandronate inhibit artery calcification at doses comparable to those that inhibit bone resorption[J]. Arterioscl Throm Vas,2001,21:817-824. |
| [17] | Sheikh MS,Shao ZM,Chen JC,et al. Differential regulation of matrix Gla protein (MGP) gene expression by retinoic acid and estrogen in human breast carcinoma cells[J]. Mol Cell Endocrinol,1993,92:153-160. |
| [18] | Matzelle MM,Gallant MA,Condon KW,et al. Resolution of inflammation induces osteoblast function and regulates the Wnt signaling pathway[J]. Arthritis Rheum,2012,64:1540-1550. |
| [19] | Chen M,Zhu M,Awad H,et al. Inhibition of beta-catenin signaling causes defects in postnatal cartilage development[J]. J Cell Sci,2008,121:1455-1465. |
| [20] | Johnson ML. LRP5 and bone mass regulation: Where are we now?[J]. Bone Key Rep,2012,1:1. |
| [21] | Wang W,Zhao L,Ma Q,et al. The role of the Wnt/beta-catenin pathway in the effect of implant topography on MG63 differentiation[J]. Biomaterials,2012,33:7993-8002. |
| [22] | Martin A,Xiong J,Koromila T,et al. Estrogens antagonize RUNX2-mediated osteoblast-driven osteoclastogenesis through regulating RANKL membrane association[J]. Bone,2015,75:96-104. |
| [23] | Hwang JH,Cha PH,Han G,et al. Euodia sutchuenensis Dode extract stimulates osteoblast differentiation via Wnt/beta-catenin pathway activation[J]. Exp Mol Med,2015,47:e152. |
| [24] | Kim HY,Yoon JY,Yun JH,et al. CXXC5 is a negative-feedback regulator of the Wnt/beta-catenin pathway involved in osteoblast differentiation[J]. Cell Death Differ,2015,22:912-920. |
| [25] | Chandra A,Lin T,Zhu J,et al. PTH1-34 blocks radiation-induced osteoblast apoptosis by enhancing DNA repair through canonical Wnt pathway[J]. J Biol Chem,2015,290:157-167. |
| [26] | Krueger T,Schlieper G,Schurgers L,et al. Vitamin K1 to slow vascular calcification in haemodialysis patients (VitaVasK trial): a rationale and study protocol[J]. Nephrol Dial Transpl,2014,29:1633-1638. |
| [27] | Huang ZB,Wan SL,Lu YJ,et al. Does vitamin K2 play a role in the prevention and treatment of osteoporosis for postmenopausal women: a Meta-analysis of randomized controlled trials[J]. Osteoporosis Int,2015,26:1175-1186. |
| [28] | Fusaro M,Dalle Carbonare L,Dusso A,et al. Differential effects of dabigatran and warfarin on bone volume and structure in rats with normal renal function[J]. PLoS One, 2015,10:e0133847. |
| (收稿日期:2015-11-26) |

