2. 215004 苏州, 苏州大学附属第二医院骨科
4. Department of Orthopedics, The Second Affiliated Hospital of Soochow University, Suzhou 215004, Jiangsu Province, China
本课题组前期的研究表明,绝经后女性体内存在铁蓄积,铁蓄积主要通过促进破骨细胞的骨吸收导致骨质疏松的发生,而降铁疗法可辅助治疗铁介导的绝经后骨质疏松症[1, 2, 3]。新型铁螯合剂地拉罗司(deferasirox,DFS)是具有降铁效率高、临床使用安全和患者依从性好的特点,适合开发为治疗绝经后骨质疏松新药物[4]。最近有研究证实,核转录因子κB(nuclear transcription factor kappa B,NF-κB)信号活性升高是破骨细胞骨吸收增强、骨质疏松发生的重要因素[5, 6]。
本实验以小鼠单核细胞RAW264.7为研究对象,使其在核因子κB活化因子配体(receptor activator of NF-κB ligand,RANKL)的作用下分化为破骨细胞,同时使用DFS进行干预,观察破骨细胞的分化状态以及相关基因转录因子c-Fos、活化T细胞核因子(nuclear factor of activated T cell c1,NFATc1)以及组织蛋白酶K(cathepsin K,CTK)表达的变化。为进一步揭示DFS的作用机制,本实验继续观察RAW264.7细胞NF-κB信号的活性水平以及NF-κB 信号关键分子P65蛋白的表达情况。本研究结合以上实验结果,探讨DFS对RAW264.7细胞向破骨细胞分化的影响及其作用机制,旨在为DFS对骨代谢作用的研究提供实验资料。
材料与方法 主要试剂和仪器小鼠单核细胞RAW264.7 (中国科学院上海细胞所细胞库);DMEM培养基和新生胎牛血清 (美国Gibco公司);RANKL (美国California Bioscience公司);地拉罗司(DFS,美国Selleck公司);Trizol(美国Invitrogen公司);细胞增生/毒性检测试剂盒(CCK-8,日本DojinDo公司);TRAP染色试剂盒(美国Sigma公司);细胞核蛋白与浆蛋白抽提试剂盒(碧云天公司);NF-κB P65抗体(美国Cell Signaling Technology公司);双荧光素酶报告基因检测系统(美国Promega公司);萤火虫荧光目的基因质粒pNF-κB-Luc(上海吉然公司);海肾荧光内参质粒PGL3-basic(上海碧云天公司);酶标仪(MuL TiSKAN MK3,美国Thermo公司);荧光定量PCR仪(美国Applied Biosystems 公司)。
细胞培养RAW264.7细胞常规培养于DMEM (高糖)培养基(含10%的胎牛血清、青霉素100 μg /mL和链霉素100 μg/mL),在5% CO2、37 ℃培养箱内。根据细胞的培养情况每1~2 d换液1次,细胞密度长至70%~80%时进行传代。
细胞活性测定RAW264.7细胞消化后以每孔5×103个细胞接种于96孔板,过夜贴壁后更换培养液并分别加入终浓度为0、5、10、20、40和80 μmol/L的DFS(0 μmol/L即不含DFS的等量培养基),细胞分为6组,每组3个复孔。干预24 h后每孔加入10 μL CCK-8试剂,混匀后37 ℃孵育2 h。随后在15 min内酶标仪读取待测样品和空白对照在450 nm处的A值。各待测样本的A值记为测量值,空白对照的A值记为空白值,终值=测量值-空白值。
TRAP染色与观察RAW264.7细胞消化后以每孔1×103个细胞接种于96孔板,过夜贴壁后更换培养液并加入终浓度为30 ng/mL的RANKL,同时分别加入终浓度为0、5、10和20 μmol/L的DFS(0 μmol/L即不含DFS的等量培养基为对照组)。细胞分为4组,每组3个复孔。药物作用5 d后使用TRAP染色试剂盒进行细胞染色。细胞用丙酮溶液固定30 s,在以萘酚AS-BI磷酸盐为底物的孵育液中37 ℃孵育1 h。碱性流水冲洗直至细胞核变为蓝色。倒置显微镜下观察每孔TRAP阳性细胞并进行计数(以染色后呈酒红色并至少含有3个细胞核的细胞为阳性细胞)。每孔TRAP阳性细胞计数重复3遍,取平均值。
实时定量PCR检测RAW264.7细胞消化后以2×104个细胞接种于12孔板。细胞贴壁后更换培养液并加入终浓度为30 ng/mL的RANKL,同时分别加入终浓度为0、5、10、20 μmol/L 的DFS(0 μmol/L即不含DFS的等量培养基为对照组),另设不加RANKL和DFS的空白组。细胞分为5组,每组3个复孔。药物作用24 h后使用Trizol试剂提取细胞总RNA后反转录成cDNA。PCR反应体系为20 μL,反应条件:95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,40个循环,反应完成后进行扩增曲线和溶解曲线分析。检测基因引物序列见表 1,以GAPDH为内参。使用2-△△CT法计算检测基因产物的相对值,并使用Step OneTM软件V 2.1进行分析。
| 基因 | 引物序列(5′→3′) | 产物大小(bp) |
| CKT:组织蛋白酶K;NFATc1:活化T细胞核因子 | ||
| CTK | F:GTCTTGTGTGTCAGTTTCGGC | 133 |
| R:CCTTGTCCTTGGTGTAGTGCTC | ||
| NFATc1 | F:GCTGTTCATTGGGACGGC | 166 |
| R:GATGGCTCGCATGTTATTTTCT | ||
| c-Fos | F:CGGGTTTCAACGCCGACTA | 185 |
| R:TGTCACCGTGGGGATAAAGTT | ||
| GAPDH | F:CCTGGAGAAACCTGCCAAGTA | 201 |
| R:TCATACCAGGAAATGAGCTTGAC | ||
RAW264.7细胞消化后以每孔2×104个细胞接种于24孔板,过夜贴壁后依照Lip 2000转染试剂操作指南转染萤火虫荧光目的基因质粒pNF-κB-Luc和海肾荧光内参质粒PGL3-basic。转染 6 h后加药干预,细胞分为4组:即空白组,加入终浓度为10 μmol/L的DFS组,加入终浓度为30 ng/mL的RANKL组和加入终浓度为30 ng/mL的RANKL+10 μmol/L的DFS组。转染48 h后按双荧光素酶报告基因检测试剂盒操作指南进行双荧光素酶报告基因检测,分别记录萤火虫荧光素酶和海肾荧光素酶的激发值,用二者的比值评价NF-κB报告基因的激发程度。
Western blotting法检测RAW264.7细胞消化后以每孔3×105个细胞接种于6孔板,过夜贴壁后细胞分为4组:即空白组,加入终浓度为10 μmol/L的DFS组,加入终浓度为30 ng/mL的RANKL组和加入终浓度为30 ng/mL的RANKL+10 μmol/L的DFS组。干预24 h后使用核浆蛋白抽提试剂盒分别提取细胞核蛋白和细胞质蛋白,检测并调整蛋白浓度,分别以PCNA和Tubulin做为细胞核和细胞质内参蛋白。配制SDS-PAGE胶块,将处理好的蛋白溶液上样,SDS-PAGE胶电泳后转移至PVDF膜,5%脱脂牛奶-TBST封闭液中室温封闭1 h,加入P65一抗(1∶1 000),4℃孵育过夜,TBST洗膜后使用抗兔二抗(1∶1 000)室温孵育1 h,TBST洗膜后显片。使用Image J 图像分析软件分析灰度值,用目的蛋白与相应内参蛋白的比值来评价P65蛋白的表达量。
统计学方法采用SPSS19.0统计软件进行分析,实验所得数据用均数±标准差(x±s)表示。采用单因素方差分析(One-way ANOVA)进行显著性检验,组间比较采用Student-Newman-Keuls(SNK)检验,以P<0.05表示差异有统计学意义。
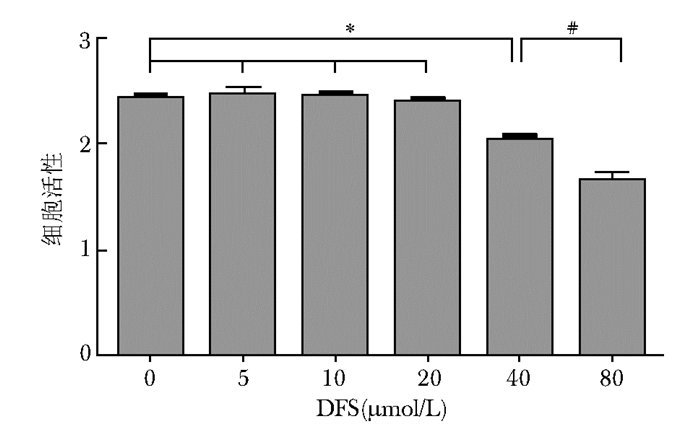
结 果 细胞活性检测结果CCK-8实验结果显示: (1)DFS浓度在0~20 μmol/L时,各浓度组间的A值无明显变化,组间比较差异无统计学意义(P>0.05);(2)DFS浓度在40 μmol/L时的A值与0 μmol/L相比明显下降,差异有统计学意义(P<0.05),80 μmol/L则下降的更为明显,与40 μmol/L相比,差异有统计学意义(P<0.05)(图 1)。
|
| 图 1 不同浓度DFS对RAW264.7细胞活性的影响 Fig 1 Effects of various concentrations of DFS on proliferation of RAW264.7 cells DFS:地拉罗司;40 μmol/L组与0 μmol/L组比较,*P<0.05;80 μmol/L组与40 μmol/L组比较,#P<0.05 |
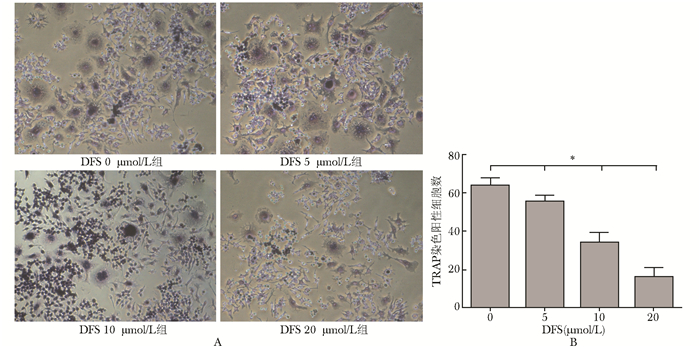
RAW264.7细胞在RANKL诱导5 d后即可出现典型的TRAP阳性细胞:细细胞形态不一,可为圆形、椭圆形、长条形、多角形、油煎蛋形和不规则型等,细胞周围常有伪足伸出,体积为单核细胞的数十倍,甚至上百倍,细胞质内抗酒石酸酸性磷酸酶部位可形成酒红色沉淀,细胞核数目≥3,核染色常为阴性。TRAP阳性细胞计数结果:0、5、10和20 μmol/L DFS组分别为:63.67±3.78、55.33±3.21、34.00±5.00、16.00±4.58,随着DFS浓度的增加TRAP阳性细胞的数目逐渐减少,各浓度组组间比较,差异有统计学意义(P<0.05)(图 2)。
|
| 图 2 DFS对RAW264.7细胞向破骨细胞分化的影响 Fig 2 Effects of various concentrations of DFS on diffrentiation of RAW264.7 cells into osteoclasts A:各浓度组RAW264.7细胞光镜下表现(TRAP染色,×20); B:各浓度组TRAP染色阳性细胞计数分析;DFS:地拉罗司; 各组组间比较,*P<0.05,n=3 |
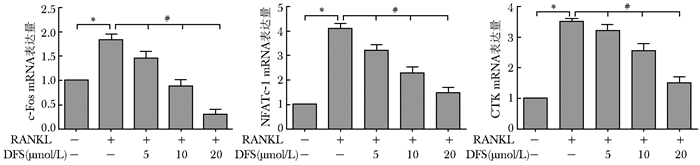
定量PCR结果显示,RANKL诱导RAW264.7细胞24 h后,c-Fos、NFATc-1和CTK mRNA的表达量为别为1.83±0.11、4.09±0.20、3.51±0.08,与空白组相比均明显升高,差异有统计学意义(P<0.05)。加入5、10和20 μmol/L 的DFS干预后,c-Fos mRNA的表达分别量为1.46±0.13、0.88±0.13、0.30±0.09,NFATc-1 mRNA的表达分别量为3.21±0.22、2.28±0.23、1.47±0.22,CTK mRNA的表达量分别为3.21±0.19、2.55±0.22、1.50±0.19。各检测基因的表达随着DFS干预浓度的增加呈浓度依赖性下降,各浓度组组间比较,差异有统计学意义(P<0.05)(图 3)。
|
| 图 3 DFS对RAW264.7细胞分化相关基因表达的影响 Fig 3 Effects of various concentrations of DFS on diffrentiation genes of RAW264.7 cells DFS:地拉罗司; RANKL:核因子κB活化因子配体; CKT:组织蛋白酶K;NFATc1:活化T细胞核因子;RANKL组与空白组比较,*P<0.05;DFS各浓度组组间比较,#P<0.05,n=3 |
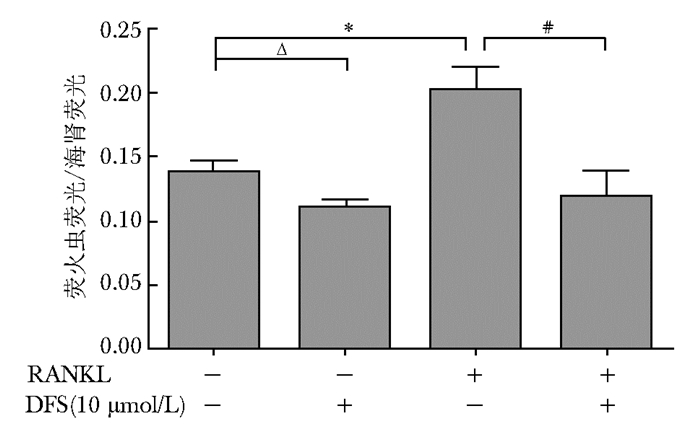
单纯使用DFS干预RAW264.7细胞48 h后,NF-κB报告基因的表达量为0.11±0.005,与空白组0.138±0.008比较明显降低,差异有统计学意义(P<0.05);RANKL诱导RAW264.7细胞48 h后,NF-κB基因的表达量为0.202±0.017,与空白组0.138±0.008比较明显升高,差异有统计学意义(P<0.05),提示RANKL可活化NF-κB信号的表达;在加入RANKL的同时上加入DFS,NF-κB报告基因的表达量为0.119±0.019,与RANKL组0.202±0.017比较明显下降,差异有统计学意义(P<0.05),提示DFS可显著降低 RANKL诱导的NF-κB报告基因表达的上升(图 4)。
|
| 图4 DFS对RAW264.7细胞NF-κB报告基因表达的影响 Figure 4 Effects of various concentrations of DFS on NF-κB Luciferase activity of RAW264.7 cells DFS:地拉罗司;NF-κB:核转录因子κB; RANKL:核因子κB活化因子配体; DFS组与空白组比较,ΔP<0.05;RANKL组与空白组比较,*P<0.05;DFS+RANKL组与RANKL组比较,#P<0.05,n=3 |
单纯使用DFS干预RAW264.7细胞24 h后,细胞质内NF-κB P65蛋白表达量为1.51±0.10,与空白组比较明显增加(P<0.05),同时细胞核内NF-κB P65蛋白表达量为0.32±0.05,与空白组比较明显减少(P<0.05),提示在DFS的作用下NF-κB P65向核内转移减少,NF-κB 活性被抑制;RANKL诱导RAW264.7细胞24 h后,细胞质内NF-κB P65蛋白表达量为0.42±0.09,与空白组比较明显减少(P<0.05),同时细胞核内NF-κB P65蛋白表达量为1.71±0.08,与空白组比较明显增加(P<0.05),提示NF-κB P65蛋白向核内转移增加,NF-κB 信号活性增强;在加入RANKL的同时加入DFS,细胞质内NF-κB P65蛋白表达量为0.56±0.08,与RANKL组0.42±0.09比较明显增加(P<0.05),细胞核内NF-κB P65蛋白表达量为1.49±0.12,与RANKL组1.71±0.08比较明显减少(P<0.05),提示在DFS的作用下,RANKL激活的 NF-κB P65的内移被阻止,NF-κB 增强的活性受到抑制(图 5)。
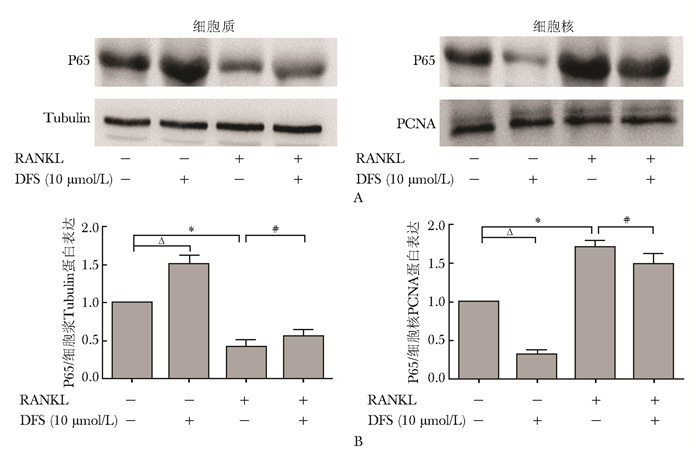
|
| 图 5 DFS对RAW264.7细胞NF-κB P65蛋白表达的影响 Fig 5 Effects of various concentrations of DFS on NF-κB P65 protein levels of RAW264.7 cells A:各组细胞质、细胞核NF-κB P65蛋白电泳图;B:各组细胞质、细胞核NF-κB P65蛋白表达量分析;DFS:地拉罗司;NF-κB:核转录因子κB;RANKL:核因子κB受体活化因子配体; DFS组与空白组比较,ΔP<0.05;RANKL组与空白组比较,*P<0.05;DFS+RANKL组与RANKL组比较,#P<0.05,n=3 |
DFS是一种可透膜的铁鳌合剂,可螯合细胞内的铁离子,因此,高浓度的DFS可能对细胞活性有明显的抑制作用。本实验首先测定了不同浓度的DFS对RAW264.7细胞活性的影响。CCK-8的结果提示,DFS浓度在达到40 μmol/L以上时即可明显抑制RAW264.7细胞的活性,所以,本研究选用0~20 nmol/L的DFS观察其对RAW264.7细胞向破骨细胞分化的影响。
小鼠单核细胞RAW264.7是一种破骨前体细胞,可在RANKL的诱导下分化为成熟的破骨细胞。当RANKL与破骨细胞表面受体RANK结合后,c-Fos调控的靶基因NFATc-1被激活,进一步启动一系列基因的转录,最终促进破骨前提细胞向成熟的破骨细胞分化。因此,c-Fos和NFATc-1是破骨细胞分化的关键转录因子[7, 8]。破骨细胞分化后会表达与骨基质降解功能相关的酶,其中CTK具有重要意义,对破骨细胞骨吸收发挥关键作用,是破骨细胞功能的标志性蛋白[9, 10]。完全分化成熟的破骨细胞具有体积较大、多核、TRAP染色阳性的特点。在本实验中,DFS干预RANKL诱导的RAW264.7细胞后,TRAP染色阳性的多核细胞数目减少,c-Fos、NFATc-1和CTK的基因表达下降,存在剂量依赖性。提示DFS可抑制RANKL诱导的RAW264.7细胞向破骨细胞分化。
NF-κB是存在于细胞质中的一种转录因子,是信号转导途径的重要枢纽。在静默条件下,NF-κB与其抑制性蛋白组成三聚体(P50-P65-IκB)而呈非活性状态,但当NF-κB受到启动因子刺激时,抑制蛋白IκB解离,NF-κB二聚体(P50-P65)从细胞质易位到细胞核,从而发挥转录调控的作用。近年来的研究提示,NF-κB信号在骨质疏松的发生过程中有重要的作用。有研究证实,NF-κB的活性升高可诱导破骨细胞分化基因表达、破骨细胞活性增加、骨吸收增加[11, 12],而NF-κB的抑制剂可抑制破骨细胞的形成和分化[13, 14]。因此,笔者考虑DFS抑制RAW264.7细胞向破骨细胞分化的作用机制可能与破骨细胞内NF-κB信号有关。为此,本研究使用双荧光素酶报告基因法检测RAW264.7细胞NF-κB的表达水平。结果发现,DFS可抑制基础和RANKL诱导的RAW264.7细胞NF-κB的表达。为进一步观察DFS作用下NF-κB生物学变化,本研究分别提取了细胞质蛋白和核蛋白,使用Western blotting法检测NF-κB的核心亚基P65蛋白的表达,结果发现,DFS可抑制基础和RANKL诱导的RAW264.7细胞NF-κB P65向细胞核转位。综合以上实验结果,可以认为,DFS可抑制RAW264.7细胞内NF-κB信号的活性。有关DFS对NF-κB信号的作用,近年来有其他研究者报道,2010年,Messa等[15]使用DFS干预白血病细胞K562,18 h后细胞内NF-κB的水平明显下降。本研究使用RAW264.7细胞得到的实验结果与其近似。此外,地拉罗司做为一种铁螯合剂,可使RAW264.7细胞内铁离子浓度降低,在低铁环境下RAW264.7细胞NF-κB信号活性降低,向破骨细胞分化过程受到抑制,本课题组以往的研究证实,在高铁负荷下RAW264.7细胞内活性氧水平增高,向破骨细胞分化作用增强[16],铁离子浓度的变化可显著影响对破骨细胞的分化。
综上,本研究发现,DFS可能通过抑制NF-κB信号活性抑制小鼠单核RAW264.7细胞向破骨细胞分化。本研究在细胞水平上支持DFS对骨质疏松的防治具有良好的作用,为DFS用于铁介导的骨质疏松辅助治疗研究提供了部分实验资料。
| [1] | 李光飞,徐又佳. 铁蓄积与绝经后骨质疏松症关系的研究进展 [J]. 中华骨科杂志,2015,35: 1017-1021. |
| [2] | Huang X,Xu Y,Partridge NC. Dancing with sex hormones,could iron contribute to the gender difference in osteoporosis ? [J]. Bone,2013,55: 458-460. |
| [3] | Li GF,Pan YZ,Sirois P,et al. Iron homeostasis in osteoporosis and its clinical implications [J]. Osteoporos Int,2012,23: 2403-2408. |
| [4] | 赵国阳,徐又佳. 铁螯合剂在骨质疏松防治中的应用前景 [J]. 中华骨质疏松和骨矿盐疾病杂志,2015,8: 164-167. |
| [5] | Yu B,Chang J,Liu Y,et al. Wnt 4 signaling prevents skeletal aging and inflammation by inhibiting nuclear factor-kappaB [J]. Nat Med,2014,20: 1009-1017. |
| [6] | Krum SA,Chang J,Miranda-Carboni G,et al. Novel functions for NF kappaB: inhibition of bone formation [J]. Nat Rev Rheumatol,2010,6: 607-611. |
| [7] | Bakiri L,Takada Y,Radolf M,et al. Role of heterodimerization of c-Fos and Fral proteins in osteoclast differentiation [J]. Bone,2007,40: 867-875. |
| [8] | Miyamoto T. Regulators of osteoclast differentiation and cell-cell fusion [J]. Keio J Med,2011,60: 101-105. |
| [9] | Suda T. Hematopoiesis and bone remodeling [J]. Blood,2011,117: 5556-5557. |
| [10] | Henriksen K,Bollerslev J,Everts V,et al. Osteoclast activity and subtypes as a function of physiology and pathology-implications for fixture treatments of osteoporosis [J]. Endocr Rev,2011,32: 31-63. |
| [11] | Boyce BF,Yao Z,Xing L. Functions of nuclear factor kappaB in bone [J]. Ann N Y Acad Sci,2010,1192: 367-375. |
| [12] | Abu-Amer Y. NF-kappaB signaling and bone resorption [J]. Osteoporos Int,2013,24: 2377-2386. |
| [13] | Yamaguchi M,Weitzmann MN. Vitamin K2 stimulates osteoblastogenesis and suppresses osteoclastogenesis by suppressing NF-kappaB activation [J]. Int J Mol Med,2011,27: 3-14. |
| [14] | Yamaguchi M,Vikulina T,Arbiser JL,et al. Suppression of NF-kappaB activation by gentian violet promotes osteoblastogenesis and suppresses osteoclastogenesis [J]. Curr Mol Med,2014,14: 783-792. |
| [15] | Messa E,Carturan S,Maffe C,et al. Deferasirox is a powerful NF-κB inhibitor in myelodysplastic cells and in leukemia cell lines acting independently from cell iron deprivation by chelation and reactive oxygen species scavenging [J]. Haematologica,2010,95: 1308-1316. |
| [16] | Jia P,Xu YJ,Zhang ZL,et al. Ferric ion could facilitate osteoclast differentiation and bone resorption through the production of reactive oxygen species [J]. J Orthop Res,2012,30: 1843-1852. |
| (收稿日期:2016-01-14) |

