2. 450052 郑州,郑州大学第一附属医院内分泌与代谢疾病科;
3. 200233 上海,上海交通大学附属第六人民医院病理科;
4. 200233 上海,上海交通大学附属第六人民医院骨科
2. Department of Endocrinology, The First Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, China;
3. Department of Pathology, Shanghai Jiaotong University Affiliated Sixth People's Hospital, Shanghai 200233, China;
4. Department of Orthopedics, Shanghai Jiaotong University Affiliated Sixth People's Hospital, Shanghai 200233, China
戈谢病(Gaucher disease,GD)是一种伴有骨损害的常染色体隐性遗传罕见病,其典型的骨损害为烧瓶样改变。本文报告1例以左侧股骨中段病理性骨折为首发表现的成人戈谢病。
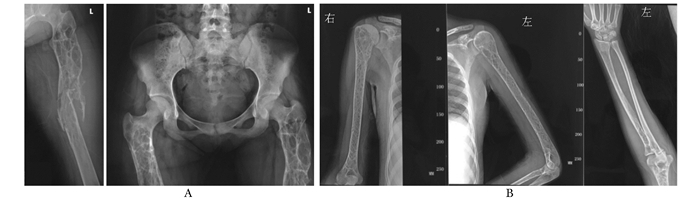
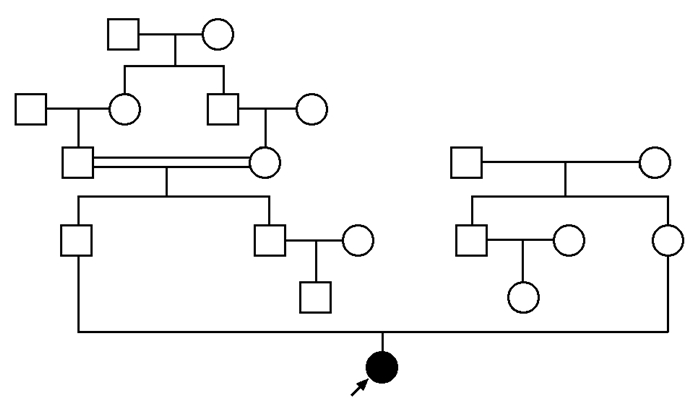
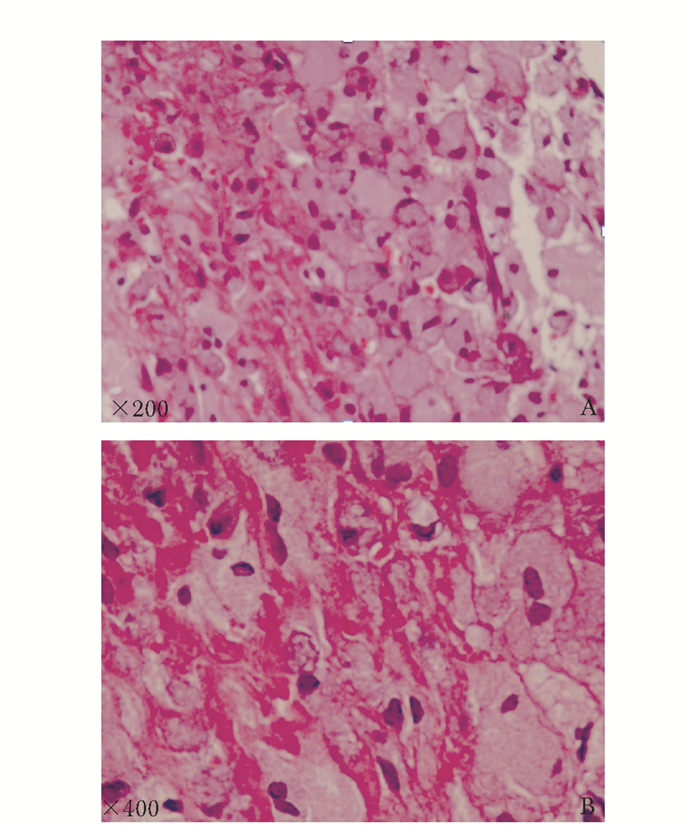
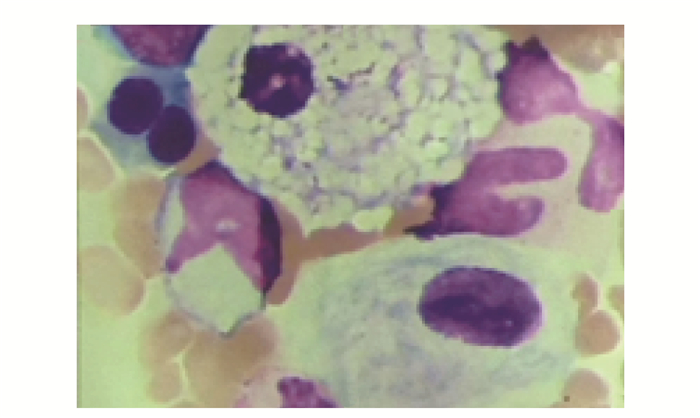
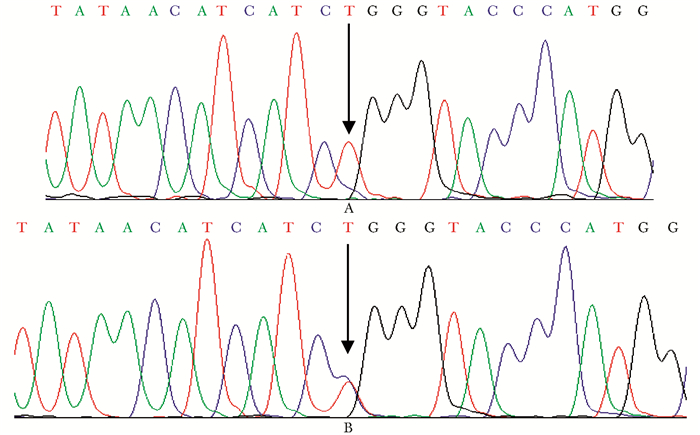
病例摘要患者女,22岁,江苏籍,在读研究生。因“平地滑倒后左大腿肿痛、活动受限7 d”于2015年12月26日于上海交通大学附属第六人民医院骨科就诊。患者7 d前提暖水壶滑倒后左大腿肿痛、活动受限,当地医院X线平片示左股骨中段骨折,多处骨骼呈膨胀性改变,伴骨溶解(图 1);予左下肢夹板固定后转至本院骨科。既往无乏力、骨痛,无头痛、视力下降,无鼻出血,无腹泻、便血、腹痛,无癫痫、抽搐。3年前体检发现轻度贫血,肝脾稍大;无不适,未就诊。患者足月顺产,生长发育同正常同龄人,未婚未育,13岁初潮,月经规律,经量正常。患者家系如图 2所示,父母非近亲婚配,父系有近亲婚配史。家族中无类似病史。既往无吸烟饮酒史,无外伤骨折史。入院体检:体温37.1 ℃,脉搏80次/min,呼吸21次/min,血压112/60 mmHg(1 mmHg=0.133 kPa),神清,精神可,面色苍白,身高162 cm;角膜无异常,无眼球震颤;上唇有一唇黑斑约0.3 cm;右滑车上淋巴结可触及,活动性可,无压痛粘连,质软;无肌阵挛,腱反射无异常,双上肢及右下肢肌力肌张力正常;病理征未引出,指鼻试验阴性;左下肢甲板固定。相关检查:白细胞4.7×109/L,红细胞3.16×1012/L,血红蛋白83 g/L,血小板135×109/L。空腹血糖7.65 mmol/L(3.90~5.80 mmol/L),总胆固醇3.02 mmol/L(0.45~1.81 mmol/L),谷丙转氨酶43 U/L(0~65 U/L),谷草转氨酶50 U/L(8~37 U/L),碱性磷酸酶225 U/L(15~112 U/L),谷氨酸转肽酶104 U/L(0~50 U/L),总胆红素22.8 μmol/L(0~18 μmol/L),直接胆红素10.9 μmol/L(0~6 μmol/L),总胆汁酸17 μmol/L(0~10 μmol/L),前白蛋白151 mg/L(200~ 400 mg/L),铁蛋白1 468.1 μg/L(10~291 μg/L),25-羟维生素D 9.61 μg/L。血钾、钠、氯、钙、镁、磷、甲状旁腺素、总蛋白、白蛋白、球蛋白、三酰甘油、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、尿素氮、肌酐、尿酸、血清铁、总铁结合力、凝血酶原时间、活化部分凝血活酶时间、纤维蛋白原均在正常范围内。腹部彩超及CT示脾大。胸片示双侧肱骨、锁骨、肩胛骨骨质密度异常,广泛网格样改变,局部骨皮质变薄伴膨胀性改变(图 1)。左股骨CT示左股骨形态异常,呈膨胀性改变,髓腔及周围见软组织肿块形成,并破坏、吸收周围骨质,致股骨多发骨折。股骨MRI示双侧股骨形态异常,呈轻度膨胀性改变,双侧股骨髓腔内信号异常,左侧股骨中段骨皮质不连续,断端错位,其内可见团片状异常信号灶,呈T1W低、T2W压脂高信号影,病灶信号不均匀,周围软组织明显肿胀。PET/CT(18F-FDG)示全身多发骨骼对称弥漫性葡萄糖代谢增高,下颌骨、双侧上下肢管状骨髓腔不均匀膨胀性改变,伴局部骨皮质不连续;肝、脾肿大,放射性均匀分布。入院后因“左股骨病理性骨折”行“左股骨肿瘤刮除植骨内固定”术。术后病理肿瘤组织免疫酶标记示PGM-1(+)、Kp-1(+)、CD163(+)、S-100(-)、CD5(-)、CD20(B细胞+)、CD4(-)、CD8(T细胞+)、SOX10(-)、Langerin(-)、CD1a (-)、CK(-)、EMA(-)、CD138(浆细胞+)、LCA(淋巴细胞+),特殊染色示AB/PAS(-/+)、网状染色(+)、Masson(+)(图 3)。骨髓细胞形态学示骨髓有核细胞增生明显活跃,粒红比倒置为0.62:1;粒细胞系统增生,占37.5%,各阶段细胞均见,形态大致正常;红细胞系统明显增生,占60.5%,以中晚幼红细胞为主,形态大致正常,成熟红细胞形态大小不一,嗜多色性红细胞可见;淋巴细胞系统占1.5%,形态大致正常;全片可见巨核细胞42个,以颗粒型巨核细胞为主,血小板成簇未见,散在可见;尾部可见较多戈谢细胞及少量尼曼-匹克细胞;戈谢细胞胞体较大,圆形、椭圆形,浆量较多,淡蓝色,含有许多波浪状条索纤维,核小1或2个,偶见多核;尼曼-匹克细胞形态大小不一,圆形,椭圆形,核较小,偏一侧,浆量较多,浆内充满泡沫状脂肪颗粒(图 4)。外周血白细胞葡萄糖脑苷脂酶活性1.12 nmol/ (h·mg)[正常参考范围6.56~55.10 nmol/ (h·mg)];酸性鞘磷脂酶61.47 nmol/h·mg[正常参考范围12.02~ 114.50 nmol/ (h·mg)]。签署知情同意书后,提取患者及双亲基因组DNA,对葡萄糖脑苷脂酶基因(Beta-glucocerebrosidase,GBA,MIM 606463)外显子编码区进行Sanger测序,结果显示:患者GBA基因5号外显子存在纯合突变(c.475C>T,NM_000157.3),致第159位氨基酸由精氨酸突变为色氨酸(R120W),父母亲为杂合子(图 5)。
|
| 图 1 X线平片检查结果 Figure 1 Results of X-ray films A.骨盆及左股骨:多处骨骼呈膨胀性改变,伴骨溶解;B.肱骨、锁骨、肩胛骨:骨质密度异常,广泛网格样改变,局部骨皮质变薄伴膨胀性改变 |
|
| 图 2 患者家系图 Figure 2 Family chart of the patient ↗为先证者(纯合子);=为近亲结婚 |
|
| 图 3 左股骨骨组织病理学 Figure 3 Histopathology of the left femur A:×200;B:×400 |
|
| 图 4 骨髓中戈谢细胞 Figure 4 Gaucher cells in bone marrow |
|
| 图 5 基因检测结果 Figure 5 Results of gene detection A:患者GBA基因突变,在外显子5上发生错义突变(纯合),c.475C>T (NM_000157.3,R120W);B:患者父母5号外显子发生错义突变(杂合) |
患者初诊表现为贫血、肝脾大,广泛显著骨侵犯伴股骨干病理性骨折等多系统病变,伴血糖、血脂等代谢指标异常,无神经系统症状,骨髓涂片尾部可见戈谢细胞及少量尼曼-匹克细胞。戈谢病(Gaucher disease,GD)和尼曼匹克病(Niemann-Pick disease,NPD)均属于鞘脂贮积病。患者骨骼受侵显著,支持戈谢病诊断;外周血酶学测定GBA活性不足正常活性的20%,鞘磷脂酶未见异常,进一步排除尼曼匹克病;基因分析发现GBA基因纯合突变,确诊GD。
GD是常见的溶酶体贮积症之一,为常染色体隐性遗传罕见病,发病率种族差异明显,德裔犹太人群发病率可高达1/855,非犹太人群发病率约1/10万[1],国内目前尚无统计数据。GD由于GBA基因突变,导致该酶的转运障碍及错折叠,使溶酶体内酶活性降低,残余酶活性多只为正常的5%~25%,造成底物葡萄糖脑苷脂在巨噬细胞溶酶体中贮积,形成典型的贮积细胞即“戈谢细胞”;主要累及肝、脾、血液、骨骼等系统,也可累及淋巴、肺脏、皮肤、眼睛、肾脏等[1-3]。按中枢神经系统有无受累等临床表现,分为非神经病变型(GDI)、急性神经病变型(GDII)、慢性或亚急性神经病变型(GDIII)以及其他少见亚型(围产期致死型、心血管型等)。GDI最常见,约占94%,无原发性中枢神经受累表现,临床异质性显著;GDII常在新生儿或婴儿期发病,有迅速进展的急性神经系统损伤,幼儿期死亡;GDIII早期表现与GDI类似,中枢神经系统受累常于青春期前后出现[4-6]。本例患者22岁初诊,无神经系统受累表现,考虑GD Ⅰ型(MIM 230800)。
GBA基因位于染色体1q21,共编码11个外显子。目前文献报道的突变已超过400种,突变类型及比例存在种族差异,少数基因型与临床表型存在一定相关性[2]。德裔犹太患者中,c.1448T>C(L444P)、c.1226A>G(N370S)、c.84dupG(84GG)和c.115+1G>A(IVS2+1G>A)4种等位基因突变可占到95%左右;非犹太群体中突变更具多样性,L444P和N370S最为常见,占约70%[1, 3]。L444P纯合突变大多表现为亚急性神经病变型,初诊年龄中位数2.3岁,75%为GDIII;N370S杂合或纯合突变更多提示GDI,初诊年龄往往在10岁以后,患者不会出现非帕金森样的神经症状[1]。我国基因突变亚型及临床表型与欧美不同。与欧美相比,中国人群戈谢病发病年龄偏早,GDII与GDIII比例相对较高,血液系统受累程度更严重,神经骨骼系统受累更广泛[7]。目前国人已报道突变约40种,L444P为最常见,在有或无神经系统症状的各型患者中均可出现,N370S,84GG和IVS2+1G>A等欧美常见突变在国人少有报道;除L444P外,国人常见突变有F213I、N188S、V375L和M416V[2, 8]。在中国台湾地区,L444P纯合子、R120W/RecNciI和R120W是GDI的常见亚型;与欧美报道病例不同,中国台湾地区L444P纯合突变患者常没有神经病变表现[9]。
本例患者为R120W突变,该突变在世界范围内不属于常见突变类型,但近年来报道比例有所上升[10]。1996年Choy等[11]首先在1例希腊患者中报道此突变。1997年施惠平等[12]报道了国人首例R120W复合杂合突变的GDI患者,初诊年龄为3岁,血液、内脏及骨骼均有受累。R120W是中国台湾地区GDI常见突变类型之一[9]。通过中国知网和万方数据库只检索到2例R120W突变报道,GDI和GDII各1例,均为儿童[12-13]。R120W突变与临床症状的相关性可能存在种族差异,欧美患病人群显示R120W突变者临床症状偏重,而中国台湾地区报道与此相反[8-9]。近年来研究发现该突变可增加罹患帕金森病的风险[14]。
GDI临床异质性明显,各年龄段均可发病,发病年龄越早,病情进展可能越快。临床损害主要体现在三方面:血液系统异常如贫血、血小板减少或凝血功能异常,内脏受累如肝脾肿大及其相关并发症,骨骼受侵[2, 15]。不同系统受累的程度可以不一致,骨损害可以在没有严重的血液或内脏系统受累时出现[16]。本例患者存在贫血、肝脾大,无不适主诉,与全身广泛严重的骨侵犯不一致。骨骼损害是GD尤其Ⅰ型的重要表现[15]。GDI青少年或成年早期发病的患者可较早出现血液或内脏受累,另一方面患者血液系统恶性肿瘤如多发性骨髓瘤、B细胞非霍奇金淋巴瘤发病风险增加,因此既往曾被认为是血液系统疾病[16-17]。随着该病的深入研究,发现骨损害在GDI中发生率最高,是GDI致残致死的主要因素。影像学提示94%未治疗的患者存在骨受累,75%有骨损害症状[1, 3, 17]。GDI骨受累程度不一,可表现为烧瓶样改变、局部骨溶解、局部骨硬化、骨量减少、骨质疏松、病理性骨折、关节损害或感染,罕见情况可发生急性骨髓炎;骨损害常导致慢性疼痛、残疾、畸形,严重影响生活质量,其中缺血性骨坏死、骨量减少及骨折危害最大[1, 6]。本例患者无典型烧瓶样改变等表现,而以全身骨骼广泛的网格样改变为主要特征。文献数据显示初诊GDI者骨痛发生率是49%~82%,既往有脾切除的患者更常见;骨坏死约30%;局部或全身骨密度(bone mineral density,BMD)下降分别是49%和36%;关于骨折的报道较少,国际戈谢病协作组对706例GD患者进行影像学评估发现108例存在骨折(15%)[3, 17-18]。骨坏死常多发,皮质骨或松质骨均可累及,当累及范围足够广泛时,可发生骨危象,表现为重度疼痛、高热、寒战、活动受限、WBC升高、ESR增快等[17];脾切除可增加骨危象的发生率,在未治疗患者中,无脾切除病史的患者骨危象发病率是22%,有脾切除病史的发生率是55%[18]。GDI患者腰椎、股骨颈或桡骨远端等处BMD均低于同龄同性别对照人群,往往达不到理想峰值骨量;既往脾切除术、N370S/84GG等是低骨量的危险因素[19-20]。GDI患者的骨折可发生在股骨颈、脊柱、胫骨平台等全身各处,常在成年后发生,年龄多在29~57岁,骨折后愈合慢,部分患者骨愈合时间可延长至2年,严重影响患者生活质量与预期寿命[6, 17, 21]。BMD尤其椎体BMD与骨骼受累影像学严重程度相关,低BMD(腰椎Z值<-1.0)是GDI患者骨折的高危因素;当腰椎BMD Z值小于-1.0时,应积极干预,提高BMD[6]。
酶替代治疗(enzyme replacement therapy,ERT)和底物减少治疗(substrate reduction transplantation,SRT)是GDI的主要治疗措施。ERT可明显改善GD的预后,早期治疗可使非神经系统症状明显缓解。ERT治疗1年内可使血液或内脏系统受累明显缓解;骨坏死、骨危象发生减少;在没有进行脾切除的患者中,骨痛发生率减少约40%[18, 20-21]。不同于血液或内脏系统的快速缓解,ERT对骨骼的改善较缓慢[18, 20]。ERT治疗1年内骨髓内脂肪沉积(戈谢细胞浸润)可有好转,4~5年可正常,对BMD的有效提高需要更长时间[18]。ERT对BMD的提高存在差异,不同年龄段疗效不一致,部分患者在起始治疗6个月内可出现BMD的一过性下降[20, 22]。Eliglustat是一种新型口服SRT药物,文献报道该药物治疗1年或2年可显著提高腰椎BMD,对伴有骨量减少或骨质疏松患者疗效更显著[23-24]。传统抗骨质疏松药物双膦酸盐虽是临床上常见的GDI处方药,但目前国际上关于该药提高GDI患者BMD的有效性尚有争议[6, 20];另外,GDI患者骨损害机制不明,骨转换指标存在异质性,影响了双膦酸盐在应用中的安全性评估[1]。Khan等[25]报道了1例并发类风湿关节炎、干燥综合征的GDI,应用特立帕肽后BMD增加,骨折发生次数下降。目前关于ERT、SRT或抗骨质疏松药物对骨折或再发骨折的预防未见明确报道。
已报道的GDI骨折患者多在早期因严重的血液或内脏受累被确诊或行脾切除术,而本患者突出表现为骨骼广泛受侵,初诊前无任何不适主诉。尽管戈谢病属于罕见病,仍需引起足够的重视,充分认识和理解戈谢病的骨骼系统表现,及早诊治十分重要。如何更有效的提高以骨病为突出表现GDI患者的生存时间和生活质量值得进一步研究。另外,鉴于我国GD基因突变、临床表型与欧美不同,建立和完善我国的GD数据库十分必要。
| [1] | Guggenbuhl P, Grosbois B, Chalès G. Gaucher disease[J]. Joint Bone Spine, 2008, 75: 116–124. DOI:10.1016/j.jbspin.2007.06.006 |
| [2] | 中华医学会儿科学分会遗传代谢内分泌学组, 中华医学会儿科学分会血液学组, 中华医学会血液学分会红细胞疾病(贫血)学组. 中国戈谢病专家共识(2015)[J]. 中华儿科杂志, 2015, 53: 256–261. DOI:10.3760/cma.j.issn.0578-1310.2015.04.006 |
| [3] | Charrow J, Andersson HC, Kaplan P, et al. The Gaucher registry:demographics and disease characteristics of 1698 patients with Gaucher disease[J]. Arch Intern Med, 2000, 160: 2835–2843. DOI:10.1001/archinte.160.18.2835 |
| [4] | Mistry PK, Cappellini MD, Lukina E, et al. A reappraisal of Gaucher disease-diagnosis and disease management algorithms[J]. Am J Hematol, 2011, 86: 110–115. DOI:10.1002/ajh.v86.1 |
| [5] | Balwani M, Grace ME, Desnick RJ. Gaucher disease:when molecular testing and clinical presenta-tion disagree-the novel c.1226A>G(p.N370S)-RecNcil allele[J]. J Inherit Metab Dis, 2011, 34: 789–793. DOI:10.1007/s10545-011-9307-7 |
| [6] | Khan A, Hangartner T, Weinreb NJ, et al. Risk factors for fractures and avascular osteonecrosis in type 1 Gaucher disease:a study from the International Collaborative Gaucher Group (ICGG) Gaucher Registry[J]. J Bone Miner Res, 2012, 27: 1839–1948. DOI:10.1002/jbmr.1680 |
| [7] | Choy FY, Zhang W, Shi HP, et al. Gaucher disease among Chinese patients:review on genotype/phenotype correlation from 29 patients and identification of novel and rare alleles[J]. Blood Cells Mol Dis, 2007, 38: 287–293. DOI:10.1016/j.bcmd.2006.11.003 |
| [8] | Hruska KS, LaMarca ME, Scott CR, et al. Gaucher disease:mutation and polymorphism spectrum in the glucocerebrosidase gene (GBA)[J]. Hum Mutat, 2008, 29: 567–583. DOI:10.1002/humu.20676 |
| [9] | Wan L, Hsu CM, Tsai CH, et al. Mutation analysis of Gaucher disease patients in Taiwan:high prevalence of the RecNciI and L444P mutations[J]. Blood Cells Mol Dis, 2006, 36: 422–425. DOI:10.1016/j.bcmd.2006.02.001 |
| [10] | Beutler E, Gelbart T, Balicki D, et al. Gaucher dis-ease:four families with previously undescribed muta-tions[J]. Proc Assoc Am Physicians, 1996, 108: 179–184. |
| [11] | Choy FY, Humphries ML, Shi H. Identification of two novel and four uncommon missense mutations among chinese Gaucher disease patients[J]. Am J Med Genet, 1997, 71: 172–178. DOI:10.1002/(ISSN)1096-8628 |
| [12] | 施惠平, 张为民, 臧晏, 等. 中国10例戈谢病[J]. 中华儿科杂志, 2001, 39: 131–133. DOI:10.3760/j.issn:0578-1310.2001.03.002 |
| [13] | 王美娟, 钟雪梅, 马昕, 等. 戈谢病Ⅱ型患儿1例报告[J]. 临床儿科杂志, 2014, 32: 287–288. DOI:10.3969/j.issn.1000-3606.2014.03.024 |
| [14] | Mitsui J, Mizuta I, Toyoda A, et al. Mutations for Gaucher disease confer high susceptibility to Parkinson disease[J]. Arch Neurol, 2009, 66: 571–576. |
| [15] | Mehta A. Epidemiology and natural history of Gaucher's disease[J]. Eur J Intern Med, 2006, 17: S2–S5. DOI:10.1016/j.ejim.2006.07.005 |
| [16] | Baris HN, Cohen IJ, Mistry PK. Gaucher disease:the metabolic defect, pathophysiology, phenotypes and natural history[J]. Pediatr Endocrinol Rev, 2014, 12: 72–81. |
| [17] | Linari S, Castaman G. Clinical manifestations and management of Gaucher disease[J]. Clin Cases Miner Bone Metab, 2015, 12: 157–164. |
| [18] | Charrow J, Scott CR. Long-term treatment outcomes in Gaucher disease[J]. Am J Hematol, 2015, 90: S19–S24. DOI:10.1002/ajh.v90.S1 |
| [19] | Pastores GM, Wallenstein S, Desnick RJ, et al. Bone density in Type 1 Gaucher disease[J]. J Bone Miner Res, 1996, 11: 1801–1807. |
| [20] | Marcucci G, Zimran A, Bembi B, et al. Gaucher disease and bone manifestations[J]. Calcif Tissue Int, 2014, 95: 477–494. DOI:10.1007/s00223-014-9923-y |
| [21] | Lutsky KF, Tejwani NC. Orthopaedic manifestations of Gaucher disease[J]. Bull NYU Hosp Jt Dis, 2007, 65: 37–42. |
| [22] | Lebel E, Dweck A, Foldes AJ, et al. Bone density changes with enzyme therapy for Gaucher disease[J]. J Bone Miner Metab, 2004, 22: 597–601. DOI:10.1007/s00774-004-0529-8 |
| [23] | Lukina E, Watman N, Arreguin EA, et al. A phase 2 study of eliglustat tartrate (Genz-112638), an oral substrate reduction therapy for Gaucher disease type 1[J]. Blood, 2010, 116: 893–899. DOI:10.1182/blood-2010-03-273151 |
| [24] | Lukina E, Watman N, Arreguin EA, et al. Improvement in hematological, visceral, and skeletal manifestations of Gaucher disease type 1 with oral eliglustat tartrate (Genz-112638) treatment:2-year results of a phase 2 study[J]. Blood, 2010, 116: 4095–4098. DOI:10.1182/blood-2010-06-293902 |
| [25] | Khan A, Hanley DA, McNeil C, et al. Improvement in bone mineral density and architecture in a patient with gaucher disease using teriparatide[J]. JIMD Rep, 2015, 22: 23–28. DOI:10.1007/978-3-662-47453-2 |
| (收稿日期:2017-08-17) |

