肾性骨病是慢性肾脏病的常见并发症,可表现为高骨转换型、低骨转换型骨病、骨软化症和混合性骨病等多种病变类型,将显著增加骨折风险。此外,该病也是严重影响患者生活质量和生存率的重要原因,早期诊断和治疗有其重要意义。本文报道1例慢性肾脏病并发骨痛、活动障碍和骨折长期不愈合的疑难病例,以探讨肾性骨病的诊断思路,提醒临床医生重视对该病的诊断及治疗。
病例摘要患者,男,63岁,主诉:左踝部骨折伴骨痛3年,乏力、活动困难2年余。患者2012年8月下楼梯摔倒后出现左踝部、双肋部疼痛,外院X线片示“左胫骨下端骨折”,予石膏外固定3个月、未好转。期间患者多次检查示,血钙2.09~2.27 mmol/L、血磷1.16~1.30 mmol/L、血肌酐215~238 μmol/L,曾行动脉血气示酸中毒(具体值不详),未予治疗。2013年患者出现全身乏力,进行性加重,逐渐出现活动困难,不能站立和行走。2015年7月外院检查血钙1.9 mmol/L、血磷1.11 mmol/L、碱性磷酸酶849 U/L、血肌酐277 μmol/L,甲状旁腺素289.6 pg/mL (参考范围6~80 pg/mL),自行服用钙剂1个月(剂量不详),上述症状无缓解。自发病以来,日晒和户外活动少,无手足麻木、抽搐;无性功能下降;偶有口干、多饮,夜尿2~3次,无排尿困难,无肉眼血尿、尿中排石;否认皮肤瘙痒、瘀斑;精神、食欲可,无恶心、呕吐;近3年体重下降8 kg,身高无明显变化。
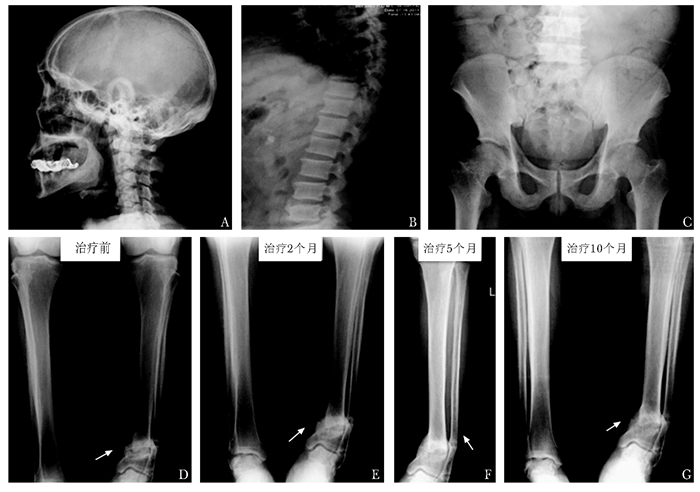
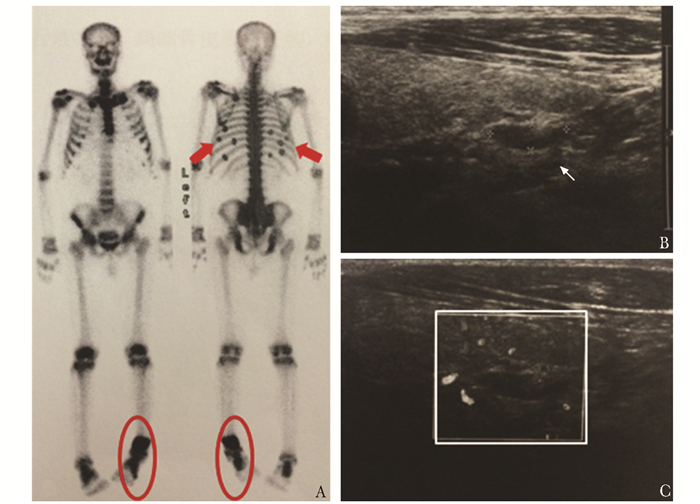
既往史:糖尿病18年,现皮下注射门冬胰岛素30早餐前12 U+晚餐前14 U;高血压5年,现口服降压零号,血糖、血压控制情况不详;否认长期服用糖皮质激素史,否认毒物、射线接触史,无烟酒嗜好。个人史、家族史无特殊。体格检查:血压(blood pressure,BP) 110/80 mmHg (1 mmHg=0.133 kPa),心率(heart rate,HR) 78次/min,轮椅入室,中等体型,贫血貌,无颜面浮肿,甲状腺未及肿大,胸廓、脊柱、骨盆压痛(-),肾区叩痛(-),左足内翻畸形,双下肢无水肿。辅助检查:正细胞正色素性贫血;血肌酐(creatinine,Cr)203 μmol/L、尿素氮(urea nitrogen,Urea)7.21 mmol/L,肾小球滤过率(glomerular filtration rate,GFR)29.2 mL/min;丙氨酸转氨酶(alanine aminotransferase,ALT)34 U/L,白蛋白(albumin,Alb)38 g/L,血钾(serum potassium,K)4.7 mmol/L,血钠(serum sodium,Na)141 mmol/L;血钙(serum calcium,Ca)2.09 mmol/L,血磷(serum phosphate,P)0.94 mmol/L,碱性磷酸酶(alkaline phosphatase,ALP)784 U/L;25羟维生素D (25 hydroxyvitamin D,25OHD)11.75 nmol/L (4.7 ng/mL);β胶原降解产物(β-cross linked C-telopeptide of type Ⅰ collagen,β-CTX)3.85 ng/mL;甲状旁腺素(parathyroid hormone,PTH)237.0 ng/L;24 h尿钙(urinary calcium,24 hUCa)0.51 mmol/24 h;游离钙1.02 mmol/L。血气分析:pH值7.319,碳酸氢根浓度(HCO3-)16.2 mmol/L,实际碱剩余(ABE)-8.5 mmol/L。促黄体生成素(luteinizing hormone,LH)4.12 U/L,促卵泡激素(follicle-stimulating hormone,FSH)7.74 U/L,雌二醇(estradiol,E2)106 pmol/L (29 pg/mL),睾酮(testosterone,T)0.103 nmol/L (2.98 ng/mL)。血清免疫固定电泳、前列腺特异性抗原正常,生化检查见表 1。骨骼X线平片:头颅、胸腰椎和骨骨盆骨质疏松,骨小梁模糊;左胫腓骨远端骨折(图 1A~D)。骨密度(dual-energy X-ray absorptiometry,DXA):股骨颈0.949 g/cm2(T值-0.2),全髋0.991 g/cm2(T值0),腰椎2-4 1.571 g/cm2(T值+3.7)。骨显像:全身骨骼异常所见,骨软化可能;左踝和双肋骨放射性摄取增高,考虑骨折及假骨折(图 2A)。超声示甲状腺右叶下级背侧低回声,1.2 cm×0.4 cm,甲状旁腺来源可能(图 2B、C);双肾皮质回声增强,前列腺增大伴钙化。奥曲肽显像:未见异常高摄取病灶。
| 指标 | 结果 | 参考范围 |
| Ca (mmol/L) | 2.09 | 2.13~2.70 |
| Alb (g/L) | 38 | 35~52 |
| P (mmol/L) | 0.94 | 0.81~1.45 |
| ALP (U/L) | 784 | 50~135 |
| Cr (μmol/L) | 203 | 45~84 |
| Urea (mmol/L) | 7.21 | 2.78~7.14 |
| CCr (ml/min) | 29.2 | 80~120 |
| ALT (U/L) | 34 | 9~50 |
| 24hUCa (mmol/24 h) | 0.51 | 2.50~8.75 |
| 24hUP (mmol/24 h) | 12.10 | 22.58~45.16 |
| 25OHD (nmol/L) | 11.75 | 50~250 |
| β-CTX (ng/mL) | 3.850 | 0.26~0.512 |
| PTH (ng/L) | 237.0 | 12.0~65.0 |
| 血气pH/HCO3- (mmol/L) | 7.319/16.2 | 7.35~7.4522.0~27.0 |
| RBC (×1012/L) | 3.30 | 3.50~5.00 |
| Hb (g/L) | 108 | 110~150 |
| LH (U/L) | 4.12 | 1.24~8.62 |
| FSH (U/L) | 7.74 | 1.27~19.26 |
| T (ng/mL) | 0.103 | 1.75~7.81 |
| E2(pmol/L) | 106 | < 172 |
| Ca:血钙;Alb:白蛋白;P:血磷;ALP:碱性磷酸酶;Cr:血肌酐;Urea:尿素氮;CCr:肌酐清除率;ALT:丙氨酸转氨酶;24hUCa:24小时尿钙;24hUP:24小时尿磷;25OHD:25羟维生素D;β-CTX:β胶原降解产物;PTH:甲状旁腺素;HCO3-:碳酸氢根浓度;RBC:红细胞;Hb:血红蛋白;LH:促黄体生成素;FSH:促卵泡激素;T:睾酮;E2:雌二醇 | ||
|
| 图 1 患者治疗前和治疗后2、5和10个月骨骼X线平片检查 Figure 1 Radiological findings in this patient before and after 2, 5, and 10 months of treatment A~C:治疗前头颅、胸腰椎和骨盆骨质疏松,骨小梁模糊,未见假骨折线;D:治疗前左胫腓骨骨质疏松,远端骨折线较宽、少量骨痂生长;E~G:治疗后2、5、10个月,远端骨折线变窄、周边骨痂形成,骨折愈合过程(箭头示下肢骨折) |
|
| 图 2 骨显像和甲状旁腺超声检查 Figure 2 Whole body bone scan and parathyroid ultrasonography A:骨显像,红色箭头示双肋骨多点状放射性摄取增高灶,红色圆圈示左踝关节放射性浓聚区;B~C:甲状旁腺超声,箭头和方框示甲状腺右叶下极背侧低回声,内部短条状血流 |
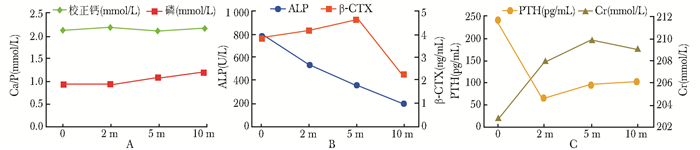
诊治经过:给予元素钙(碳酸钙)0.4 g/次、3次/d,骨化三醇0.25 μg/次、3次/d和碳酸氢钠片1.0 g/次、3次/d治疗;控制糖尿病及高血压;肾内科就诊,评估和治疗慢性肾脏疾病。治疗2个月后患者骨痛减轻,5个月后骨痛消失,活动能力逐渐提高,现治疗10个月,X线片提示左胫腓骨远端骨折基本愈合(图 1E~G),患者可自行站立及缓慢行走。近10个月,患者血Ca、P、24hUCa均在正常范围,PTH逐渐降至正常,骨转换生化指标ALP和β-CTX较前明显下降,代谢性酸中毒纠正(图 3A~C);患者未再新发骨折。
|
| 图 3 患者治疗前后骨代谢生化指标、血肌酐变化 Figure 3 Changes of bone metabolic biochemical markers and serum creatinine pre-treatment and post-treatment A:血钙磷水平恢复正常;B:骨转换生化标志物ALP和β-CTX水平显著下降;C:PTH水平逐渐降至正常,血肌酐水平稳定; ALP:碱性磷酸酶;β-CTX:β胶原降解产物;PTH:甲状旁腺素;Cr:血肌酐 |
本患者为老年男性,慢性病程;临床表现为轻微外力下骨折、长期不愈合,伴骨痛、乏力和活动受限;X线检查示骨质疏松、骨小梁模糊和左胫腓骨远端骨折;骨显像示全身骨骼异常,骨软化可能,左踝和双肋骨放射性摄取增高,考虑骨折及假骨折;实验室检查示低钙、低磷、高ALP水平,多次血肌酐升高、维生素D缺乏、高PTH血症、代谢性酸中毒和贫血。经钙剂、大剂量活性维生素D治疗和纠正代谢性酸中毒后,除血肌酐外的上述生化指标逐渐恢复正常,患者骨痛减轻,最终骨折愈合。
本患者病情复杂,以骨痛和骨折长期不愈合为主要特点,生化检查提示低钙、低磷、高ALP,结合骨影像学改变,提示骨软化症较为明确。骨软化症是新合成的骨基质矿化障碍导致的代谢性骨病。骨骼正常矿化的必要条件包括成骨细胞及骨细胞活性正常、骨基质成分和合成速率正常、充足的细胞外液钙磷、矿化部位合适的酸碱度、维生素D充足及无过多矿化抑制剂[1]。临床上,骨软化症的原因需考虑有无维生素D合成、代谢及作用障碍,有无骨矿化障碍因素以及各种磷代谢异常因素[2]。本患者中老年起病,多种遗传相关的低磷软骨病及假性维生素D依赖性佝偻病,证据不足;奥曲肽显像未发现放射线异常浓聚病灶,提示肿瘤诱发的低磷软骨病证据不足;经系列病因筛查,提示患者存在慢性肾脏疾病(chronic kidney disease,CKD),肌酐清除率明显降低,仅29.2 mL/min,达到CKD 4期,患者存在重度维生素D缺乏、失代偿性代谢性酸中毒、低钙和低磷血症、明显继发性甲状旁腺功能亢进,上述代谢紊乱导致患者肾性骨病、骨折及骨折不愈合;患者活动减少,可能同时存在废用性骨质疏松,进一步加重骨骼病变。
肾性骨病是慢性肾病患者的常见并发症,不仅显著增加骨痛、骨折风险,而且明显影响患者生活质量。20世纪初,内分泌学家刘士豪教授将慢性肾脏疾病引发的骨骼病变统一命名为肾性骨营养不良(renal osteodystrophy,ROD)[3]。近年来,改善全球肾脏病预后组织(Kidney Disease Improving Global Outcomes,KDIGO)将其更名为慢性肾脏病-矿物质和骨异常(chronic kidney disease-mineral and bone disorder,CKD-MBD),是指慢性肾脏疾病所引发的Ca、P、PTH和维生素D代谢异常,骨转换、骨矿化、骨量和骨强度异常,以及骨外钙化[4]。其中骨矿物质代谢异常可以在CKD 2期即出现,继发性甲状旁腺功能亢进是其特征性生化异常,导致PTH升高的原因除高磷、低钙血症、维生素D缺乏、1,25(OH)2D合成减少外,近期研究发现成纤维细胞生长因子23(fibroblast growth factor 23,FGF23)、骨硬化素增加以及维生素D受体、钙敏感受体、FGF受体和Klotho蛋白表达减少亦参与其中[5-6]。上述代谢异常共同导致骨量丢失、骨骼矿化异常,引起肾性骨病。
肾性骨病的表现类型多样,骨活检提示肾性骨病可以有4种类型,即纤维囊性骨炎(高骨转换型)、低骨转换型骨病、骨软化症及混合性骨病(兼有高转换和矿化异常)[7]。上述骨骼病变均与高骨折风险密切相关,明确骨病类型、积极治疗肾性骨病,对于提高CKD患者生活质量及降低死亡率具有重要意义。研究表明,CKD 3~5患者的骨折发生率较同龄人升高2~14倍,且随着肾病进展而增加,并明显影响患者病死率和生活质量[7-8]。一项研究分析630例CKD 5期患者的骨标本,发现高骨转换与皮质骨穿孔性增加有关,低骨转换与松质骨量下降和骨皮质变薄有关,上述异常均导致骨强度下降、骨折风险增加[9]。由于骨活检是有创性检查,限制了其临床应用。近年研究表明,影像学和生化指标检查也有助于评估肾性骨病。如双能X线吸收仪和高分辨外周定量CT检测的骨密度和骨微结构参数,可预测CKD患者的骨折风险[10-12]。一项前瞻性研究,使用DXA测定131例CKD 3~5期患者的髋部骨密度,结果发现骨折患者BMD更低、骨丢失速率更快,骨折患者基线髋部骨密度平均为0.77 g/cm2、每年丢失约2.6%,骨丢失率显著高于非骨折患者(1.2%/年)[10]。骨生化指标水平可以判断骨转换状态,也有助于评估肾性骨病的严重程度[7, 13]。本例患者虽未行骨活检,但骨骼X线所示患者存在典型骨质疏松和骨软化征象;DXA示腰椎骨密度增高,考虑肾性骨病可伴有骨质疏松、骨质软化和骨质硬化等多种表现,故单纯骨密度检查不能完全反映肾性骨病严重受损的骨质量[14]。此外,患者PTH水平较正常升高3倍,骨形成指标ALP和骨吸收指标β-CTX较正常升高6~7倍,提示患者存在以骨软化为主,高转换型骨质疏松、继发甲状旁腺功能亢进为特点的肾性骨病,应予以积极治疗。
本例患者的另一重要特征为骨折长期不愈合。研究显示长骨骨折不愈合发生率可达5%~10%[15],影响骨折愈合的因素较多,如高龄、吸烟、糖尿病、肥胖、长期应用糖皮质激素等[16-17],然而,对肾性骨病骨折愈合的相关研究较少。本例患者除糖尿病外,推测影响骨折愈合的重要因素还包括:(1)重度维生素D缺乏:维生素D可促进胶原合成、骨骼矿化[18],维生素D缺乏可影响骨折后骨痂的形成[19];研究发现骨折后骨痂形成较多人群,维生素D的无活性代谢产物24R,25(OH)2D显著升高[20],提示维生素D代谢与骨折愈合密切相关。本例患者25OHD水平仅为11.75 nmol/L (4.7 ng/mL),且肾功能明显受损,可能存在活性维生素D生成不足,这均与骨折不愈合密切关联。(2)并发骨质疏松:骨质疏松可引起间充质干细胞分化障碍、软骨细胞和成骨细胞活性降低及血管再生受阻,影响骨折后骨基质和生长因子的产生[21]。(3)代谢性酸中毒:长期酸中毒引起骨量丢失,骨基质矿化障碍,从而阻碍骨折愈合[22]。
肾性骨病的治疗目标是维持正常血钙磷水平、控制继发性甲状旁腺功能亢进和改善骨质疏松。具体措施包括:控制高磷血症、纠正低钙血症;应用活性维生素D增加钙磷吸收、抑制PTH分泌和促进骨矿化[4, 7],也有研究表明钙敏感受体调节剂(西那卡塞)可抑制PTH释放、减少骨折风险[23]。本例患者多次查血钙磷偏低、PTH明显升高,因此给予钙剂和骨化三醇以升高血钙、降低PTH水平、促进骨骼矿化;此外,患者并发代谢性酸中毒,予碳酸氢钠纠酸治疗。治疗过程中,监测血钙磷、PTH、24h尿钙、血PH值及碳酸氢根水平,调整药物剂量,必要时完善甲状旁腺超声、甲状旁腺显像。随着患者血Ca、P恢复正常,酸中毒纠正,PTH降低、骨转换指标下降,患者骨痛明显减轻、左胫腓骨远端骨折逐渐愈合。关于骨质疏松的治疗,应根据CKD患者的骨转换指标,选择合适的药物:高骨转换型骨病更适于抗骨吸收药物,如双膦酸盐类、核因子κB受体活化因子配体(receptor activator for nuclear factor-κ B ligand,RANKL)单克隆抗体;低骨转换型骨病更适于促骨形成药物,如重组人甲状旁腺素、新型骨硬化蛋白(sclerostin, SOST)单克隆抗体[7, 13, 24-25]。然而,由于本例患者骨密度不低,eGFR < 35 mL/min,故未使用上述抗骨质疏松药物。
对本例CKD并发骨痛、骨折长期不愈合疑难病例的鉴别诊断及综合治疗表明,肾性骨病是慢性肾脏病常见且严重的并发症。骨骼病变类型多样,应予以早期诊断,并给予钙剂、活性维生素D、纠正代谢性酸中毒等综合治疗措施,以减轻骨痛、降低骨折率、避免骨折延迟愈合,减少骨病对患者生活质量及预期寿命的不良影响。
| [1] | 史铁蘩. 协和内分泌和代谢学[M]. 北京: 科学出版社, 1999 : 1529. |
| [2] | Fukumoto S, Ozono K, Michigami T, et al. Pathogenesis and diagnostic criteria for rickets and osteomalacia-proposal by an expert panel supported by Ministry of Health, Labour and Welfare, Japan, The Japanese Society for Bone and Mineral Research and The Japan Endocrine Society[J]. J Bone Miner Metab, 2015, 62 : 665–671. |
| [3] | Liu SH, Chu HI. Treatment of renal osteodystrophy with dihydrotachysterol (A.T.10) and iron[J]. Science, 1942, 95 : 388–389. DOI:10.1126/science.95.2467.388 |
| [4] | Kidney Disease:Improving Global Outcomes (KDIGO) CKD-MBD Work Group. KDIGO clinical practice guideline for the diagnosis, evaluation, prevention and treatment of chronic kidney disease-mineral and bone disorder (CKD-MBD)[J]. Kidney Int Suppl, 2009:S1-S130. |
| [5] | Carrillo-Lopez N, Panizo S, Alonso-Montes C, et al. Direct inhibition of osteoblastic Wnt pathway by fibroblast growth factor 23 contributes to bone loss in chronic kidney disease[J]. Kidney Int, 2016, 90 : 77–89. DOI:10.1016/j.kint.2016.01.024 |
| [6] | Asai O, Nakatani K, Tanaka T, et al. Decreased renal alpha-Klotho expression in early diabetic nephropathy in humans and mice and its possible role in urinary calcium excretion[J]. Kidney Int, 2012, 81 : 539–547. DOI:10.1038/ki.2011.423 |
| [7] | Babayev R, Nickolas TL. Bone disorders in chronic kidney disease:an update in diagnosis and management[J]. Semin Dial, 2015, 28 : 645–653. DOI:10.1111/sdi.2015.28.issue-6 |
| [8] | Kim SM, Long J, Montez-Rath M, et al. Hip fracture in patients with non-dialysis-requiring chronic kidney disease[J]. J Bone Miner Res, 2016, 31 : 1803–1809. DOI:10.1002/jbmr.v31.10 |
| [9] | Malluche HH, Mawad HW, Monier-Faugere MC. Renal osteodystrophy in the first decade of the new millennium:analysis of 630 bone biopsies in black and white patients[J]. J Bone Miner Res, 2011, 26 : 1368–1376. DOI:10.1002/jbmr.309 |
| [10] | West SL, Lok CE, Langsetmo L, et al. Bone mineral density predicts fractures in chronic kidney disease[J]. J Bone Miner Res, 2015, 30 : 913–919. DOI:10.1002/jbmr.2406 |
| [11] | Iimori S, Mori Y, Akita W, et al. Diagnostic usefulness of bone mineral density and biochemical markers of bone turnover in predicting fracture in CKD stage 5D patients-a single-center cohort study[J]. Nephrol Dial Transplant, 2012, 27 : 345–351. DOI:10.1093/ndt/gfr317 |
| [12] | Jamal S, Cheung AM, West S, et al. Bone mineral density by DXA and HR pQCT can discriminate fracture status in men and women with stages 3 to 5 chronic kidney disease[J]. Osteoporos Int, 2012, 23 : 2805–2813. DOI:10.1007/s00198-012-1908-y |
| [13] | West SL, Patel P, Jamal SA. How to predict and treat increased fracture risk in chronic kidney disease[J]. J Intern Med, 2015, 278 : 19–28. DOI:10.1111/joim.2015.278.issue-1 |
| [14] | Adams JE. Renal bone disease:radiological investigation[J]. Kidney Int Suppl, 1999, 73 : S38–41. |
| [15] | Oryan A, Monazzah S, Bigham-Sadegh A. Bone injury and fracture healing biology[J]. Biomed Environ Sci, 2015, 28 : 57–71. |
| [16] | Silverman SL, Kupperman ES, Bukata SV. Fracture healing:a consensus report from the International Osteoporosis Foundation Fracture Working Group[J]. Osteoporos Int, 2016, 27 : 2197–2206. DOI:10.1007/s00198-016-3513-y |
| [17] | Zura R, Mehta S, Della RG, et al. Biological risk factors for nonunion of bone fracture[J]. JBJS Rev, 2016, 4. |
| [18] | Priemel M, von Domarus C, Klatte TO, et al. Bone mineralization defects and vitamin D deficiency:histomorphometric analysis of iliac crest bone biopsies and circulating 25-hydroxyvitamin D in 675 patients[J]. J Bone Miner Res, 2010, 25 : 305–312. DOI:10.1359/jbmr.090728 |
| [19] | Kolb JP, Schilling AF, Bischoff J, et al. Calcium homeostasis influences radiological fracture healing in postmenopausal women[J]. Arch Orthop Trauma Surg, 2013, 133 : 187–192. DOI:10.1007/s00402-012-1650-0 |
| [20] | Briggs AD, Kuan V, Greiller CL, et al. Longitudinal study of vitamin D metabolites after long bone fracture[J]. J Bone Miner Res, 2013, 28 : 1301–1307. DOI:10.1002/jbmr.1855 |
| [21] | Cheung WH, Miclau T, Chow SK, et al. Fracture healing in osteoporotic bone[J]. Injury, 2016, 47 : S21–S26. |
| [22] | Krieger NS, Frick KK, Bushinsky DA. Mechanism of acid-induced bone resorption[J]. Curr Opin Nephrol Hypertens, 2004, 13 : 423–436. DOI:10.1097/01.mnh.0000133975.32559.6b |
| [23] | Moe SM, Abdalla S, Chertow GM, et al. Effects of cinacalcet on fracture events in patients receiving hemodialysis:The EVOLVE Trial[J]. J Am Soc Nephrol, 2015, 26 : 1466–1475. DOI:10.1681/ASN.2014040414 |
| [24] | Schipper LG, Fleuren HW, van den Bergh JP, et al. Treatment of osteoporosis in renal insufficiency[J]. Clin Rheumatol, 2015, 34 : 1341–1345. DOI:10.1007/s10067-015-2883-4 |
| [25] | Moe SM, Chen NX, Newman CL, et al. Anti-sclerostin antibody treatment in a rat model of progressive renal osteodystrophy[J]. J Bone Miner Res, 2015, 30 : 499–509. DOI:10.1002/jbmr.2372 |
| (收稿日期:2016-08-18) |

