2. 100050 北京,首都医科大学附属北京友谊医院骨科
经皮椎体成形术(percutaneous vertebroplasty,PVP)及经皮椎体后凸成形术(percutaneous kyphobroplasty,PKP)已成为全世界公认的有效治疗骨质疏松性椎体压缩性骨折的微创手术方式,通过注入聚甲基丙烯酸甲酯(polymethyl methacrylate,PMMA),能够快速缓解疼痛、恢复椎体高度,减轻患者腰背疼,明显改善患者的生活质量[1]。目前对于椎体成形术止痛机制的考虑主要有以下3点:(1) 骨水泥的填充能够稳定椎体微小骨折,达到机械稳定性[2-3];(2) 骨水泥的热效应致骨内神经组织变性、坏死,使神经对疼痛的敏感性降低或消失[4];(3) 单体甲基丙烯酸甲酯(methyl methacrylate,MMA)对椎体内神经组织的毒性作用[5]。其中前两点均得到大多数国内外研究者的认可,然而目前国内外并无具体实验研究阐述MMA单体对神经细胞的影响[2-3]。本实验通过体外细胞培养实验研究骨水泥单体对脊髓背根神经元损伤的影响,以推测释放的单体对椎体内感觉神经细胞的影响。
资料与方法 实验动物SD大鼠乳鼠12只购于北京华阜康动物公司,实验动物许可证号:SYXK(京)2012-0023。
实验仪器美国安捷伦气相色谱仪6890n;EPS/PS系列电子天平;IKL RH basic可控温磁力搅拌器;MDF-192超低温冰箱(MDF-192 SANYO ElectricCo Ltd Japan);XDS-1B倒置显微镜(重庆奥特光学仪器有限责任公司);YJ-1450医用超净工作台(苏州净化设备仪厂);CO2培养箱(Heal Force Development Ltd.Hong Kong);模具,恒温箱,小烧杯,温度计,湿度计,BD Ariall流式细胞分选仪。
实验试剂山羊血清(Santa Cruz公司),Anti-NSE抗体(Abcam公司),Alexa Fluor®488标记山羊抗兔IG(重链+轻链),抗荧光衰减封片剂(含6-diamidino-2-phenylindol,DAPI),MTT溶液,二甲基亚砜,台盼蓝,骨水泥e(Osteopal V批号:76495241),标准甲基丙烯酸甲酯试剂,Annexin V凋亡检测试剂盒(BD Biosciences公司)。
实验对象与分组原代脊髓背根神经细胞(dorsal root ganglion neurons, DRGs)提取[6]:无菌条件下,将冰袋冷冻下的12只SD大鼠乳鼠分次分别去头处死,组织剪沿背部剪开皮肤及软骨,暴露脊椎,矢状位打开椎管,小心剥离脊髓,解剖显微镜下可见两侧椎体的外侧隐窝中有圆形透亮的脊神经节,解剖镊逐个摘除神经节,并用2支解剖镊交替尽量剥除神经节表面的筋膜。将来源于12只乳鼠的神经节放入盛有4 ℃解剖液的平皿中,眼科剪将神经节剪至0.5 mm的碎块,并用解剖液冲洗3遍。
脊髓背根神经细胞鉴定及纯度测定:用移液器将碎块移加入含有0.25%胰蛋白酶的离心管中离心10 min,置于37 ℃培养箱中消化20 min。消化后加入含有10%胎牛血清(fetal bovine serum,FBS)的细胞培养基(dulbecco modified eagle medium-F12,DMEM-F12),培养基离心管中作用10 min,终止胰蛋白酶的消化,然后将絮状组织吸出,置入另一离心管,用同上培养基漂洗2次,最后加入神经细胞培养基[含10% FBS、双抗、人类白细胞抗原B27(human leukocyte antigen-B27,HLA-B27)]用吸管吹打,将其制成单细胞悬液,以106个/mL的密度接种于24孔塑料细胞培养板中,每板种植8孔,共种植8个培养板。于37 ℃、5% CO2培养箱中进行培养。培养7 d后,随机取出1板神经元细胞,吸出培养液上清,4%多聚甲醛室温下固定20 min,磷酸缓冲盐溶液(phosphate buffer saline,PBS)清洗3次,每次5 min。0.5% Triton-100打孔15 min,加入山羊血清封闭液,室温下作用20 min,吸出封闭液,不冲洗,加入1:200的兔抗鼠神经元特异性烯醇化酶(neuron specificity enolization enzymes,NSE),4℃过夜。次日PBS清洗3次,加入荧光标记的山羊抗兔IgG,避光,室温下作用20 min,PBS清洗3次,DAPI染核,荧光显微镜下观察。随机选取5个视野,相差显微镜下计数同一视野的染色阳性细胞及所有细胞,二者之比即为神经元细胞的纯度,计算神经元细胞的纯度平均值。
体外实验模拟椎体成形术,室温控制在23 ℃,湿度45%,按手术实际情况1:1比例混合骨水泥粉末与液体,开始计时,充分搅拌,设置重复试样5个,分别注入4.4 mL球状模具并搅拌30 s,静置1 min 30 s,骨水泥工作时间8 min,分别称其重量。然后把骨水泥球放入存有22 mL预热37 ℃的人工体液的50 mL的试管中,置于37 ℃的恒温箱中,于放入后每10 min采用气相色谱法测浸泡液中MMA单体浓度,以此类推,并记录,得出60 min中内MMA释放浓度范围和变化趋势。取培养7 d DRGs,根据体外实验模拟椎体成形术测得的MMA释放浓度范围,于DRGs中加入含有不同浓度MMA的培养基,设为正常对照组,10-3,10-2,10-1,1和10 g/L MMA组,每组设置8孔细胞。
细胞存活率及凋亡率测定采用台盼蓝染色计数测定存活率[7]:随机选取每组中的5孔细胞培养10 min,吸出含MMA培养基,PBS清洗,分别进行台盼蓝染色。台盼蓝染色法对PMMA损伤后的DRGs进行细胞计数:取MMA作用后的DRGs细胞,取5张细胞爬片,PBS清洗,放于载玻片,滴加0.4%台盼蓝溶液,倒置显微镜下观察,计数随机视野内100个细胞,计算死亡细胞百分率。死亡的细胞着浅蓝色并膨大,无光泽。细胞存活率(%)=未染色的细胞数/观察的细胞总数×100。
采用磷脂酰丝氨酸外翻分析法(Annexin V法)分析MMA单体诱导的DRGs细胞凋亡[8]:随机选取每组中的3孔细胞培养60 min后,吸出含MMA的培养基,PBS清洗,加入正常培养基,继续培养24 h。DRGs染色:先用0.25%的胰酶消化,将细胞(1×106)用PBS洗2次,加入100 μL结合缓冲液(binding buffer)和假单胞菌外毒素(pseudomonas exotoxin,PE)标记的膜联蛋白Annexin-V(20 μ g/mL)5 μL,室温避光30 min,再加入7-氨基放线菌素D(7-amino-actinomycin,7-AAD)(50 μg/mL)5 μL,避光反应5 min后,加入400 μL结合缓冲液Binding Buffer,立即用BD Ariall仪器进行流式细胞术定量检测,同时以不加AnnexinV-PE及7-AAD的一管作为阴性对照。分析细胞的凋亡率。
统计学方法实验结果采用SPSS17.0统计软件分析,各组实验数据以均数±标准差(x±s)表示,采用单因素方差分析及LSD检验,以P<0.05为差异有统计学意义。
结果 初步测定单体释放量及其释放趋势骨水泥在植入后前10 min内释放出大量单体,约占总释放量的90%以上,随着时间延长,单体释放总量基本保持平稳。60 min内测得MMA单体最大释放浓度为(0.102 5±0.006 8) g/L(图 1)。
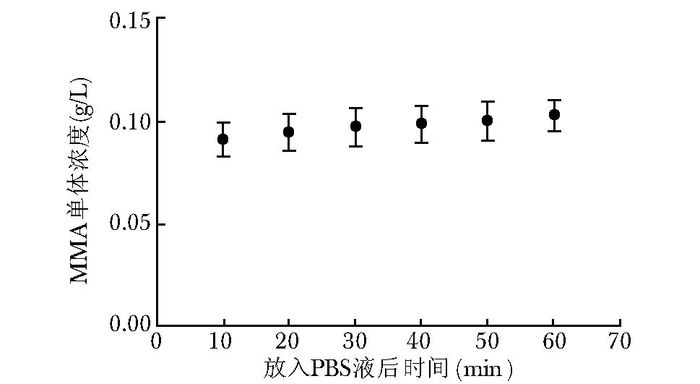
|
| 图 1 单体MMA释放浓度及变化趋势 Figure 1 Concentration range and trends of MMA monomer MMA:甲基丙烯酸甲酯 |
培养7 d的DRGs细胞,神经元烯醇化酶特异性抗体主要表达在神经细胞的细胞核内,蓝色荧光下DAPI染核的细胞见图 2A,绿色荧光下NSE表达阳性的神经细胞见图 2B。5个视野的阳性率分别为69/79,87/89,83/86,76/77,80/94。神经元细胞的纯度平均为(96.04±2.01)%。
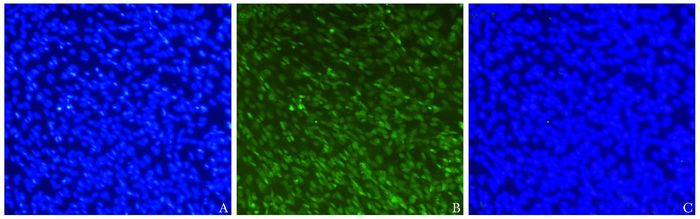
|
| 图 2 NSE荧光染色鉴定DRG细胞 Figure 2 DRGs identified by NSE immunofluorescence staining(×100) A:蓝色荧光下DAPI染核的细胞;B:绿色荧光下NSE表达阳性的神经细胞;C:Merger图像 |
培养7 d的DRGs神经元细胞大量生长,细胞胞体呈圆形较大,折光性好,细胞连成网络状、突起细长。台盼蓝染色洗脱后,死亡细胞着浅蓝色并膨大,无光泽;活细胞不着色并保持正常形态,有光泽(图 3)。随着MMA浓度的增加,出现蓝染的细胞比例明显增加,图 3A未见明显的细胞蓝染征象,图 3B、C可见零星蓝染的细胞,图 3D、E可见视野内少量蓝染细胞,图 3F可见大量细胞出现蓝染。
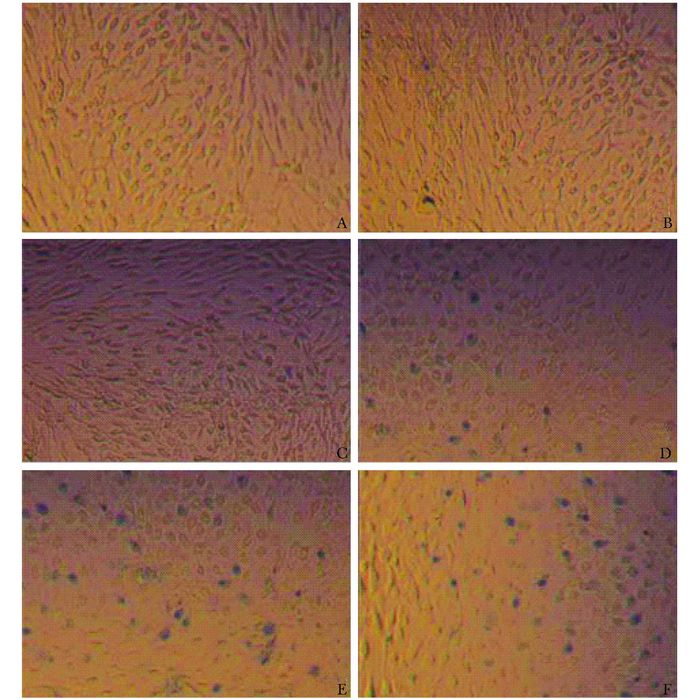
|
| 图 3 台盼蓝染色法观察MMA单体对DRGs的细胞毒性(×200) Figure 3 DRGs toxic effects of MMA monomer dealed with trypan blue staining(×200) A:对照组;B:10-3g/L MMA;C:10-2g/L MMA; D:10-1 g/L MMA; E:1 g/L MMA;F:10 g/L MMA; MMA:甲基丙烯酸甲酯单体 |
通过单因素方差分析及LSD检验,10-1、1、10 g/L组细胞存活率与对照组相比,差异有统计学意义(P<0.05),10-3,10-2 g/L组与对照组相比,差异均无统计学意义(P值分别为0.380、0.070)(表 2)。
| 组别 | MMA单体浓度(g/L) | 存活率(%) |
| 1 | 0 | 97.00±1.87 |
| 2 | 10-3 | 95.00±2.24 |
| 3 | 10-2 | 92.20±2.77 |
| 4 | 10-1 | 89.40±5.18* |
| 5 | 1 | 86.20±4.32* |
| 6 | 10 | 77.60±3.78* |
| MMA:甲基丙烯酸甲酯;与对照组比较,*P<0.05 | ||
流式细胞仪测定MMA单体诱导的DRGs细胞凋亡情况,P3表示早期凋亡指标。通过单因素方差分析及LSD检验表明各浓度组分别与对照组相比,差异均有统计学意义,说明MMA单体能够诱导DRGs细胞的凋亡(表 3)。
| 组别 | MMA浓度(g/L) | 凋亡率P3(%) |
| 1 | 0 | 22.6±5.0 |
| 2 | 10-3 | 38.3±2.2* |
| 3 | 10-2 | 40.5±1.1* |
| 4 | 10-1 | 44.1±3.5* |
| 5 | 1 | 48.0±1.8* |
| 6 | 10 | 54.8±2.7* |
| MMA:甲基丙烯酸甲酯;与对照组比较,*P<0.05 | ||
经皮椎体(后凸)成形术是目前治疗骨质疏松性椎体压缩骨折最常用、最有效的方法。由于其较好的临床效果,近年来得到广泛推广。然而其确切的止痛机制仍不明确,目前认为可能存在的机制包括力学、热学、化学等因素。首先,通过填充骨水泥,使其沿着骨小梁间隙弥散至整个或部分椎体,固定椎体的微骨折,增强椎体稳定性,有效防止骨折部位的微动,从而限制对局部痛觉末梢神经的刺激,防止与椎体微骨折相关的疼痛[2-3]。其次,有研究报道甲基丙烯酸甲酯聚合时椎体中央温度能达到49~112 ℃,可能直接导致椎体内痛觉神经末梢及神经细胞坏死,造成对疼痛敏感性降低。第三,MMA对椎体内感觉神经的毒性作用[4]。其中前两点已得到广泛学者认可,第三点仍存在较大争议。本研究前期实验得出,MMA单体能够降低蟾蜍坐骨神经动作电位的振幅和传导速度,明显影响神经传导[9]。然而目前MMA单体的具体浓度与神经细胞毒性之间的关系尚无文献报道。本实验通过体外实验研究MMA单体对脊髓背根神经元损伤的影响,以推测持续释放的单体对椎体内感觉神经细胞的影响。
本实验参考王黎明等[10]的PVP术治疗32个骨质疏松性椎体压缩骨折(T6-L4) 的数据,采用CT扫描及计算机处理得出其研究中骨质疏松椎体体积约为22 mL,骨水泥的平均注入量为4.4 mL。本实验测定4.4 mL的骨水泥置入22 mL的人工体液后60 min内MMA单体的释放量、浓度及其趋势。实验得出MMA单体释放最大浓度为(0.102 5±0.006 8) g/L,进一步研究此单体浓度范围对DRGs细胞的作用。
本研究采用台盼蓝染色法,测定不同浓度的MMA单体作用于DRGs细胞,所产生的细胞毒性,发现10-1g/L的MMA即对DRGs存在明显细胞毒性,10 g/L单体的细胞毒性明显增加。Stricker等[11]证实浓度超过10 g/L的MMA单体具有单核细胞、粒细胞和上皮细胞毒性,使细胞的生长、DNA的合成和糖代谢明显受到抑制,甚至引起细胞凋亡。Baker等[12]用10 g/L的MMA处理白细胞及内皮细胞,观察到绝大多数细胞已经崩解。关于MMA单体能够引起细胞毒性的原因,Kedjarune等[13]认为MMA单体通过影响细胞磷脂双分子层,破坏细胞膜的结构,从而产生细胞毒性。Bereznowski[14]通过大鼠肝脏线粒体试验发现,MMA单体作为一种氧化磷酸化的解偶联剂影响线粒体的结构与功能,从而破坏细胞膜失去稳定结构,导致细胞的崩解坏死。
本研究通过流式细胞学方法,测定不同浓度的MMA单体作用于DRGs细胞所产生的凋亡率,发现MMA单体能够诱导DRGs的凋亡,并且凋亡率随浓度增加而增加。关于MMA能够诱导细胞凋亡的原因,Ansteinsson等[15]认为甲基丙烯酸酯能够结合谷胱甘肽中的半胱氨酸,从而导致谷胱甘肽的减少,细胞抗氧化能力减弱,进而导致DNA损害,干扰细胞周期,导致丝裂原活化蛋白激酶变性,进而致细胞死亡。
目前大量研究认为甲基丙烯酸甲酯的毒性是明确的[16],然而对于椎体成形术椎体内MMA浓度是否高到产生神经毒性损伤而参与止痛一直未能明确[17]。本研究通过体外模拟椎体成形术,初步得出椎体内MMA单体的最大浓度,发现对神经细胞存在一定毒性,10-3 g/L的MMA单体即可促进细胞凋亡,10-1 g/L即存在明显的细胞毒性。
椎体成形术中释放的MMA单体能够造成椎体内感觉神经元显著损伤,并且较低浓度即可促进细胞的凋亡,因此MMA单体的神经细胞毒性对椎体成形术的止痛机制有意义。本研究由于客观原因限制,采用体外实验存在一定的局限性,目前无法准确测得椎体内MMA瞬时积聚浓度的最大值,并且细胞死亡率及凋亡率可能与在体实验有一定差别。
椎体成形术中存在MMA单体释放,并且对椎体内感觉神经细胞存在毒性,因此MMA单体释放对椎体成形术快速止痛有一定意义。
| [1] | Tang H, Zhao JD, Li Y, et al. Efficacy of percutaneous kyphoplasty in treating osteoporotic multithoracolumbar vertebral compression fractures[J]. Orthopedics, 2010, 33: 885–891. |
| [2] | Mermelstein LE, McLain RF, Yerby SA. Reinforcement of thoracolumbar burst fractures with calcium phosphate cement. A biomechanical study[J]. Spine (Phila Pa 1976), 1998, 23: 664–670. DOI:10.1097/00007632-199803150-00004 |
| [3] | Liebschner MA, Rosenberg WS, Keaveny TM. Effects of bone cement volume and distribution on vertebral stiffness after vertebroplasty[J]. Spine (Phila Pa 1976), 2001, 26: 1547–1554. DOI:10.1097/00007632-200107150-00009 |
| [4] | Urrutia J, Bono CM, Mery P, et al. Early histologic changes following polymethylmethacrylate injection (vertebroplasty) in rabbit lumbar vertebrae[J]. Spine (Phila Pa 1976), 2008, 33: 877–882. DOI:10.1097/BRS.0b013e31816b46a5 |
| [5] | Gough JE, Downes S. Osteoblast cell death on methacrylate polymers involves apoptosis[J]. J Biomed Mater Res, 2001, 57: 497–505. DOI:10.1002/(ISSN)1097-4636 |
| [6] | Orita S, Ohtori S, Koshi T, et al. The effects of risedronate and exercise on osteoporotic lumbar rat vertebrae and their sensory innervation[J]. Spine (Phila Pa 1976), 2010, 35: 1974–1982. DOI:10.1097/BRS.0b013e3181d5959e |
| [7] | Qiu J, Shi P, Mao W, et al. Effect of apoptosis in neural stem cells treated with sevoflurane[J]. BMC Anesthesiol, 2015, 15: 0018–0026. DOI:10.1186/1471-2253-15-18 |
| [8] | Nordin M, Nystrom B, Wallin U, et al. Ectopic sensory discharges and paresthesiae in patients with disorders of peripheral nerves, dorsal roots and dorsal columns[J]. Pain, 1984, 20: 231–245. DOI:10.1016/0304-3959(84)90013-7 |
| [9] | 张体栋, 包利, 陈浩, 等. 甲基丙烯酸甲酯对蟾蜍神经动作电位传导的影响[J]. 临床和实验医学杂志, 2015, 3: 704–707. DOI:10.3969/j.issn.1671-4695.2015.09.003 |
| [10] | 王黎明, 喻忠, 桂鉴超, 等. 计算机导航辅助下经皮椎体成形术[J]. 中华骨科杂志, 2006, 26: 676–681. DOI:10.3760/j.issn:0253-2352.2006.10.008 |
| [11] | Stricker K, Orler R, Yen K, et al. Severe hypercapnia due to pulmonary embolism of polymethylmethacrylate during vertebroplasty[J]. Anesth Analg, 2004, 98: 1184–1186. |
| [12] | Baker S, Brooks SC, Walker DM. The release of residual monomeric methyl methacrylate from acrylic appliances in the human mouth:an assay for monomer in saliva[J]. J Dent Res, 1988, 67: 1295–1299. DOI:10.1177/00220345880670101001 |
| [13] | Kedjarune U, Charoenworaluk N, Koontongkaew S. Release of methyl methacrylate from heat-cured and autopolymerized resins:cytotoxicity testing related to residual monomer[J]. Aust Dent J, 1999, 44: 25–30. DOI:10.1111/j.1834-7819.1999.tb00532.x |
| [14] | Bereznowski Z. Effect of methyl methacrylate on mitochondrial function and structure[J]. Int J Biochem, 1994, 26: 1119–1127. DOI:10.1016/0020-711X(94)90134-1 |
| [15] | Ansteinsson V, Kopperud HB, Morisbak E, et al. Cell toxicity of methacrylate monomers-the role of glutathione adduct formation[J]. J Biomed Mater Res A, 2013, 101: 3504–3510. DOI:10.1002/jbm.a.v101.12 |
| [16] | Webb JC, Gbejuade H, Lovering A, et al. Characterisation of in vivo release of gentamicin from polymethyl methacrylate cement using a novel method[J]. Int Orthop, 2013, 37: 2031–2036. DOI:10.1007/s00264-013-1914-5 |
| [17] | 徐宏辉, 刘宏建, 王义生. 经皮椎体成形术和经皮后凸成形术的止痛机制研究进展[J]. 中华实验外科杂志, 2008, 25: 1686–1687. DOI:10.3321/j.issn:1001-9030.2008.12.064 |
| (收稿日期:2016-11-01) |

