脆性骨折是骨质疏松症的严重后果,常见骨折部位有脊椎、髋部和前臂远端等。据统计2000年全球每年新发脆性骨折约900万例次,而2010年仅北美、欧洲和太平洋地区的12个工业化国家脆性骨折就达520万例次[1]。中国骨质疏松性骨折也在快速增加。近年来,我国髋部骨折的发生率有明显上升趋势,1990-1992年北京地区50岁以上的髋部骨折率男性为83/10万,女性为80/10万;而2002-2006年,此发生率男性增长为129/10万,女性增长为229/10万[2]。2010年中国大陆发生骨质疏松性骨折233万例次,其中髋部骨折36万例次,椎体骨折111万例次,其他骨质疏松性骨折86万例次;为此产生的医疗支出高达94.5亿美元。据预测到2030年中国大陆地区骨质疏松性骨折发生率将达436万例次/年,至2050年达599万例次/年,相应的医疗支出分别为178亿美元和254亿美元[3]。
脆性骨折后再发骨折风险明显增加初发骨质疏松性骨折妇女中26%会再发骨折,其中23%发生于初次骨折后第1年,54%发生在5年内[4]。Klotzbuecher等[5]荟萃分析表明椎体骨折妇女再发骨折的风险是无椎体骨折史者的4倍。初次骨折后患者标化死亡率增加,死亡风险持续增高5~10年;而再骨折会进一步增加患者5年内病死率[6]。再次骨折的发生与患者对治疗的依从性不高有关,因骨质疏松症不能得到有效的治疗,不仅增加了患者的骨折风险,也增加了医疗负担。由此可见,脆性骨折患者是未来再发骨折的极高危人群。对骨折后人群积极开展骨质疏松症的评估和干预,对降低骨折发生率和相关的医疗支出,可能会达到事半功倍之效。
脆性骨折后骨质疏松症的诊断和治疗不足尽管骨质疏松及其骨折在我国的流行趋势愈演愈烈,但对骨质疏松及其骨折的防治还存在较大缺口。新近资料表明,即使发生了骨质疏松性椎体骨折或髋部骨折,给予有效抗骨质疏松治疗的患者仅为24%[7]。一项对亚洲地区1 122例髋部骨折后骨质疏松症的诊疗状况调查表明,仅28%患者做过骨密度检查,51.5%患者被告知患有骨质疏松症,而仅33.0%的患者处方抗骨质疏松症药物。以上比例在中国大陆最低,且明显低于香港地区、台湾地区,新加坡、马来西亚和韩国等[8]。全球范围内,脆性骨折后骨质疏松症的诊疗还存在明显不足,在亚洲、特别是在中国大陆,这一问题更为突出。
实施积极防治骨质疏松症的措施可以有效减少再发骨折骨质疏松症可防可治,在给予适当干预措施后,骨质疏松性骨折可以预防。已经批准上市的多数抗骨质疏松症药物约可使骨折风险降低50%。特别需要强调的是,对发生脆性骨折或腰椎压缩性骨折的患者,部分药物能使其再发骨折的风险降低50%以上[9]。此外,健康知识普及、适量运动、预防跌倒和避免使用损害骨健康药物等综合干预措施,均可有效地预防再发骨折。
“攻克骨折”全球行动 “攻克骨折”行动目标2012年国际骨质疏松基金会(International Osteoporosis Foundation,IOF)启动了“攻克骨折(Capture the Fracture Campaign) ”行动,即对脆性骨折的患者提供标准化医疗服务,以期减少二次或多次骨折的发生。该行动的落脚点是基于协调员参与的骨折后医护模式,或称作“骨折联络服务(Fracture Liaison Services,FLS)”。IOF希望通过“攻克骨折”行动提高患者、医务人员、医疗机构、骨质疏松学术组织、政策制定者和政府等各方对骨质疏松症的认识,并能分享他们的最佳实践经验,在全球范围内减少再骨折的发生,降低骨折后患者病死率和巨大医疗费用[10]。
“攻克骨折”行动实施2012年在法国波尔多召开的IOF欧洲骨质疏松和骨关节炎会议上首次倡议实施“攻克骨折”行动,号召由骨质疏松骨折相关的医务人员做为FLS的倡导者,与患者组织或代表共同努力,影响当地卫生政策,落实FLS计划。同年10月世界骨质疏松日以“攻克骨折”为主题,倡导在全球范围内防止再次骨折的发生。美国骨矿盐研究学会(American Society of Bone and Mineral Research,ASBMR)在2012年组织了预防再发骨折工作组,并发表了题为《让骨折止于第一次》的工作报告。报告提出了到2020年让髋部骨折率降低20%的初步目标,并建议通过落实FLS而实现[11]。之后FLS体系在全球范围推广,欧洲、美洲、澳大利亚和亚洲很多国家和地区相继实施了FLS计划。
骨折联络服务体系的形成和实施 FLS的形成和实施爱丁堡骨科创伤服务(Edinburgh Orthopaedic Trauma Service)调查了1988-1999年发生骨折的22 000例患者,12年间再发骨折者2 900例(13.2%),同时发现予以骨质疏松症的诊断和治疗,可以明显减少骨折的发生,提示对骨折后患者进行疾病管理的重要性[12]。而2003年发表的苏格兰地区骨折后服务研究可谓是FLS之雏形,研究组针对该地区骨折后进行骨密度检查患者不足10%的现实,开展了骨折联络服务项目,旨在增加骨折后患者检查骨密度,诊断骨质疏松症和给予抗骨质疏松药物的比率。该项目实施18个月后,辖区内50岁以上发生骨折的患者,有近3/4接受了骨密度双能X线吸收检测(dual energy X-ray absorptiometry,DXA),其中82.3%被诊断为骨量减少或骨质疏松症[13]。尽管全球都在努力提高对骨质疏松症的认识,但是骨折后骨质疏松症的临床诊断、管理和治疗均不能令人满意。因此2012年IOF倡导“攻克骨折”行动,推广实施FLS项目后,得到了全球范围的积极响应。美国骨科学会(American Orthopedic Association,AOA)创立的“拥有骨骼(Own the Bone)”支持在全国范围内预防再发骨折;美国风湿病学会年会每年均召开FLS工作组会议; ASBMR开发了工具包支持地方建立FLS。日本开展了针对髋部骨折后的FLS,韩国、新加坡、中国台湾地区也有多家医院开展了FLS。近3年来,IOF对FLS项目进行了完善,其涵盖的范围也得以延展,并形成了较为全面的评价体系。
FLS内容和体系评价FLS是指对骨折后患者识别登记、评价和治疗的全面体系。该体系由医疗机构的多科协作团队组成,其核心围绕专门协调员进行,协调员通常是临床专科护士,由他(她)们负责骨折后患者的全程医护计划,包括识别脆性骨折患者、登记和建立临床数据库、跟踪、评价、记录诊断治疗进展。协调员同时开展教育患者,评估跌倒风险,预约必要的实验室和骨密度检查,推荐或转诊患者,启动治疗和随访[10]。FLS基本流程见图1。
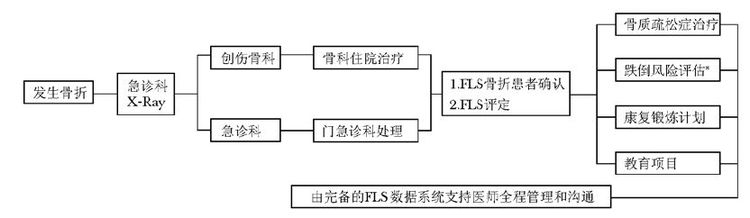
|
| 图1 FLS基本流程图 Fig.1 Basic flow chart of FLS *对老龄患者开展跌倒风险评估;FLS:骨折联络服务 |
FLS项目在以上工作过程中,主要包涵以下4个基本要素[10]:
(1)脆性骨折患者确认:在开展FLS项目的医院,从急诊、骨科、放射科或出院登记系统中,确定50岁以上骨折患者,包括所有髋部骨折、非髋部骨折、椎体骨折的患者。不同的医院由协调员和中心工作人员共同协商和寻求最为有效的识别和确认的方法。
(2)提供个体化评价和处理:临床评价采用标准化的病历收集系统,包括病史、体检、实验室检查、骨折临床危险因素、继发性骨质疏松病因的筛查、药物治疗的禁忌证。预约骨密度检查,推荐全面的干预措施,包括药物性和非药物性干预,如营养干预、减少危险因素、运动康复指导,预防跌倒等。告知患者今后治疗和随访的流程等。
(3)随访和长期治疗:要求患者按时完成随访,且每次随访应评价药物的耐受性、依从性、疗效、伴发事件。协调员分配患者随访的科室、是否同社区建立联系等。保证患者从住院到门诊、门诊到社区之间无缝对接,全程管理。
(4)随访患者、治疗和结局:建立和不断完善数据库,登记患者的基本资料、病史、骨折史、其他临床危险因素、随访日期、治疗、依从性、结局,是否新发骨折等。不同国家和地区可以建立全国或者地区中心数据库,中心化登记和管理。必要时对数据进行分析和总结,促使FLS不断完善(图2)。
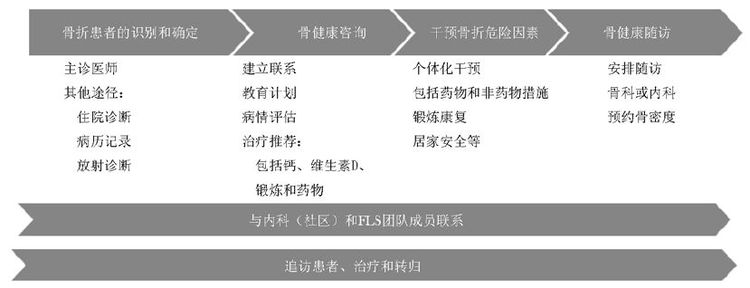
|
| 图2 FLS项目的四个基本要素 Fig.2 Four basic elements of FLS FLS:骨折联络服务 |
在全球范围内建立统一模式的FLS尚存困难,但是不同地区应该具有相似的评价系统,以促进FLS的实施和系统评价。IOF提出了标杆式服务模式和最佳实践框架(best practice framework,BPF),其主要内容和评价标准如表1。依据表1中所列的13项基本内容完成优劣,评判为金、银、铜牌[14](表1)。
| 内容 | 铜 | 银 | 金 |
| 患者确认 | 确认,但未追踪 | 确认,而且追踪 | 确认,追踪并独立审核 |
| 患者评价 | 50%评价 | 70%评价 | 90%评价 |
| 骨折后评价时效 | 13~16周以内 | 9~12周以内 | 8周以内 |
| 椎体骨折(VF)判断标准 | 已知VF认定 | 常规VF认定 | 放射专家确定 |
| 判断标准 | 局部 | 区域 | 全国 |
| 继发性骨质疏松症原因 | 50%患者筛查 | 70%患者筛查 | 90%患者筛查 |
| 跌倒预防服务 | 50%患者评价 | 70%患者评价 | 90%患者评价 |
| 多种危险因素判定 | 50%患者评价 | 70%患者评价 | 90%患者评价 |
| 开始药物干预 | 50%患者开始 | 70%患者开始 | 90%患者开始 |
| 药物评价 | 50%患者评价 | 70%患者评价 | 90%患者评价 |
| 联络方案 | 与医生联系 | 与医生联系达标50%* | 与医生联系达标70%* |
| 长期干预 | 随访1年 | 随访6个月、1年 | |
| 数据库 | 局部 | 区域 | 全国 |
| IOF:国际骨质疏松基金会;*标准:骨折风险评分,DXA- BMD:DXA-椎体骨折判断或脊柱X线照相,原发性骨质疏松症危险因素,继发性骨质疏松病因,骨折/跌倒风险,目前药物治疗,药物依从性评价,随访计划,生活方式危险因素评价,末次骨折的时间 | |||
根据以上BPF标准,2015年IOF公布了对6大洲60家医院的调查结果[14]。这60家医院的服务人口为2万至1 500万,涵盖公立和私立医院,每个机构管理脆性骨折患者146~6 200例,总数达55 160例。其中27家医院达到金牌,23家银牌,10家铜牌。
近期澳大利亚墨尔本的研究提示在实施骨质疏松干预计划和FLS之前,急诊脆性骨折的患者只有2%接受DXA骨密度检查,仅6%的患者予以抗骨质疏松症的药物治疗。在实施FLS后2年中,所有203例新发脆性骨折患者均接受了DXA检查,其中44%的患者诊断骨质疏松症,40%的患者诊断为骨量减少,61%的患者接受了抗骨质疏松症药物,多数患者对FLS满意。据估计FLS实施5年,可使非椎体骨折由59人降为50人,提高生命质量年( Quality Adjusted Life Year,QALY)0.054,每例患者的花费为1 716美元,故认为FLS是一项效价比极高的健康提升措施[15]。Eekman等[16]对荷兰4家医院外科门诊中50岁以上脆性骨折患者2 207例发出邀请。在337例接受的患者中开始骨质疏松症的诊断和治疗,随访1年后仍有88%的患者坚持抗骨质疏松症治疗,只有2%的患者出现新发骨折。在加拿大安大略省开展为期6年的骨折临床筛查项目(Ontario Fracture Clinic Screening program)结果显示,该项目提高患者QALYs 4.3年,每1 000例患者增加花费83 000美元,获得每QALY的花费为19 132美元。其中增加骨密度筛查改进项目更为有效(每QALY获得花费5 720美元)[17],提示即使是非强化的FLS亦有助于预防再发骨折。澳大利亚对急诊中50岁轻创后骨折的患者实施骨折预防临床项目(Fracture Prevention Clinic,FPC),在始发骨折后12~40个月(平均24个月),FPC组新发骨折(5.1%)显著低于对照组(16.4%,P=0.000)。FPC组抗骨质疏松药物使用率为81.3%,而对照组为54.1%(P=0.000),表明FLS干预可以直接降低再发骨折的发生率[18]。
最近在线发表FLS对再发骨折影响的研究,比较了同一地区实施FLS与否的效果。统计了6个月急诊50岁以上轻创后骨折患者并随访3年,其中515例在应用FLS医院,416例在非FLS医院。3年中FLS医院有12%(63/515)、非FLS 医院有17%(70/416)的患者再发轻创后骨折,经基线校正后,FLS医院使再发骨折的风险降低近30%(HR=0.67,95% CI:0.47~0.95,P=0.025),主要骨折风险降低近40%(HR=0.59,95%CI: 0.39~0.90,P=0.013)[19]。
综上,自2012年FLS项目实施以来,该项目已经在全球范围内迅速推广。且许多地区FLS 完成水平很高,达金牌或银牌要求。FLS涵盖的对象也从髋部骨折,拓宽至椎体骨折和其他脆性骨折。FLS项目的实施提高了脆性骨折患者骨质疏松症的管理率、诊断率、抗骨质疏松症药物的使用率和依从性。更重要的是,FLS达到了降低再骨折和提高患者生活质量的预期效果。显示出FLS是一项效价比高,实用、宜于推广预防再发骨折的好项目。
我国建立骨折联络服务体系的必要性 骨质疏松性骨折后管理缺位前文已述及我国普遍存在骨质疏松性骨折后患者管理不到位以及骨质疏松症诊断和治疗不足的情况。骨质疏松性骨折后患者又是骨折的极高危人群,必须予以特别关注和管理。目前的基本状况是骨科医生重点关注骨质疏松骨折后患者手术和术后康复情况,故患者在骨科手术和处理均很到位,但骨科医生却无暇关注骨质疏松症的诊断和治疗。而内分泌科、骨质疏松专科、老年科、妇产科、风湿科、骨内科、中医科和核医学科等专业骨质疏松症团队,不易接触到发生脆性骨折后的骨质疏松症患者,从而造成这部分患者疾病管理缺失。一些医院已经建立了多科协作骨质疏松诊疗中心,骨科专家、内科专家、骨质疏松专家均有参与,但正如Harrington[20]所言“唯独将骨质疏松性骨折的患者排除在这个百慕大三角之外”。补充骨质疏松性骨折后患者管理的缺口乃当务之急。
促进资源合理应用,提升服务水平和质量如何将有限的医疗资源合理的分配和利用,对于“攻克骨折” 至关重要。抓牢骨折的最高危群体——脆性骨折患者,对于切断骨折的恶性循环-再次和多次骨折有事半功倍之效,即要将“好钢用在刀刃上”。因此,响应IO的“攻克骨折”行动,在我国创立涵盖FLS实质,具有中国创新特色的FLS系统,并积极推广应用,对节约医疗资源,提高医疗服务效益,摸索骨质疏松的慢病管理和分级诊疗路径等均将大有裨益。
| [1] | Wade SW,Strader C,Fitzpatrick LA,et al. Sex- and age-specific incidence of non-traumatic fractures in selected industrialized countries[J]. Arch Osteoporos,2012,7:219-227. |
| [2] | Xia WB,He SL,Xu L,et al. Rapidly increasing rates of hip fracture in Beijing,China[J]. J Bone Miner Res,2012,27:125-129. |
| [3] | Si L,Winzenberg TM,Jiang Q,et al. Projection of osteoporosis-related fractures and costs in China:2010-2050[J]. Osteoporos Int,2015,26:1929-1937. |
| [4] | Kanis JA,Johnell O,De Laet C,et al. A meta-analysis of previous fracture and subsequent fracture risk[J]. Bone,2004,35:375-382. |
| [5] | Klotzbuecher CM,Ross PD,Landsman PB,et al. Patients with prior fractures have an increased risk of future fractures:a summary of the literature and statistical synthesis[J]. J Bone Miner Res,2000,15:721-739. |
| [6] | Elliot-Gibson V,Bogoch ER,Jamal SA,et al. Practice patterns in the diagnosis and treatment of osteoporosis after a fragility fracture:a systematic review[J]. Osteoporos Int,2004,15:767-778. |
| [7] | Wang O,Hu Y,Gong S,et al. A survey of outcomes and management of patients post fragility fractures in China[J]. Osteoporos Int,2015,26:2631-2640. |
| [8] | Kung AW,Fan T,Xu L,et al. Factors influencing diagnosis and treatment of osteoporosis after a fragility fracture among postmenopausal women in Asian countries:a retrospective study[J]. BMC Womens Health,2013,13:7. |
| [9] | Cranney A,Guyatt G,Griffith L,et al. Meta-analyses of therapies for postmenopausal osteoporosis. IX:Summary of meta-analyses of therapies for postmenopausal osteoporosis[J]. Endocr Rev,2002,23:570-578. |
| [10] | Akesson K,Marsh D,Mitchell PJ,et al. Capture the Fracture:a Best Practice Framework and global campaign to break the fragility fracture cycle[J]. Osteoporos Int,2013,24:2135-2152. |
| [11] | Eisman JA,Bogoch ER,Dell R,et al. Making the first fracture the last fracture:ASBMR task force report on secondary fracture prevention[J]. J Bone Miner Res,2012,27:2039-2046. |
| [12] | Robinson CM,Royds M,Abraham A,et al. Refractures in patients at least forty-five years old. a prospective analysis of twenty-two thousand and sixty patients[J]. J Bone Joint Surg Am,2002,84-A:1528-1533. |
| [13] | Mclellan AR,Gallacher SJ,Fraser M,et al. The fracture liaison service:success of a program for the evaluation and management of patients with osteoporotic fracture[J]. Osteoporos Int,2003,14:1028-1034. |
| [14] | Javaid MK,Kyer C,Mitchell PJ,et al. Effective secondary fracture prevention:implementation of a global benchmarking of clinical quality using the IOF Capture the Fracture(R) Best Practice Framework tool[J]. Osteoporos Int,2015,26:2573-2578. |
| [15] | Yates CJ,Chauchard MA,Liew D,et al. Bridging the osteoporosis treatment gap:performance and cost-effectiveness of a fracture liaison service[J]. J Clin Densitom,2015,18:150-156. |
| [16] | Eekman DA,van Helden SH,Huisman AM, et al. Optimizing fracture prevention:the fracture liaison service,an observational study[J]. Osteoporos Int,2014,25:701-709. |
| [17] | Yong JH,Masucci L,Hoch JS,et al. Cost-effectiveness of a fracture liaison service-a real-world evaluation after 6 years of service provision[J]. Osteoporos Int,2016,27:231-240. |
| [18] | Van der Kallen J,Giles M,Cooper K, et al. A fracture prevention service reduces further fractures two years after incident minimal trauma fracture[J]. Int J Rheum Dis,2014,17:195-203. |
| [19] | Nakayama A,Major G,Holliday E,et al. Evidence of effectiveness of a fracture liaison service to reduce the re-fracture rate[J]. Osteoporos Int,2016,27:873-879. |
| [20] | Harrington J. Dilemmas in providing osteoporosis care for fragility fracture patients[J]. US Musculoskelet Rev Touch Brief,2006,Ⅱ:64-65. |
| (收稿日期:2016-02-24) |

