2型糖尿病(type 2 diabetes mellitus,T2DM)是以长期血糖升高为主要临床特征的代谢性疾病,可以引起心脏、肾脏、视网膜等全身重要脏器功能障碍,引起慢性并发症的发生及发展,研究报道,我国成人糖尿病患病率已经达到了11.6%[1-2]。T2DM患者胰岛素抵抗及胰岛β细胞分泌功能受损的发病机制主要包括脂肪组织的内分泌机制、机体炎性反应、细胞内氧化应激、线粒体功能异常、内质网氧化应激等机制[2],但具体分子机制仍未研究清楚。
高血糖可引起骨代谢异常,研究证实胰岛素抵抗可以导致成骨细胞及破骨细胞活性降低和骨细胞凋亡增加[3],同时,临床研究也肯定了骨骼系统的内分泌功能,骨代谢产物可通过反馈调节能量代谢而进一步调节糖代谢,二者相互影响。骨骼系统对于机体能量代谢及血糖水平的影响主要通过骨钙素(osteocalcin,OC)实现,动物研究表明其不仅可影响机体产生胰岛素分泌功能,还可调节外周组织对胰岛素的敏感性及外周组织脂肪的蓄积,影响组织对胰岛素作用的敏感性,从而调控机体的能量代谢过程,影响机体血糖代谢[3]。研究证实,未羧化的OC对糖代谢具有调节作用[4],其对患者胰岛素分泌功能有着积极作用,但临床研究中,由于很难测定未羧化OC水平,对于总OC水平是否对患者糖代谢及胰岛功能产生影响,国内外鲜有报道。
本研究通过分析初诊的T2DM患者血清总OC水平与胰岛素抵抗及胰岛β细胞分泌功能的相关性,进一步明确在初诊T2DM患者中总OC的作用,为T2DM的治疗提供新的方向及依据。
对象与方法 研究对象本研究回顾性分析2016年12月至2018年10月于北京大学国际医院内分泌科门诊及住院初诊T2DM患者216例,其中男性142例,女性74例,平均年龄41.93±9.06岁。详细记录患者体格检查及实验室检验资料,并详细记录患者的病程、性别、年龄、身高、体质量和其他一般信息。
所有患者均符合1999年世界卫生组织WHO(World Health Organization,WHO)发布的糖尿病诊断标准[5]:(1)糖尿病的典型症状同时随机血糖≥11.1 mmol/L;(2)空腹血糖≥7.0 mmol/L;(3)葡萄糖耐量试验(oral glucose tolerance test,OGTT),服用75 g葡萄糖2 h后血糖≥11.1 mmol/L。若无糖尿病症状,在另一天重复上述检查,若仍符合三条标准之一者即诊断为糖尿病,并根据临床分型符合2型糖尿病诊断标准。
排除标准:(1)患有1型糖尿病、妊娠糖尿病及其他特殊类型糖尿病者;(2)患有甲状旁腺功能异常、甲状腺功能异常、肾上腺功能异常等疾病;(3)患有严重肝、肾功能不全,骨质疏松症及新发骨折者;(4)绝经后女性;(5)近1个月服用过钙片、维生素D、抗骨质疏松药物、他汀类、糖皮质激素等影响骨代谢药物者。
根据患者血清总OC水平四分位数分为:(1)<P25组(n=54):OC<10.00 mg/L;(2)P25~P50组(n=54):10.00 mg/L≤OC<12.23 mg/L;(3)P50~P75组(n=54):12.23 mg/L≤OC<15.98 mg/L;(4)>P75组(n=54):OC≥15.98 mg/L。
实验室检查所有研究对象均为首次就诊于门诊或住院诊断为2型糖尿病患者,研究对象均空腹8 h以上,并在次日清晨行OGTT试验,患者先抽取空腹静脉血,测定空腹血糖(fast blood glucose,FBG)、空腹胰岛素(fast insulin,FINS)、糖化血红蛋白(glycosylated hemoglobin,HbA1c)、血清总OC、甲状旁腺素(parathyroid hormone,PTH)、钙(calcium, Ca)等生化指标,然后将75 g葡萄糖粉溶于300 mL温开水中,搅拌均匀,5 min内喝完,从服用糖第一口开始计时,检测2 h后血糖(postprandial blood glucose,PBG)、2h后胰岛素(postprandial insulin,PINS)水平,血清总OC采用电化学发光分析法测定,HbA1c采用高效液相色谱法测定,检测仪器型号为日本东曹G8糖化血红蛋白分析仪。
计算相关代谢指标根据测定结果,计算体质量指数(body mass index, BMI)=体重/身高2,采用稳态模型评估法(homeostasis model assessment,HOMA)计算胰岛素敏感性及胰岛素抵抗程度,其中,采用HOMA-β指数评价胰岛素分泌指数,计算公式:HOMA-β=FINS×20/(FBG-3.5)。采用Matsuda指数评估糖负荷后胰岛素敏感性,采用胰岛素抵抗指数评估胰岛素抵抗程度,计算公式:HOMA-IR=FINS×FBG/22.5。采用葡萄糖处置指数(disposition index, DI0)(DI0=HOMA-β/HOMA-IR)表示校正HOMA-IR后基础胰岛素分泌功能。
统计学方法采用SPSS22.0软件进行统计分析,正态分布计量资料采用均数±标准差(x±s)表示,非正态分布数据用平方根(SQRT)转换呈正态分布后再进行分析,组间比较采用单因素方差分析,计数变量使用卡方检验。相关性分析服从正态分布的采用Pearson相关性检验,不服从正态分布的采用Spearman相关性检验,以P<0.05为差异有统计学意义。
结果 不同血清总OC水平T2DM患者胰岛功能的比较低血清总OC水平组PTH较低,与其他总OC水平组比较,差异有统计学意义(P<0.05);其他指标比较,差异无统计学意义(P>0.05)(表 1)。
| 分组 | 年龄(岁) | BMI(kg/m2) | SBP(mmHg) | DBP(mmHg) | TC(mmol/L) | TG(mmol/L) | LDL-C(mmol/L) | HDL-C(mmol/L) | HbA1c(%) | FBG(mmol/L) | PTH(pg/ml) | eGFR(ml/min/1.73 m2) | UA(mmol/L) | Ca(mmol/L) | SQRTHOMA-IR | SQRTHOMA-β | SQRTMatsuda | SOQRDI0 |
| <P25(n=64) | 43.00±5.70 | 28.88±11.12 | 131.15±13.51 | 80.41±10.62 | 4.70±2.10 | 2.76±2.43 | 2.94±1.46 | 0.96±0.47 | 9.50±3.23 | 9.28±3.54 | 32.40±18.54 | 104.85±24.64 | 370.41±168.59 | 2.16±0.52 | 1.97±0.88 | 6.50±4.19 | 8.23±3.80 | 3.37±1.73 |
| P25~P50(n=64) | 43.15±7.53 | 27.32±4.63 | 129.92±16.25 | 78.54±12.54 | 4.53±1.13 | 2.10±1.78 | 2.74±0.81 | 0.99±0.26 | 8.35±3.74 | 9.73±3.72 | 40.65±14.74 | 108.66±18.36 | 354.90±124.73 | 2.25±0.46 | 1.97±0.85 | 6.85±4.46 | 7.80±3.23 | 3.82±1.84 |
| P50~P75(n=64) | 42.90±7.78 | 27.04±5.72 | 129.59±14.15 | 78.97±10.41 | 4.56±1.17 | 1.96±1.23 | 2.95±0.94 | 0.94±0.19 | 8.03±4.33 | 8.99±3.81 | 45.77±24.74 | 105.76±12.77 | 317.68±151.45 | 2.11±0.66 | 1.97±1.16 | 7.12±5.36 | 7.05±3.62 | 3.88±2.03 |
| >P75(n=64) | 43.67±6.64 | 26.59±4.34 | 128.23±15.16 | 78.13±11.40 | 4.40±1.16 | 1.89±1.19 | 2.73±0.83 | 1.05±0.24 | 7.21±3.22 | 8.38±3.68 | 45.92±18.57 | 101.62±26.50 | 326.92±138.06 | 2.28±0.41 | 1.81±1.08 | 7.06±4.10 | 6.83±4.10 | 3.90±1.97 |
| F | 0.220 | 0.740 | 0.260 | 0.300 | 0.270 | 2.050 | 0.490 | 0.840 | 2.590 | 0.670 | 3.550 | 1.060 | 0.380 | 0.700 | 0.260 | 0.150 | 1.220 | 0.490 |
| P | 0.880 | 0.530 | 0.860 | 0.820 | 0.850 | 0.110 | 0.700 | 0.470 | 0.060 | 0.570 | 0.020 | 0.370 | 0.770 | 0.550 | 0.860 | 0.930 | 0.300 | 0.690 |
| OC:骨钙素;T2DM:2型糖尿病;BMI:体质量指数;SBP:收缩压;DBP:舒张压;TC:总胆固醇;TG:三酰甘油;LDL-C:低密度脂蛋白胆固醇;HDL-C:高密度脂蛋白胆固醇;HbA1c:糖化血红蛋白;FBG:空腹血糖;PBG:餐后血糖;PTH:甲状旁腺素;eGFR:肾小球滤过率;UA:尿酸;Ca:血钙;HOMA-IR:胰岛素抵抗指数;DI0:葡萄糖处置指数;SQRTHOMA-IR:HOMA-IR平方根;SQRTHOMA-β:HOMA-β平方根; SQRTMatsuda:Matsuda平方根;SQRTDI0:DI0平方根;1 mmHg=0.133 kPa | ||||||||||||||||||
初诊T2DM女性患者(n=74),血清总OC水平与SQRTHOMA-β呈正相关(r=0.41,P<0.05)(图 1A),并且与SQRTDI0呈正相关(r=0.45,P<0.05)(图 1B)。60岁以上男性T2DM患者(n=44),血清总OC水平与SQRTHOMA-β呈明显正相关(r=0.34,P<0.05)(图 1C), 并且与SQRTDI0呈正相关(r=0.32,P<0.05)(图 1D)。
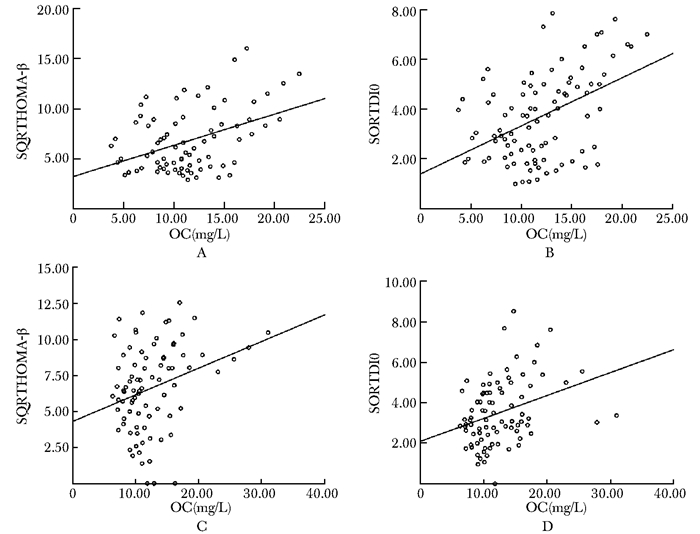
|
| 图 1 血清总OC水平与HOMA-β及DI0相关性分析 Figure 1 Correlation of serum total OC levels with insulin resistance and β function cells A:女性患者,血清总OC水平与SQRTHOMA-β呈正相关(r=0.41,P<0.05);B:女性患者,血清总OC水平与SORTDI0呈正相关(r=0.45,P<0.05);C:60岁以上男性患者,血清总OC水平与SQRTHOMA-β呈正相关(r=0.34,P<0.05);D:60岁以上男性患者,血清总OC水平与SQRTDI0呈正相关(r=0.32,P<0.05);SQRTHOMA-β:HOMA-β平方根;SQRTDI0:DI0平方根; OC:骨钙素;HOMA-β:稳态模型评估β指数;DI0:葡萄糖处置指数 |
应用多元线性回归进一步分析OC与SQRTHOMA-β及SQRTDI0相关性。模型1分别在初诊女性T2DM患者及60岁以上男性患者中,以SQRTHOMA-β为因变量,校正了HbA1c、年龄、BMI、PTH、Ca等因素,发现在上述两种人群中,低OC水平是SQRTHOMA-β水平下降独立危险因素(P<0.05)。模型2分别在初诊女性T2DM患者及60岁以上男性患者中,以SQRTHOMA-β为因变量,校正了年龄、BMI、血糖、血脂、血压、尿酸、eGFR、PTH、Ca等因素,结果显示在上述两种人群中,低OC水平是SQRTHOMA-β水平下降的独立危险因素(P<0.05)。模型3分别在初诊女性T2DM患者及60岁以上男性患者中,以SQRTDI0为因变量,校正了HbA1c、年龄、BMI、PTH、Ca等因素,在上述两种人群中,低OC水平是SQRTDI0水平下降的独立危险因素(P<0.05)。模型4分别在初诊女性T2DM患者及60岁以上男性患者中,以SQRTDI0为因变量,校正了年龄、BMI、血糖、血脂、血压、尿酸、eGFR、PTH、Ca等因素,结果提示在上述两种人群中,低OC水平是SQRTDI0水平下降的独立危险因素(P<0.05)(表 2)。
| 变量 | Β | 标准差 | Wald | t | P | |
| OC女性 | 模型1 | 0.381 | 0.132 | 0.507 | 2.879 | <0.05 |
| 模型2 | 0.545 | 0.236 | 0.986 | 3.023 | <0.05 | |
| 模型3 | 0.425 | 0.432 | 0.745 | 5.634 | <0.05 | |
| 模型4 | 0.236 | 0.231 | 0.897 | 4.464 | <0.05 | |
| OC男性>60岁 | 模型1 | 0.195 | 0.094 | 0.347 | 2.068 | <0.05 |
| 模型2 | 0.423 | 0.376 | 0.879 | 2.321 | <0.05 | |
| 模型3 | 0.381 | 0.132 | 0.507 | 2.879 | <0.05 | |
| 模型4 | 0.245 | 0.143 | 0.853 | 2.874 | <0.05 | |
| 模型1和模型3:校正了HbA1c、年龄、BMI、PTH、Ca因素;模型2和模型4:校正了年龄、BMI、血糖、血脂、血压、尿酸、eGFR、PTH、Ca因素; T2DM:2型糖尿病;OC:骨钙素;HbA1c:糖化血红蛋白;BMI:体质量指数;PTH:甲状旁腺素;Ca:血钙;eGFR:肾小球滤过率 | ||||||
OC是成骨细胞分泌的一种由49个氨基酸组成蛋白,由BGLAP基因编码,其合成受1,25双羟维生素D3 (1,25-dihydroxyvitamin D3)调节。OC分子中含有3个羧化的谷氨酸残基,其羧化过程依赖于体内维生素K水平,因此,OC是一种依赖于维生素K的钙结合蛋白,当维生素K水平偏低时,则会生成羧化不全骨钙素(uncarboxylated osteocalcin,ucOC)。OC主要来源于成骨细胞、成牙质细胞和少量软骨细胞,是骨形成的重要标志之一。在调节骨钙代谢中起重要作用,对骨质疏松诊断、钙磷代谢异常等疾病有重要价值[6]。目前已有研究发现了骨骼系统具有调节机体新陈代谢的内分泌功能[7]。
骨骼系统对于机体能量代谢及血糖水平的影响主要是通过OC实现,成骨细胞分泌的OC可通过对胰岛细胞起到保护作用,减少胰岛细胞的损伤,维持胰岛细胞的分泌功能,提高机体组织细胞对胰岛素的敏感度等多种途径调节机体血糖代谢水平。在成骨细胞中,OC可与存在的胰岛素受体相结合,进而调节机体的能量代谢及血糖代谢水平[8],进一步提示了OC调节糖代谢过程中,胰岛素信号通路发挥重要的作用。
已经有研究证实了OC可以参与胰岛β细胞调节血糖稳态的过程[9],促进胰岛素分泌,改善靶器官胰岛素敏感性并调节能量代谢。因此,对于胰岛功能较低的糖尿病患者,OC可以发挥其特有的作用[10]。目前为止,动物实验研究证实,OC在促进小鼠体内的胰岛β细胞分泌功能中发挥了重要的作用[11]。近期的一项体外细胞学研究表明,将人体的胰腺细胞放在高糖环境中,在加入未羧化OC后,SUR1基因的表达增多,并且胰岛β细胞数量增多及胰岛素分泌量增加[12]。同时,在免疫缺陷的小鼠体内移植人胰岛后注射ucOC,其血清胰岛素及C肽水平在高糖刺激下明显增高,证实ucOC对人胰岛有促进增生作用,验证了在血糖代谢过程中OC的调节作用。
一项纳入66篇文章的Meta分析结果显示,与健康人群相比,糖尿病患者的OC水平明显降低[13],提示OC可能与T2DM的发生发展有关。也有研究发现,在一些早期糖调节受损最终发展为糖尿病患者中,其基线OC水平与糖尿病的发生并无相关性[14-15]。与此类似,在178例肥胖患者中,无论是否并发糖尿病,OC水平均与体质量和血糖水平呈负相关,说明OC和葡萄糖稳态间的关系与糖尿病的发生并无明显相关性[16]。另一项739例T2DM患者的研究分析表明男性患者的血清OC水平低于女性患者,男性主要通过代偿性增加胰岛素分泌量调节糖代谢,女性则通过代偿增加胰岛素分泌量及改善胰岛素抵抗两种途径调节血糖水平[17]。
本研究人群为初诊T2DM患者,结果发现在女性及60岁以上男性患者中,OC水平与胰岛功能成显著正相关,随着OC水平增加,上述患者HOMA-β水平增加。这与之前的报道结果[18]一致。而在一些研究中,在即使非初诊T2DM患者中,也发现患者OC水平越高,FBG及FINS水平越低,胰岛素敏感性相对越高,患者的血糖控制更容易达标[19]。本研究纳入T2DM患者均为首次诊断T2DM,可以更好揭示胰岛素功能与OC水平的相关性。但本研究结果仅在女性及60岁以上男性患者中发现OC水平与胰岛功能呈显著相关,而在60岁以下男性患者中并没有得出相似结论。本研究进一步进行了多元线性回归分析,结果表明在校正了HbA1c、BMI、PTH、Ca等因素后,女性及60岁以上男性患者的OC水平与胰岛β细胞分泌功能呈独立相关(P<0.05)。在另一项研究中,也得到相似结果[17],提示OC与胰岛素敏感性相关性在女性中更明显,而在男性中则不明显。推测可能与饮食习惯、身体特征和身体组成(脂肪百分比)的差异有关。本研究未发现60岁以下男性患者血清总OC水平与胰岛β细胞分泌功能指标相关,可能的原因是本研究中,60岁以下男性血清总OC水平没有明显下降,未发现其与胰岛β细胞分泌功能指标相关;另一种原因可能与样本量有关,不除外随着样本量扩大,在60岁以下男性患者中血清总OC水平与胰岛β细胞分泌功能指标存在相关性的可能。
本研究仍存在一定的局限性,首先,这是一项横断面研究,只揭示相关性,而不能表明因果关系。其次,本研究不能排除OC的羧化状态差异对研究结果的影响。还需进一步增加大样本前瞻性研究探索OC与糖尿病致病机制、病理生理变化等的内在联系。同时,本研究对象为初诊T2DM患者,最小程度减少了病程对本研究的影响,但是不除外部分患者病程较长对胰岛β细胞的影响。另外,因为T2DM对骨转换水平存在一定的影响,本研究对象为初诊T2DM患者,减少了T2DM病程对胰岛β细胞分泌功能的影响,在今后的研究中,还需进一步探讨T2DM与OC相互影响的机制。
OC可能对机体的能量代谢产生调节作用,对于初诊女性及60岁以上男性患者,其与胰岛β细胞分泌功能具有一定的相关性。推测在此类人群中,OC可能会成为评价胰岛β细胞分泌功能指标之一,用于评估糖尿病患者的疾病进程。因此,进一步深层次的评价OC对机体血糖代谢的调节机制可能为糖尿病的治疗及其并发症的预防提供新的策略和方向。
| [1] | Yang L, Shao J, Bian Y, et al. Prevalence of type 2 diabetes mellitus among inlan dresidents in China (2000-2014): A meta-analysis[J]. J Diabetes Invest, 2016, 7: 845–852. DOI:10.1111/jdi.12514 |
| [2] | Mohan V, Amutha A, Ranjani H, et al. Associations of beta-cell function and insulin resistance with youth-onset type 2 diabetes and prediabetes among Asian Indians[J]. Diabetes Technol Ther, 2013, 15: 315–322. DOI:10.1089/dia.2012.0259 |
| [3] | Wongdee K, Charoenphandhu N. Update on type 2 diabetes-related osteoporosis[J]. World J Diabetes, 2015, 6: 673–678. DOI:10.4239/wjd.v6.i5.673 |
| [4] | Epstein S, Defeudis G, Manfrini S, et al. Diabetes and disordered bone metabolism:Time for recognition[J]. Osteoporos Int, 2016, 27: 1931–1951. DOI:10.1007/s00198-015-3454-x |
| [5] | World Health Organization.Definition, diagnosis and classification of diabetes mellitus and its complications. Report of a WHO consultation. Part 1:diagnosis and classification of diabetes mellitus[M]. Geneva: WHO, 1999: 4-7. |
| [6] | Kanazawa I, Yamaguchi T, Yamamoto M, et al. Serum osteocalcin level is associated with glucose metabolism and atherosclerosis parameters in type 2 diabetes mellitus[J]. J Clin Endocrinol Metab, 2009, 94: 45–49. DOI:10.1210/jc.2008-1455 |
| [7] | Yang Y, Liu G, Zhang Y, et al. Association between bone mineral density, bone turnover markers, and serum cholesterol levels in type 2 diabetes[J]. Front Endocrinol Lausanne, 2018, 9: 646. DOI:10.3389/fendo.2018.00646 |
| [8] | 戴小宇, 滕华建, 徐兴全, 等. 骨钙素调节糖代谢的研究进展[J]. 中国病理生理杂志, 2013, 29: 952–956. DOI:10.3969/j.issn.1000-4718.2013.05.033 |
| [9] | Gu PY, Yu F, Jin S, et al. Analysis of serum undercarboxylated osteocalcin level in rats with type 2 diabetes mellitus and the correlation with cognitive impairment[J]. Exp Ther Med, 2017, 14: 2603–2607. DOI:10.3892/etm.2017.4838 |
| [10] | Ferron M, Hinoi E, Karsenty G, et al. Osteocalcin differentially regulates cell and adipocyte gene expression and affects the development of metabolic diseases in wild-type mice[J]. Proc Natl Acad Sci USA, 2008, 105: 5266–5270. DOI:10.1073/pnas.0711119105 |
| [11] | Schwetz V, Pieber T, Obermayer-Pietsch B. The endocrine role of the skeleton: background and clinical evidence[J]. Eur J Endocrinol, 2012, 166: 959–967. DOI:10.1530/EJE-12-0030 |
| [12] | Sabek OM, Nishimoto SK, Fraqa D, et al. Osteo-calcin effect on human -cells mass and function[J]. Endocrinology, 2015, 156: 3137–3146. DOI:10.1210/EN.2015-1143 |
| [13] | Hygum K, Starup-Linde J, Harslof T, et al. Mechanisms in endocrinology:diabetes mellitus, a state of low bone turnover—a systematic review andmeta-analysis[J]. Eur J Endocrinol, 2017, 176: R137–R157. DOI:10.1530/EJE-16-0652 |
| [14] | Hwang YC, Jeong IK, Ahn KJ, et al. The uncarboxylated form of osteocalcin isassociated with improved glucose tolerance and enhanced β-cell function inmiddle-aged male subjects[J]. Diabetes Metab Res Rev, 2009, 25: 768–772. DOI:10.1002/dmrr.1045 |
| [15] | Bilotta FL, Arcidiacono B, Messineo S, et al. Insulin and osteocalcin: further evidence for a mutual cross-talk[J]. Endocrine, 2018, 59: 622–632. DOI:10.1007/s12020-017-1396-0 |
| [16] | De Luis DA, Perez Castrillon JL, Aller R, et al. Response of osteocalcin and insulin resistance after a hypocaloric diet in obese patients[J]. Eur Rev Med Pharmacol Sci, 2015, 19: 2174–2179. |
| [17] | Rui X, Xu B, Su J, et al. Differential pattern for regulating insulin secretion, insulin resistance, and lipid metabolism by osteocalcin in male and female T2DM patients[J]. Med Sci Monit, 2014, 20: 711–719. DOI:10.12659/MSM.890130 |
| [18] | Wang Q, Zhang B, Xu Y, et al. The relationship between serum osteocalcin concentration and glucose metabolism in patients with type 2 diabetes mellitus[J]. Int J Endocrinol, 2013: 842598. |
| [19] | Ducy P. The role of osteocalcin in the endocrine cross-talk between bone remodelling and energy metabolism[J]. Diabetologia, 2011, 54: 1291–1297. DOI:10.1007/s00125-011-2155-z |
| (收稿日期:2019-03-13) |

